铜死亡是一种新发现的程序性细胞死亡形式,在肿瘤发生中起着重要作用。然而,铜死亡与铁死亡之间的相互关系尚不清楚。在作者的研究中,作者探索了来自癌症基因组图谱(TCGA)和基因表达数据库(GEO)的1162个肺腺癌(LUAD)样本中的基因组改变,全面评估了铜死亡调节因子。
1. LUAD中的铜死亡调节因子的遗传和转录改变
这项研究的工作流程如图1所示。作者的研究分析了14个铜死亡调节因子。为了揭示铜死亡调节因子的遗传变异,作者简要概述了恶性肿瘤中非沉默性体细胞突变的发生情况。在TCGA的UCEC、BLCA和CESC队列中,铜死亡调节因子的突变发生率适中,但在UVM中较低。在561个LUAD样本中,67个(11.94%)携带了铜死亡调节因子的突变(图2A)。最高的突变频率出现在ATP7A(4%)和ATP7B(3%),而LIAS、LIPT1、GCSH、PDHB、LIPT2和SLC31A1没有发现突变。GCSH、ATP7B、DBT、ATP7A和DLST之间存在显著的突变共存。然而,在TCGA-LUAD队列中,患者是否携带突变与生存差异无关。作者检测了铜死亡调节因子的染色体位置,如图2B所示。在TCGA-LUAD队列中,作者分析了铜死亡调节因子在癌旁非肿瘤组织和LUAD样本中的mRNA表达(图2C)。在非小细胞肺癌(A549)和正常肺上皮细胞(BEAS-2B)中分析了铜死亡调节因子的表达(图2D)。此外,通过CNV改变频率的研究发现,在LIPT2、SLC31A1和DLD中存在高频率的CNV增益。为了发现遗传变异与mRNA表达之间的关系,作者发现CNV增益的LIAS表现出高的mRNA表达(图2C)。有趣的是,CNV损失频率较高的DBT和FDX1表达也较高。
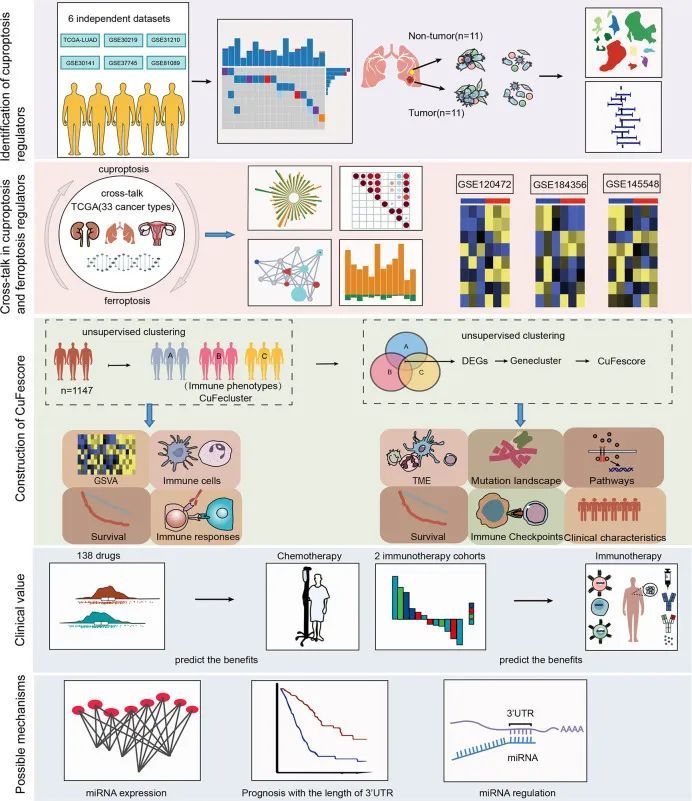
图1 工作流程
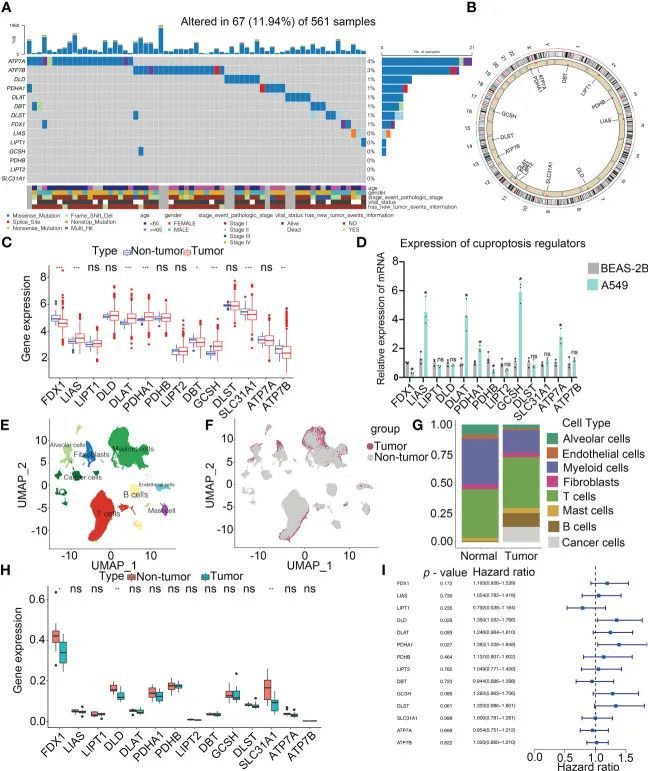
图2 LUAD中铜死亡调节因子的遗传和表达变异景观
单细胞组织分析已成为评估恶性肿瘤中不同细胞类型临床相关性的重要工具。经过质量控制,作者分析了来自11个LUAD和11个非肿瘤样本的208,506个细胞的全转录组数据库。根据细胞特异性标记物,作者确定了8种细胞类型,包括肺泡细胞、B细胞、癌细胞、成纤维细胞、髓系细胞、T细胞、内皮细胞和肥大细胞(图2E)。所有的肿瘤细胞都来自肿瘤样本(图2F、G)。值得注意的是,T细胞在正常组织和癌组织样本中占所有细胞亚群的最大比例(图2G)。根据scRNA-seq的分析,FDX1、DLD和SLC31A1在非肿瘤组织中的表达要比肿瘤组织高得多,这与作者从大规模测序分析中的发现一致(图2H)。单变量Cox回归分析确定了LUAD患者中铜死亡调节因子的预后意义(图2I)。低水平的9个铜死亡调节因子与LUAD患者的高OS率密切相关。因此,作者的结果表明非肿瘤和LUAD样本之间的遗传景观和铜死亡调节因子表达的高度异质性,暗示铜死亡调节因子表达不平衡在LUAD中至关重要。
2. 鉴定出铜死亡和铁死亡调节因子之间的新的相互连接
为了探索不同细胞死亡途径之间的潜在相互连接性,作者研究了铜死亡和铁死亡调节因子之间的相互作用。作者获取了来自TCGA的33种癌症类型的全基因组组学数据进行分析。作者发现,在33种癌症类型中,大多数铜死亡和铁死亡调节因子的突变频率相当(图3A)。此外,作者的研究结果表明铜死亡调节因子与铁死亡调节因子之间存在强烈的相关性(图3B)。铜死亡调节因子与来自GeneMANIA数据库的铁死亡调节因子相互作用(图3C)。为了确定参与相互连接性的核心调节因子,作者进行了WGCNA分析,以识别在33种癌症类型中的铜死亡调节因子和铁死亡调节因子中的核心基因(图3D)。有趣的是,在不同癌症中,核心铜死亡调节因子的数量与核心铁死亡调节因子的数量强相关(R = 0.86;图3E),这表明在不同癌症中铜死亡调节因子和铁死亡调节因子之间可能存在相互作用。作者还研究了不同癌症中典型致癌途径的活性。为了验证铜死亡和铁死亡调节因子之间的关系,作者分析了先前研究中几个铁死亡调节因子敲除后铜死亡调节因子的表达情况。在GSE120472队列中,敲除小鼠原代胚胎成纤维细胞(MEFs)中的Pten导致Dbt、Slc31a1和Atp7a等3个铜死亡调节因子的上调。在GSE184356队列中,TFAM的敲除导致人皮肤成纤维细胞中PDHA1、PDHB、ATP7A和ATP7B的显著变化。在GSE145548队列中,ATF2的敲除导致乳腺癌细胞MCF7中铜死亡调节因子(DLST、GCSH、PDHA1、LIPT1和DLD)的显著变化。此外,作者将siRNA和shRNA转染到A549细胞中,以验证铜死亡和铁死亡调节因子之间的相关性。PTEN敲除后SL31A1的表达上调,TFAM敲除后ATP7A的水平增加,ATF2敲除后LIPT1受到抑制(图3F),表明铜死亡和铁死亡调节因子之间存在强烈的关联。因此,作者的结果表明了癌症中铜死亡和铁死亡调节因子之间的相互作用和生物调控。
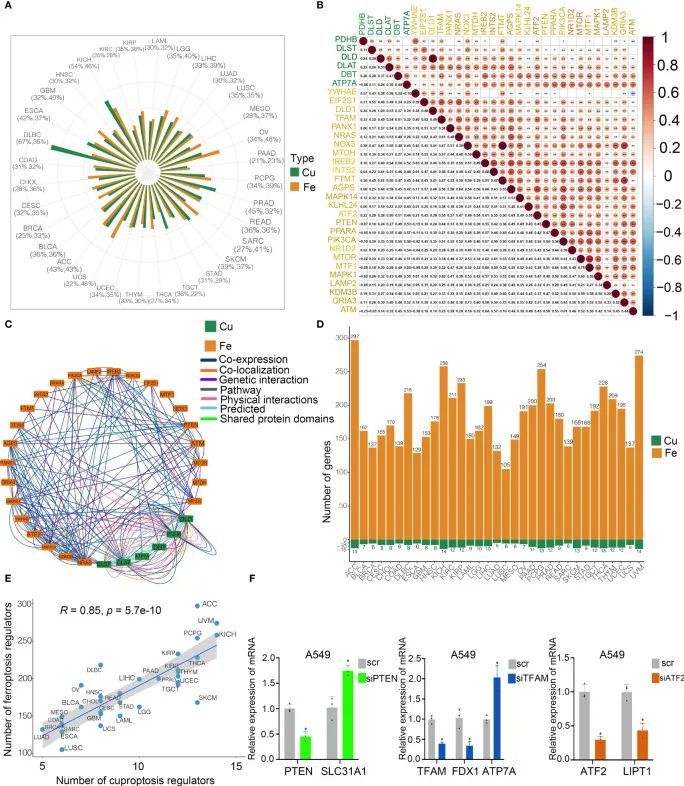
图3 癌症中鉴定出交叉对话在铜死亡和铁死亡调节因子之间的存在
3. TME细胞浸润特征在铜死亡和铁死亡调节因子的不同模式中
通过基于铜死亡和铁死亡调节因子水平的无监督聚类分析,将来自6个队列(TCGA,GSE30219,GSE31210,GSE3141,GSE37745和GSE81089;n = 1147)的患者分为三个亚型,命名为CuFecluster A/B/C。主成分分析显示3个聚类之间存在明显的区别(图4A)。与CuFecluster A和C相比,CuFecluster B的患者预后更有利(p < 0.001,图4B)。对来自6个不同队列的1147名患者进行GSVA富集通路分析,以确定3个CuFecluster的生物功能。与CuFecluster A和C相比,CuFecluster B与免疫完全激活相关,包括B细胞受体信号通路、自然杀伤细胞介导的细胞毒作用、抗原处理和呈递、细胞因子-细胞因子受体相互作用和趋化因子信号通路(图4C,D)。此外,CuFecluster B富含各种活化的免疫细胞浸润(图4E)。考虑到相应的生存优势,CuFecluster B被归类为免疫炎症表型。该表型的特点是存在适应性免疫细胞浸润和免疫激活。CuFecluster A与几个细胞增殖过程相关,尤其是错配修复、DNA复制和细胞周期(图4C),而CuFecluster A与先天免疫细胞(包括MDSC、嗜酸性粒细胞、自然杀伤细胞、单核细胞、肥大细胞和巨噬细胞)的相关性较高(图4E)。有趣的是,CuFecluster A还与TGF-β家族成员和TGF-β家族成员受体高度相关(图4F)。先前的研究表明,免疫排除表型的特点是存在大量免疫细胞和TGF-β信号通路活性升高,然而免疫细胞无法穿透肿瘤的实质部分,因为它们受到包围肿瘤细胞巢的基质的阻碍。因此,确定CuFecluster A代表了免疫排除亚型。此外,发现CuFecluster C获得了较少的免疫细胞和被抑制的免疫反应(图4D-F),与免疫荒漠表型的主要特征相符。因此,在肿瘤微环境的细胞浸润特征方面,这三种CuFecluster之间存在显著差异。
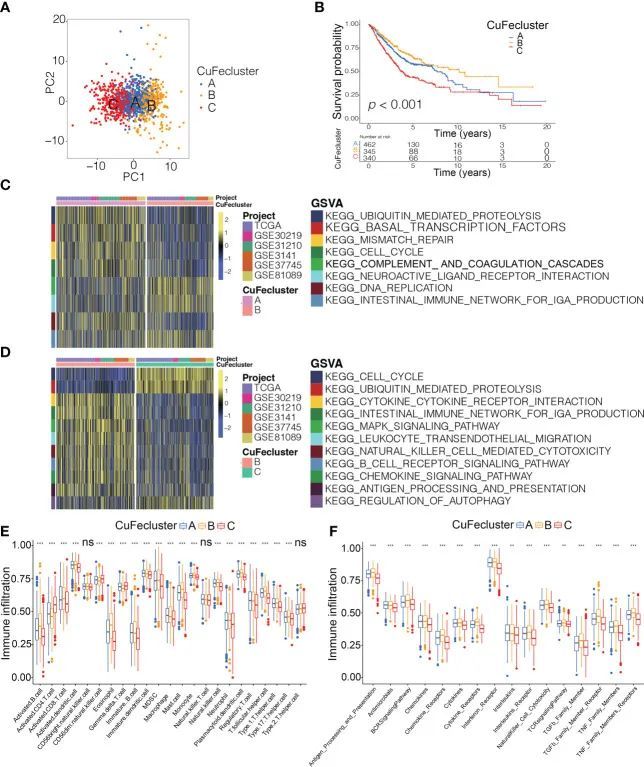
图4 不同CuFe亚型中的肿瘤微环境细胞浸润特征和转录组特征
4. 鉴定与铜死亡/铁死亡调控相关的基因亚型并建立CuFescore评分系统
为了评估不同的铜死亡/铁死亡亚组的可能基因修饰,作者得到了108个重叠的差异表达基因(图5A),并通过单变量Cox回归分析发现了105个具有预后意义的差异表达基因。作者进行了无监督聚类分析,并将患者分为3个独特的基因组亚型,作者将其称为基因亚型A/B/C。值得注意的是,与其他亚型相比,基因亚型A的预后显著改善(p < 0.001,图5B)。尽管作者的研究显示了与铜死亡/铁死亡相关的基因改变与预后有关,但作者根据铜死亡/铁死亡相关差异表达基因的表达生成了预测个体患者铜死亡和铁死亡修饰的应用分数。流图说明了CuFescore建立过程中涉及的步骤(图5C)。作者发现,在评估中,CuFe亚型B(图5D)和基因亚型A(图5E)的患者具有较低的CuFescores。此外,作者还检查了这3个不同亚型的重叠部分。CuFe亚型A占36个。高CuFescore组中的患者中有6%,而低CuFescore组中有52.4%的样本与CuFecluster B重叠(图S5A)。同时,在高CuFescore组中,55%的病例与基因cluster B重叠,而在低CuFescore组中,82%的病例与基因cluster A重叠。与高CuFescore的队列生存率相比,低CuFescore的亚组有更好的生存概率(70% vs 52%,图5F),与早期(T1-2)和晚期(T3-4)肺癌的发现相当。与此发现一致,存活病例的平均CuFescore明显低于死亡病例(图5G)。Kaplan-Meier分析显示低CuFescore组的患者预后更好(p < 0.001,图5H)。通过在4个独立的LUAD队列中验证预后价值,验证了CuFescore模型的稳定性。低CuFescore组中富集的通路包括DNA复制、错配修复和细胞周期(图5I)。此外,研究显示,CuFe得分低的患者与早期临床和病理特征以及分期有相关性(图5J),这表明这些个体具有CuFe亚型B和免疫炎症亚型所表现的生存优势。此外,基于时间的AUC曲线确定CuFe得分在4个队列中作为LUAD患者生存期的预测生物标志物(图5K)。因此,这些数据表明CuFe得分与LUAD患者的预后有关。
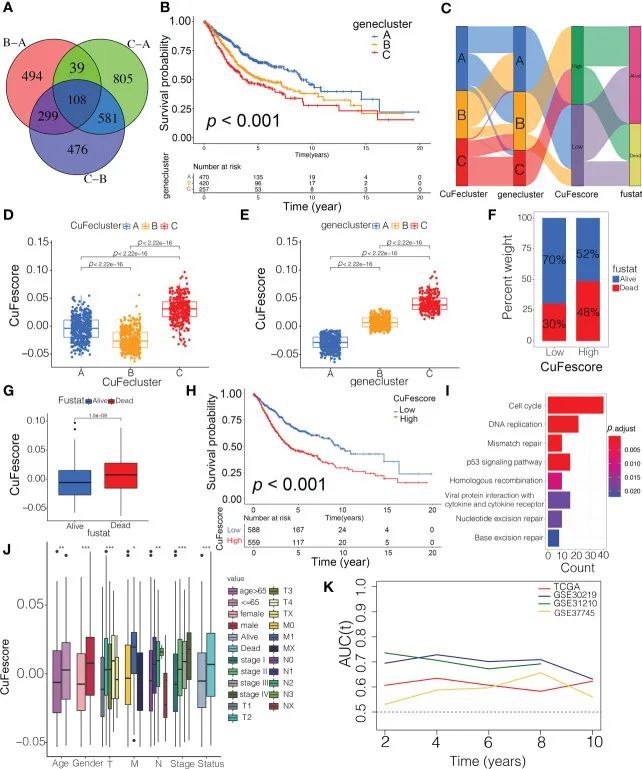
图5 CuFescore的构建和CuFescore的预后价值
5. CuFescore与免疫检查点之间的关联
基于与免疫相关通路的强相关性,包括免疫检查点、CD8 T效应细胞和抗原处理机制,作者假设CuFescore与免疫疗法相关。在本研究中,作者检查了肿瘤突变负荷(TMB)和免疫检查点等与免疫疗法相关的参数。与低CuFescore组相比,高CuFescore组的TMB较高(p = 2.8e-16;图6A)。此外,CuFescore与TMB也呈正相关(R = 0.45,p < 2.2e-16,图6B)。低TMB亚组和高TMB亚组之间没有差异(p = 0.084,图6C)。通过结合CuFescore和TMB,作者发现低CuFescore和高TMB患者具有良好的预后(p < 0.001,图6D)。CuFescore与肿瘤浸润免疫细胞(TIICs)相关,包括活化树突状细胞、活化CD4 T细胞、CD8 T细胞以及活化B细胞。作者还评估了两个CuFescore组之间的肿瘤微环境细胞的差异。研究结果显示,低CuFescore表明M0和M1巨噬细胞、激活的T细胞CD4记忆型、T细胞CD8、静止的NK细胞、中性粒细胞和激活的肥大细胞的浸润水平升高,而高CuFescore则表明巨噬细胞、激活的CD4 T细胞和激活的肥大细胞水平升高(图6E,F),这表明低CuFescore的患者存在免疫激活。总体而言,作者的研究结果证明了CuFescore与TMB和浸润免疫细胞等免疫特征之间的关联。
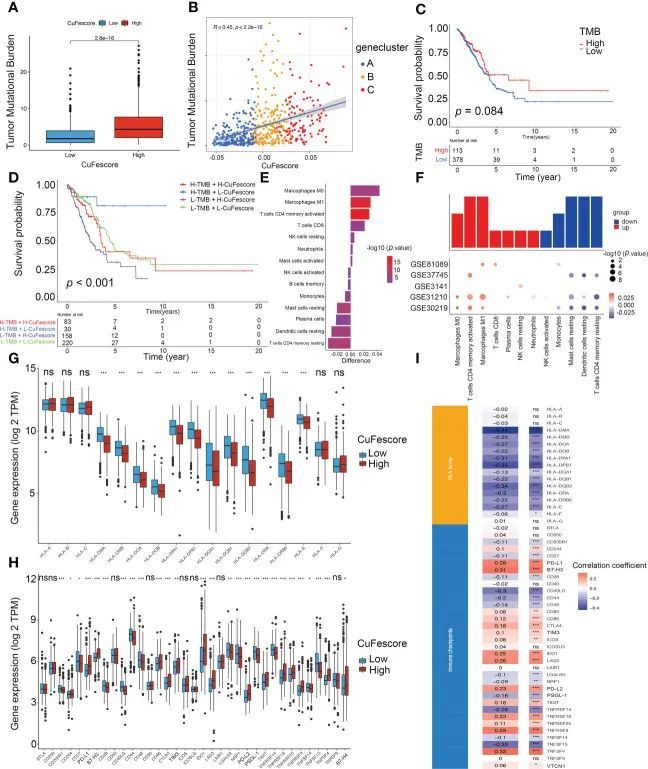
图6 CuFescore和免疫检查点之间的相关性
Wilcoxon检验表明,就12个HLA家族基因的表达(图6G)和27个免疫检查点(图6H)而言,2个CuFescore组之间存在显著差异。此外,CuFescore与13个HLA家族基因和29个免疫检查点的表达显著相关(图6I)。因此,数据显示CuFescore与肿瘤免疫检查点密切相关。
6. 高CuFescore组和低CuFescore组的突变状态
为了进一步研究CuFescore与LUAD中的突变之间的相关性,作者确定了TCGA队列中高和低CuFescore组之间的体细胞突变。经常发生突变的基因显示在图7A、B中。值得注意的是,发现在高CuFescore患者中20个基因的突变频率更高(图7C)。此外,在低CuFescore组(图7D)和高CuFescore组(图7E)中,这些基因的突变之间存在显著的共存。
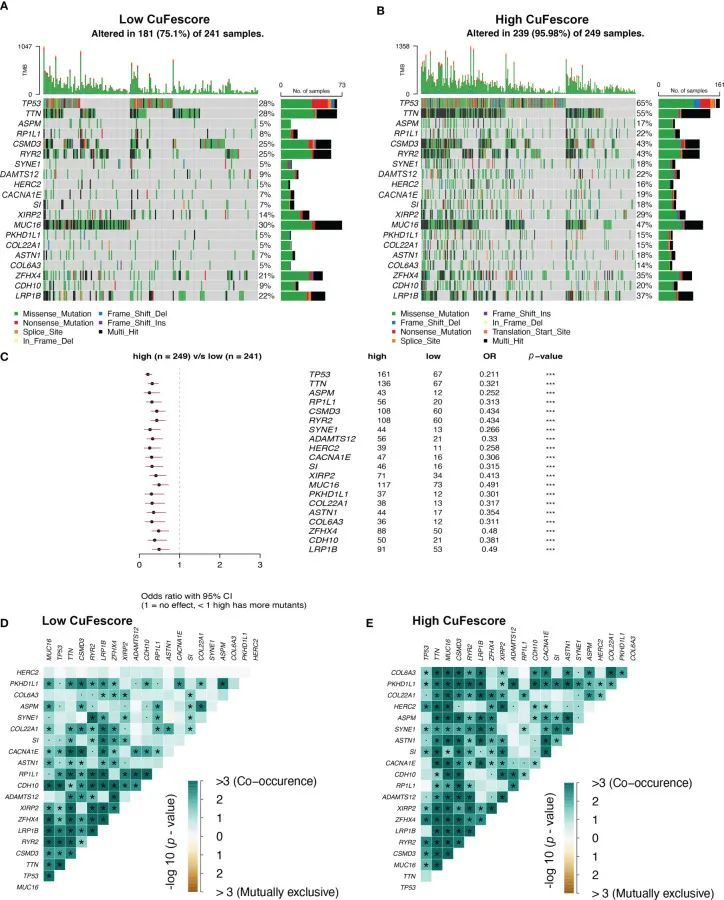
图7 CuFescore与肿瘤突变状态之间的关联
7. CuFescore预测了化疗和免疫疗法的益处
为了评估CuFescore在预测化疗药物反应性方面的价值,计算了138种药物的IC50值(图8A)。CuFescore较低的患者对阿昔替尼具有较强的敏感性(p = 0.0014,图8B),对厄洛替尼也具有较强的敏感性(p < 0.001,图8C),而高CuFescore组的患者对多西他赛(p < 0.001,图8D)和吉西他滨(p < 0.001,图8E)具有较强的敏感性,这表明CuFescore可能作为LUAD药物的预测生物标志物。
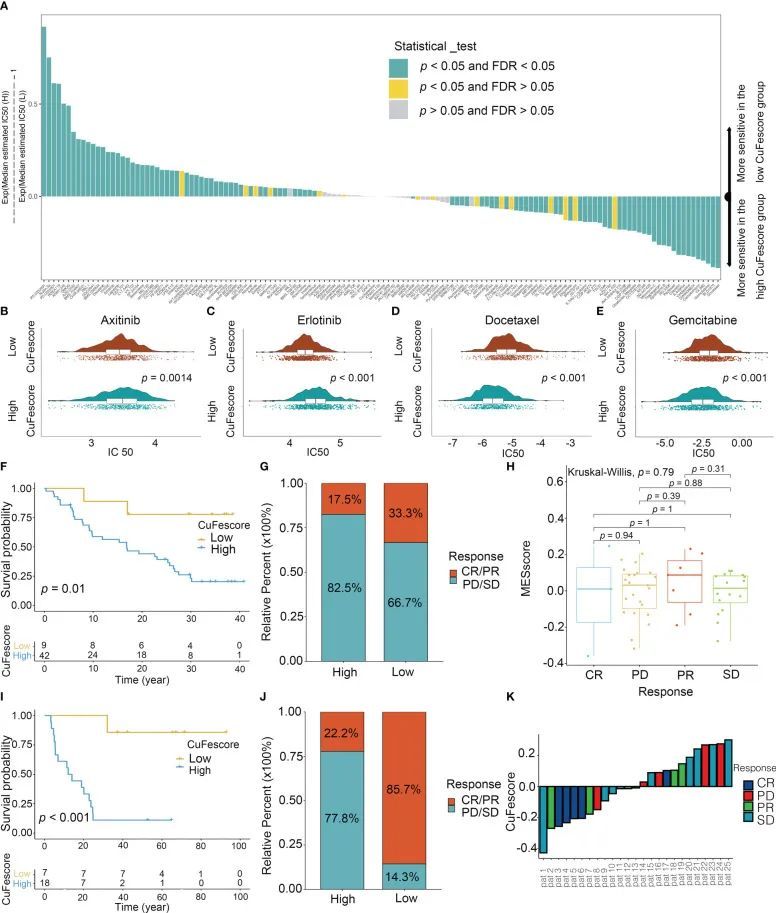
图8 CuFescore在化疗和免疫疗法中的作用
为了探索CuFescore在免疫检查点阻断(ICB)治疗反应方面的预测价值,作者分析了两个免疫疗法队列(GSE91061和GSE100797)中的CuFescore。作者根据铜死亡/铁死亡调节基因的水平计算接受免疫疗法的患者的CuFescore,并将其分为高CuFescore组和低CuFescore组。在GSE91061队列中,低CuFescore组的患者在接受抗CTLA4和抗PD1治疗时有更好的预后(p = 0.01,图8F)。低CuFescore组的患者表现出显著的治疗效益,并对PD-1阻断具有改善的免疫敏感性(响应者/非响应者:33.3%/17.5%,图8G),尽管完全缓解(CR)、进展性疾病(PD)、部分缓解(PR)和稳定疾病(SD)患者之间的CuFescore没有差异(图8H)。此外,这一发现在GSE100797中也得到了验证。低CuFescore组的患者具有较长的生存期(图8I)和显著更好的治疗结果(响应者/非响应者:85.7%/22.2%,图8J)。通过验证,与高CuFe分数的患者相比,低CuFe分数的患者对采用T细胞治疗有显著的临床反应(图8K)。总的来说,CuFe分数与肿瘤免疫表型有显著相关性,并且在预测患者对ICB治疗的反应性方面具有有效性。
8. CuFescore与miRNA和转录后调控相关
CuFescore是一种基于铜死亡和铁死亡调节因子的评估系统,这些因子存在于转录后修饰的关联中。为了评估CuFescore在转录和转录后事件解释中的调节作用,作者分析了APA事件。鉴于APA处理的转录本具有较短的3'UTR,因此能够容忍miRNA的调节,作者假设CuFescore与miRNA的表达密切相关,可能是APA事件作用下的潜在机制。在TCGA-LUAD队列中,作者检测到高CuFescore组和低CuFescore组之间有79个差异表达的miRNA。miRNA靶向基因在自噬、ROS信号通路、MAPK信号通路和其他通路中有富集现象(图9A)。在与自噬相关的56个miRNA靶向基因中,有29个基因的表达水平升高。此外,在高CuFescore组中,miRNA靶向基因中的cGMP-PKG信号通路(11/22)和cAMP信号通路(11/23)的表达水平降低。根据所获得的研究结果,CuFescore与miRNA的表达以及信号通路的调节存在非常强的关联。
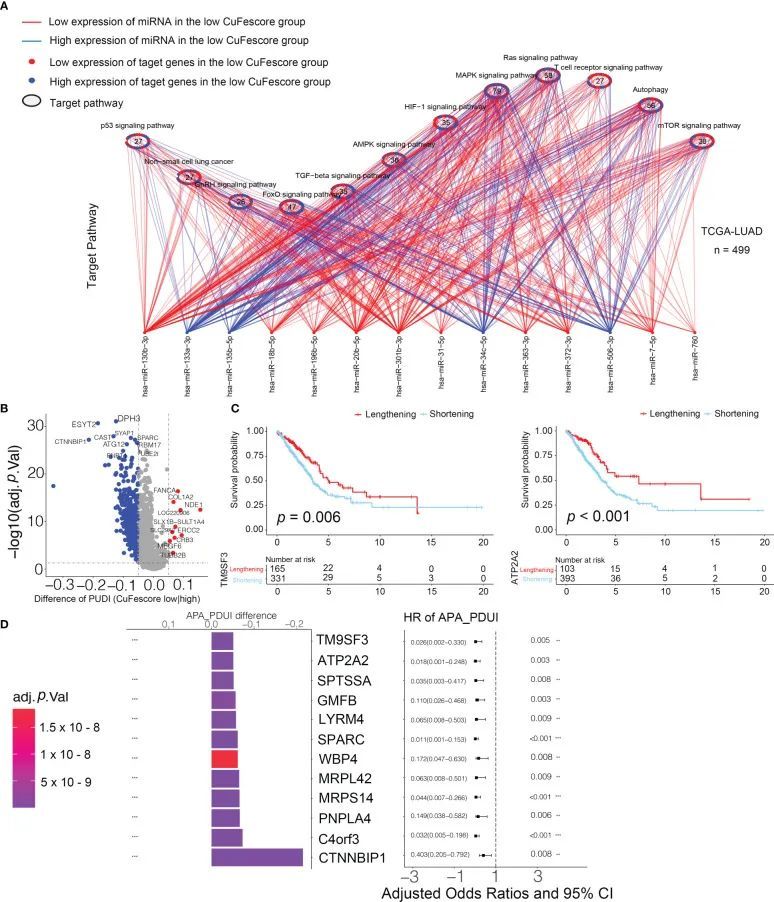
图9 CuFescore与转录后特征之间的关联
作者研究了APA事件,以发现CuFescore与转录后特征之间的联系。作者发现了高CuFescore组和低CuFescore组之间APA差异的基因,并检查了其预后意义,以显示LUAD患者的生存是否受到3'UTR长度的影响(图9B)。APA事件延长的基因在低CuFescore组中,与延长生存一致(图9C)。TM9SF3和ATP2A2在白血病、三阴性乳腺癌和弥漫性星形细胞瘤中被认为是原癌基因。两个基因的短转录本与个体的预后较差有关(图9D)。此外,TM9SF3在3'UTR上直接被miR-1193靶向。作者的印象是,由于基因的3'-UTR已经缩短,miRNA可能无法结合到基因上,从而消除对原癌基因的抑制作用,促进LUAD的进展。
总结
总之,作者建立了一个CuFescore模型来预测LUAD患者的预后,该模型与免疫检查点和突变密切相关。CuFescore是一个应用评分系统,用于评估对化疗药物的敏感性,并确定适合免疫治疗的LUAD患者。







![2023年中国彩色滤光片竞争格局、市场规模及行业技术趋势分析[图]](https://img-blog.csdnimg.cn/img_convert/ceeb8dd9cab4741fae2ea7a94108887a.png)