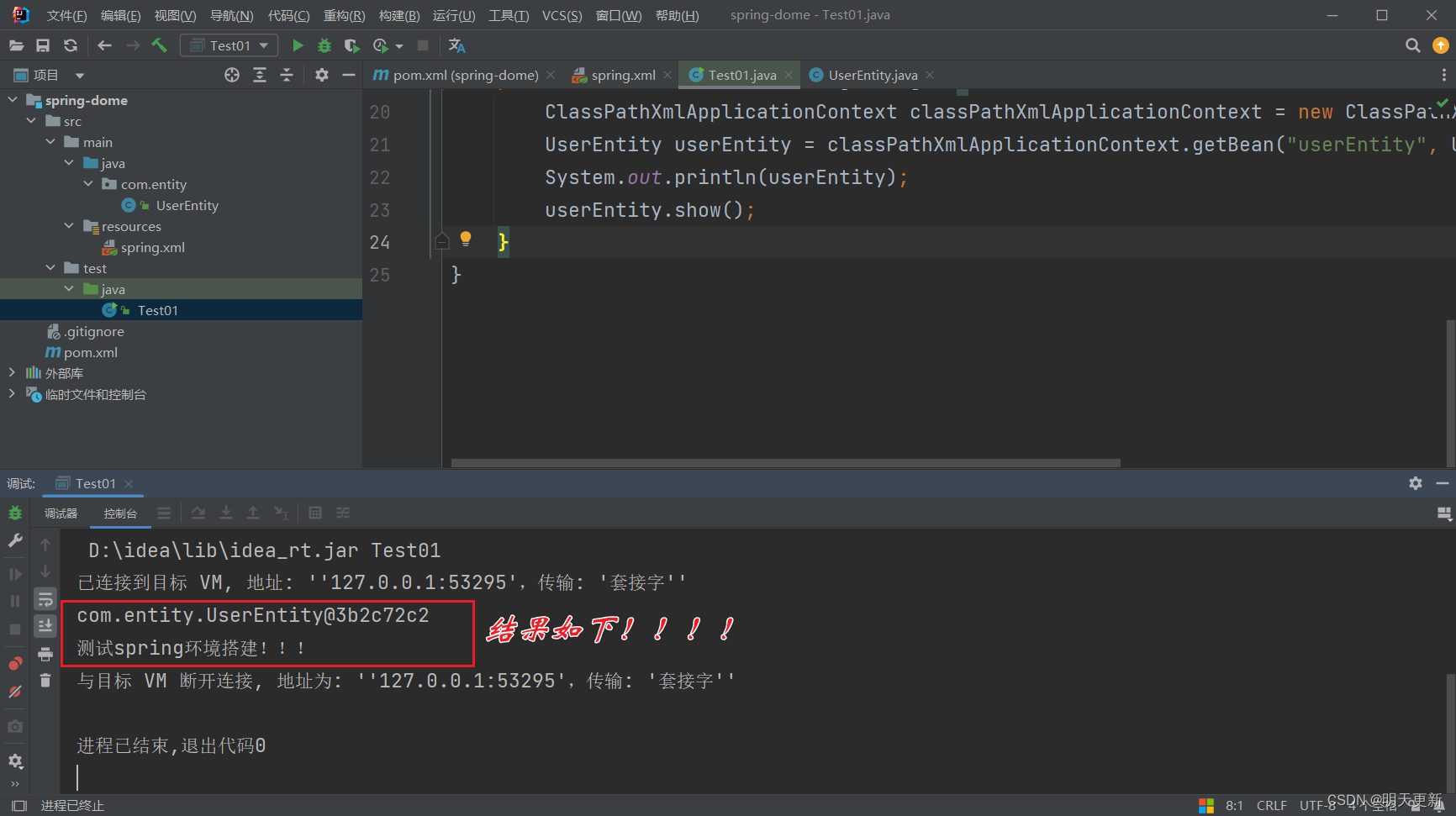
👊
- 溶液=溶质+溶剂;浓度= 溶质 溶液 \frac{溶质}{溶液} 溶液溶质×100%= 溶质 溶质 + 溶剂 \frac{溶质}{溶质+溶剂} 溶质+溶剂溶质×100%。
- 重要等量关系
①浓度不变准则:将溶液分成若干份,每份的浓度相等,都等于原来溶液的浓度;将溶液倒掉一部分后,剩余溶液的浓度与原溶液的浓度相等。
②物质守恒准则:物质(无论是溶质、溶剂,还是溶液)不会增多也不会减少,前后都是守恒的。 - 解题思路
①“稀释”问题:特点是增加“溶剂”,解题关键是找到始终不变的“量”–—“溶质”。
②“浓缩”问题:特点是减少“溶剂,解题关键是找到始终不变的“量”——“溶质”。
③“加浓"问题:特点是增加“溶质”,解题关键是找到始终不变的“量”——“溶剂”。
④“配制”问题:是指两种或两种以上的不同浓度的溶液混合配制成新的溶液(成品)。
⑤“置换”问题:一般是用溶剂等量置换溶液,原来溶液v升,倒出m升,再补等量的溶剂(水),则浓度为原来的 v − m v \frac{v-m}{v} vv−m。
⛲️
浓度问题命题灵活多样,公式使用为根基,在处理问题时往往以浓度计算公式为核心,同时会涉及比例问题的解题技巧以及交叉法的使用。
1.基本公式
溶液
=
溶质
+
溶剂
溶液=溶质+溶剂
溶液=溶质+溶剂
浓度 =
溶质
溶液
\frac{溶质}{溶液}
溶液溶质×100%=
溶质
溶质
+
溶剂
\frac{溶质}{溶质+溶剂}
溶质+溶剂溶质×100%
溶质
=
溶液
×
浓度
溶质=溶液×浓度
溶质=溶液×浓度
溶剂
=
溶液
×
(
1
−
浓度
)
溶剂=溶液×(1-浓度)
溶剂=溶液×(1−浓度)
2.重要等量关系
(1)浓度不变准则:将溶液分成若干份,每份的浓度相等,都等于原来溶液的浓度;将溶液倒掉一部分后,剩余溶液的浓度与原溶液的浓度相等。
(2)物质守恒准则:物质(无论是溶质、溶剂,还是溶液)不会增多也不会减少,前后都是守恒的。
3.重要命题思路
(1)“稀释“”问题:特点是加溶剂,溶质不变,以溶质为基准进行求解。
(2)"浓缩”问题:也称“蒸发”问题,特点是减少溶剂,溶质不变,以溶质为基准进行求解。
(3) “加浓”问题:特点是增加溶质,溶剂不变,以溶剂为基准进行求解。
(4)"混合”问题:用两种或多种溶液混合在一起,采用溶质或溶剂质量守恒分析,也可利用杠杆原理分析。
(5)"置换”问题:一般是用溶剂等量置换溶液,可以记住结论,原来溶液v升,倒出m升,再补等量的溶剂(水),则浓度头原来的
v
−
m
v
\frac{v-m}{v}
vv−m。
⛲️
交叉法
当出现一个整体分为两部分时,可以采用交叉比例法。
交叉法是应用题中一类技巧方法,运用巧妙关键在于,应用时机的把握以及最后的比值确定。
当一个整体按照某个标准分为两部分时,可以根据杠杆原理得到交叉法,快速求出两部分的数量比。另外,交叉法的应用不局限于平均值问题,只要涉及一个大量,一个小量以及它们混合后的中间量,一般都可以利用交叉法算出大量与小量的比例。
⛲️
一、考点讲解
- 溶液=溶质+溶剂
- 浓度 = 溶质 溶液 \frac{溶质}{溶液} 溶液溶质×100%= 溶质 溶质 + 溶剂 \frac{溶质}{溶质+溶剂} 溶质+溶剂溶质×100%
- 溶质 = 溶液 × 浓度 溶质=溶液×浓度 溶质=溶液×浓度
- 溶剂 = 溶液 × ( 1 − 浓度 ) 溶剂=溶液×(1-浓度) 溶剂=溶液×(1−浓度)
二、考试解读
- 溶液的浓度问题是考生的薄弱点,因为考题比较抽象。
- 此类问题的关键点是找到溶质、溶剂、溶液、浓度的关联式,根据题目的已知信息来列方程求解。
- 此类题目又可分为:蒸发、稀释、等量置换、溶液混合等类型,要掌握每类题目的解题套路。浓度的本质是溶质占总体的百分比。根据溶质守恒,来分析浓度的变化。
- 配制问题是指两种或两种以上的不同浓度的溶液混合配制成新溶液(成品),解题关键是分析所取原溶液溶质的量等于成品溶质的量及溶液前后质量不变,找到两个等量关系。
三、命题方向
- 溶质、溶剂单一变化
思路:根据不变量列方程求解。具体分为:
(1)“稀释”问题:特点是加“溶剂”,解题关键是找到始终不变的量(溶质)。
(2)“浓缩”问题:特点是减少溶剂,解题关键是找到始终不变的量(溶质)。
(3)“加浓”问题:特点是增加溶质,解题关键是找到始终不变的量(溶剂)。 - 溶液混合
思路:如果已知每部分的浓度和混合后的浓度,采用交叉比例法求解。如果已知每部分的浓度及溶液的量,求混合后的浓度,采用权重法求解。 - 等量置换
思路:对于用溶剂等量置换溶液问题,可以记住结论:设体积为 v 升溶液,倒出 m 升,补等量的水,则浓度为原来的 v − m v \frac{v-m}{v} vv−m。 - 互相倒溶液
思路:对于多容器互相倒溶液,每倒一次,相当于混合一次,多次用交叉比例法求解即可。 - 其他等量关系
思路:可以根据溶质或溶剂来列方程,或者根据浓度的定义来分析。
PS:
等量置换:对于用溶剂等量置换溶液问题,可以记住结论:设体积为 v 升溶液,倒出 m 升,补等量的水,则浓度为原来的 v − m v \frac{v-m}{v} vv−m。
【解题思路】浓度问题主要研究溶质、溶剂、溶液的关系,浓度的本质表示溶质占总体的百分比。求解时,核心问题是溶质,很多方程都是通过溶质列等量关系。
🌊
【A】溶液 = 溶质+溶剂
(1)浓度 =
溶质
溶液
\frac{溶质}{溶液}
溶液溶质×100%=
溶质
溶质
+
溶剂
\frac{溶质}{溶质+溶剂}
溶质+溶剂溶质×100%
(2)溶质 = 浓度 × 溶液
(3)溶液 = 溶质 ÷ 浓度
【B】浓度不变准则:
(1)将溶液分成若干份,每份的浓度都相等,都等于原来的浓度。
(2)如果将溶液倒出一部分之后,剩余溶液的浓度与原溶液的浓度相同。
【C】考官重要命题思路
(1)稀释问题:特点是加溶剂稀释,溶质不变,以溶质不变列等式求解。
(2)浓缩问题:特点是溶剂减少,溶质不变,以溶质不变列等式求解.
(3)加浓问题:特点是增加溶质,溶剂不变,以溶剂不变列等式求解.
(4)蒸馏问题:特点是减少溶剂,溶质不变,以溶质不变列等式求解.
(5)混合问题:用两种浓度不同的溶液进行混合,通常使用杠杆原理交叉法。
(6)置换问题:浓度置换公式(秒杀思路)
💂
-
基本公式
溶质 溶质 + 溶剂 \frac{溶质}{溶质+溶剂} 溶质+溶剂溶质 ×100% -
溶液倒出后加满水
将某液体倒出 V 1 V_1 V1体积后,加满水搅匀,再倒出 V 2 V_2 V2体积后,加满水搅匀,得到的稀释后的液体浓度公式为:
初始浓度× 总体积 V − 体积减少量 V 1 总体积 V \frac{总体积V-体积减少量V_1}{总体积V} 总体积V总体积V−体积减少量V1× 总体积 V − 体积减少量 V 2 总体积 V \frac{总体积V-体积减少量V_2}{总体积V} 总体积V总体积V−体积减少量V2=最终浓度
注:将溶液更多次倒出后加满水得到稀释后的液体浓度可以此类推。当初始液体为纯酒精时,浓度为1。 -
两种不同溶液混合——十字交叉
两种相同成分不同浓度的溶液混合,混合前浓溶液的质量为m,溶质质量分数为a%,稀溶液的质量为n,溶质质量分数为b%,两溶液混合后的溶质质量分数为c%,根据十字交叉法(或称 “ 对角线法 ”)有:

🌐
稀释问题——解题提示:溶质守恒
常用公式:
- 浓度百分比 = 溶质 溶液 浓度百分比=\frac{溶质}{溶液} 浓度百分比=溶液溶质
- 溶质 = 溶液 × 浓度百分比
- x + y = a x+y=a x+y=a和 x b xb xb% + y c +yc +yc% = a b =ab =ab%
- 一种酒精溶液,其中纯酒精和水之比是 a : b a:b a:b(重量之比),含纯酒精为 a a + b \frac{a}{a+b} a+ba,含水为 b a + b \frac{b}{a+b} a+bb。