狨猴体型小,具有巨大的基因修饰潜力,并可表现复杂的行为,已经成为神经科学领域的一个关键模型。
德国恩斯特·斯特朗格曼神经科学研究所与马克斯·普朗克学会的研究人员设计了一种轻质的、3D打印的植入物,利用高密度硅基微电极阵列,实现了在清醒狨猴中神经记录、光遗传学和行为操纵的整合。

发表在《自然通讯》杂志上的这项研究,介绍了一种新的方法首次在清醒绒猴中实现神经记录和光遗传刺激与行为操纵结合。该方法采用3D打印技术,设计了一个轻质的钛合金腔室,可以放置多个高密度硅探针,进行半慢性记录和光遗传刺激。同时在两个视觉区域V1和V6区记录192个通道的多单元和单单元数据。并通过光遗传激活V6区神经元,影响动物在检测任务中的行为。该方法可进一步研究狨猴的感知和行为的神经基础。
植入物的设计和记录方法
3d打印允许快速的设计调整,需要较少的机械约束,并能够以低成本和较短的周转时间生产原型。3d打印的最新进展使利用医用级钛(Ti6Al4V)精确制造复杂形状成为可能,实现重量最小化和机械鲁棒性,使植入物与无线记录技术兼容,并保持在可接受的重量。
植入物由多个部分组成:头柱、腔室、微驱动器、稳定器、硅探针和固定连接器的电路板(图1a)。3d打印的钛腔室平滑匹配绒猴颅骨表面(图1a、b)。腔室里有6个带有连接器的电路板,用于传递来自两个硅探针阵列的神经信号。一个是针对V6视觉区的四针4×32通道硅探针,另一个是针对V1视觉区的双针2×32通道硅探针,共计192通道(图1a)。硅探针安装在微驱动器上,允许垂直移动5毫米。微驱动器由3d打印的钛稳定器支持,在植入后提供附加刚度。稳定器安装在靠近颅骨的位置,以减少植入时需要用骨水泥填充的间隙。探针通过小的(≈直径2mm)开颅手术植入,用透明硅胶密封(图1c)。光纤指向开颅区进行光遗传刺激,使光穿过硅胶进入组织(图1c)。为了在记录过程中稳定动物的头部,在腔室前植入了一个数控铣床的钛头柱(图1a、b)。腔室的内部由一个3d打印的尼龙盖保护,盖子到腔室由四个螺纹(M1.4螺纹直径,2mm螺纹长度)(图1a,d)固定。在5只狨猴体内植入了腔室和头柱。所有动物对植入物的耐受性良好,不需要植入后的伤口护理。使用几个月后,盖子无需更换。
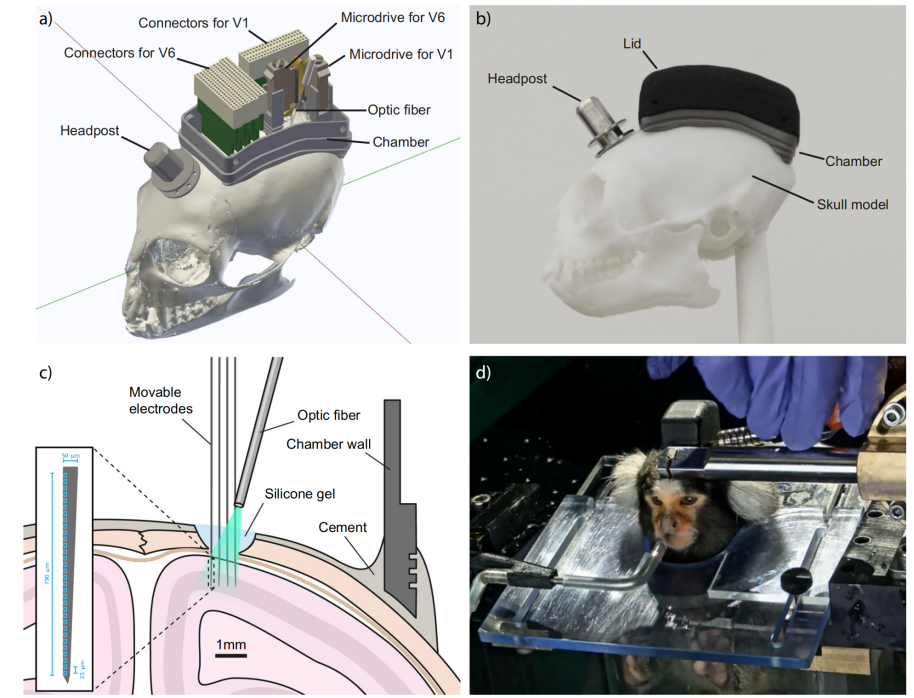
▲图1 植入物设计及记录方法
腔室设计为前后轴28 mm,颅骨中外侧轴17 mm,腔室从颅骨表面仅突出7-9mm(图2a、b)。3D打印钛的机械强度使腔室的壁厚降低到0.5-1mm,重量仅为1.5g(图2c)。头柱和稳定器的重量分别为0.91 g和0.22 g。高筒盖和扁平盖采用具有高耐磨性的聚酰胺(PA12尼龙)打印,重量分别为0.93 g和2.0 g。因此,植入物的总重量仅为≈8g,包括头柱、腔室、硅探针、微驱动器、稳定器、连接器和水泥。

▲图2 植入物尺寸和重量
注射病毒载体和植入硅探针
在V6区进行~1.5 mm的硬脑膜切开术,并注射病毒载体(图3a)。将3d打印的植入支架放入腔室。支架夹持植入所需的所有必要组件:连接器电路板、带探针的V1微驱动器和带探针的V6微驱动器,各组件能够在z轴上独立运动。连接器电路板处于最低位置,首先植入(图3b),通过微操作器放置在颅骨骨水泥层的上方,然后进行骨水泥固定。固化后,去除固定连接器电路板的植入支架部分(图3c)。接下来,植入V6区的探针阵列,探针宽25-50µm,厚15µm。将探针缓慢插入皮层的浅表部分(<500µm)后,将带有稳定器的微驱动器粘结到腔室中。随后,移除固定V6微驱动器的植入支架部分。对V1区进行同样的操作,完全取出植入支架(图3d),用硅胶密封。通过CT扫描(图3e-g)检查微驱动器和电路板的位置。连接器和微驱动器的金属部分呈绿色,颅骨为半透明的灰色,基于MRI模板拟合的大脑为红色。

▲图3 注射病毒载体和植入硅探针
同时记录V1和V6区
在V1和V6区域的记录位点上都可以看到spike活动(图4a)。通过多单元活动(MUA)进行感受野(RF)映射。感受野是由不同方向和大小的黑色楔形和环状组成的刺激,在灰色背景上呈现。当狨猴保持注视中心注视点时,闪烁环形和楔形刺激,以120 Hz的刷新率在显示器上显示。狨猴处于光线昏暗的录音室,距离显示器45厘米。V1区的感受野位于右下视野(图4b)。接下来,研究人员向动物展示静态光栅。使用光栅进行视觉刺激后在多个记录位点均可见spike活动,并在刺激开始后不久达到峰值(图4c,d)。基线期和刺激周期分别定义为刺激开始后的−0.25~0s和0~0.65s。如果刺激前基线(-0.25-0s)和刺激后(0-0.65s)之间的多单元活动有显著差异,则认为该位点处具有视觉调节。
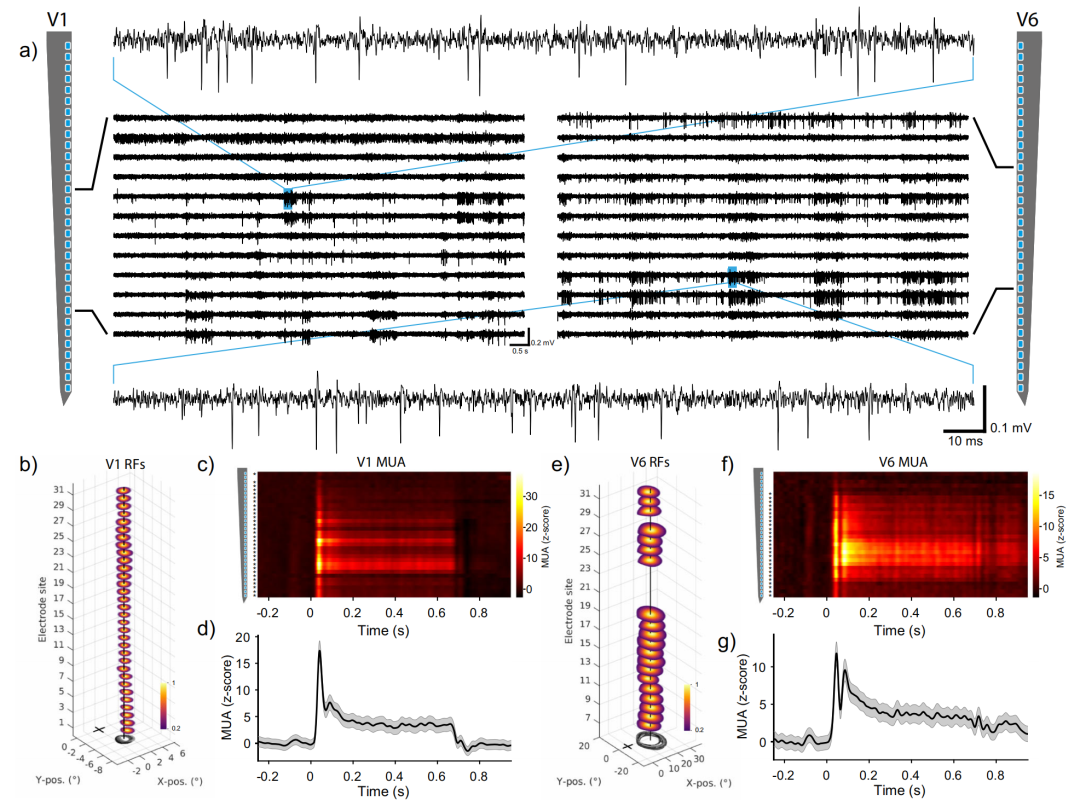
▲图4 V1和V6区的神经记录
V6区的光遗传刺激
研究人员将腺相关病毒载体(AAV)注射到V6区,在CamKIIα启动子控制下表达快速通道视紫红质变体“Chronos”。CamKIIα启动子控制下的表达仅限于兴奋性神经元。表达数周后,在V6上方放置一根光纤(50μm/ 0.22NA),以刺激透明硅胶下方的神经元。光纤连接到一个光纤套管(内径200µm,0.39 NA)。在记录/刺激过程中,套管由微操纵器夹持,并位于开颅手术上方~4 mm处。光纤耦合到一个激光束组合器上,包含一种波长为505 nm的100 mW二极管激光器(LuxXplus 505-100),和一种波长为594 nm的100 mW DPSS激光器(OBIS 594-100),可以用任意波形直接调制。研究人员用峰值振幅为25mW的正弦波进行刺激,光遗传诱导spike(图5a,b)。图5d,e以80Hz正弦模式进行光遗传刺激,正弦波在波谷处从0 mW的强度平稳开始,峰值振幅为25 mW。单神经元spike与激光刺激时间精确锁定,在刺激频率的倒数(1/80 Hz=12.5 ms)处有显著的峰值。
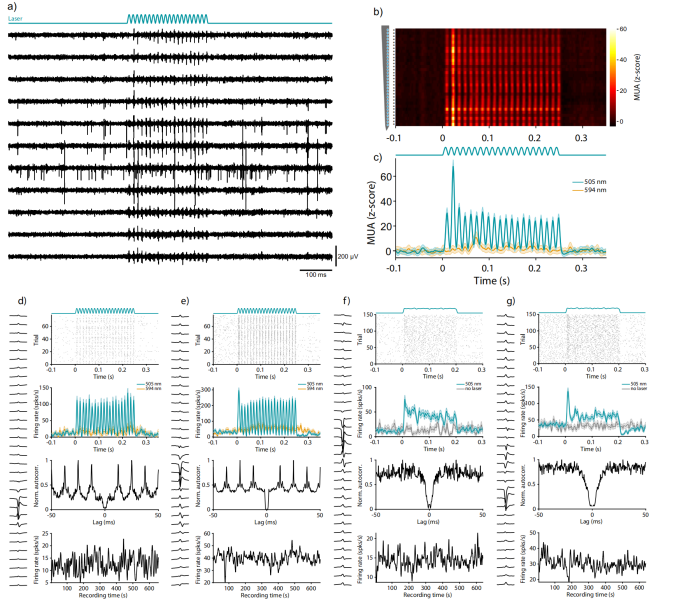
▲图5 清醒绒猴神经元的光遗传激活
光遗传刺激的行为操纵
研究人员训练了一只猴子进行视觉和光遗传学检测任务。要求猴子在一个中心固定点上短暂地保持固定100-150 ms。之后,呈现一个全屏圆形光栅的背景刺激,与注视点同心,向注视点收缩或扩张。在背景刺激开始后150-320 ms,一个低或高对比度的移动视觉目标呈现250 ms。该目标的运动路径中心在具有明显光遗传调制的记录位点的感受野范围内。这些目标试验中有一半随机配对光遗传刺激(250 ms 矩形脉冲,25 mW振幅,与视觉刺激同时开始)。另一半,在没有视觉目标的情况下进行光遗传刺激。若猴子在视觉和/或光遗传学刺激开始时间后500ms内扫视离开固定点,则给予奖励。为了防止误判,40%的试验中既没有光遗传刺激,也没有出现视觉目标。在这些试验中,猴子若保持注视800 ms,则给予奖励。作为对照,随机将试验与假刺激条件进行交叉试验。假刺激与真实的光遗传刺激相同(没有视觉目标),但激光输出被转换到第二根光纤,放置在开颅手术外2毫米。假刺激得到的奖励与真实实验相同,猴子能够从任何与光遗传刺激无关的线索中获益。
在93.9%的试验中,高对比度的视觉目标被正确检测,而在低对比度的目标条件下,这一比例仅为55.9%。将高对比度视觉目标与光遗传刺激配对对检测性能没有显著影响。将低对比度视觉目标刺激与光遗传刺激配对,检测性能从55.9%显著提高到81.7%。这一现象表明,当光遗传刺激与低对比度的视觉刺激配对时,可以观察到明显的行为效应,猴子能够整合来自光遗传和视觉来源的神经信号,以提高检测性能。
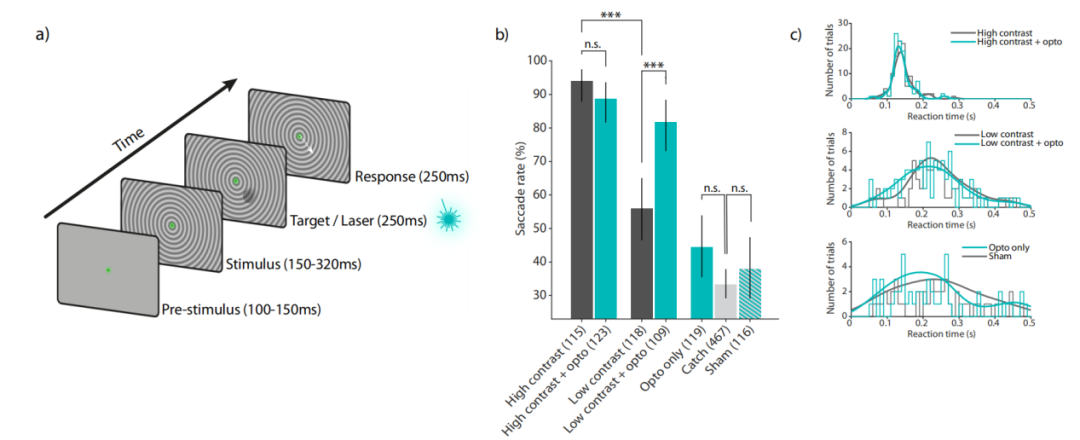
▲图6 视觉和光遗传学检测任务和行为结果
参考:
Multi-area recordings and optogenetics in the awake, behaving marmoset
—— End ——
仅用于学术分享,若侵权请留言,即时删侵!
更多阅读
脑机接口、脑波和fMRI,AI正在掌握读心术
获批FDA!创新头戴式脑电设备
这个脑机接口实现每分钟超60个单词的意念说话
人类意识的大脑模式

加入社群
欢迎加入脑机接口社区交流群,
探讨脑机接口领域话题,实时跟踪脑机接口前沿。
加微信群:
添加微信:RoseBCI【备注:姓名+行业/专业】。
加QQ群:913607986
欢迎来稿
1.欢迎来稿。投稿咨询,请联系微信:RoseBCI
2.加入社区成为兼职创作者,请联系微信:RoseBCI


一键三连「分享」、「点赞」和「在看」
不错每一条脑机前沿进展 ~