文章信息
题目:GmNAC181 promotes symbiotic nodulation and salt tolerance of nodulation by directly regulating GmNINa expression in soybean
刊名:New Phytologist
作者:Xiaodi Wang,Youning Wang, Xia Li et al.
单位:Huazhong Agricultural University
日期:25 June 2022
01
摘要
大豆 ( Glycine max ) 是世界范围内最重要的农作物之一。在低氮(N)条件下,大豆可以与根瘤菌形成共生关系,为它们的生长和生产获取充足的氮。
结瘤信号控制大豆与根瘤菌的共生。大豆结瘤( GmNINa ) 基因是大豆结瘤的中心调节因子。然而,GmNINa的转录调控在很大程度上仍然未知。结瘤对盐胁迫很敏感,但其潜在机制尚不清楚。
在这里,我们确定了一个名为 GmNAC181(也称为 GmNAC11)的 NAC 转录因子作为 GmNSP1a 的相互作用蛋白。大豆中的GmNAC181过表达或敲低分别导致结节数量增加或减少。因此,GmNINa的表达分别大大上调和下调。此外,我们发现 GmNAC181 可以直接与GmNINa启动子结合以激活其基因表达。有趣的是,GmNAC181在结瘤过程中受到盐胁迫的高度诱导,并在盐胁迫下促进了共生结瘤。
我们在结瘤途径中鉴定了一种新的GmNINa转录激活因子,并揭示了 GmNAC181 作为网络节点在盐胁迫条件下协调GmNINa表达和共生结瘤的机制。
02
技术路线
Soybean (Glycine max [L.] Merrill) cv Williams 82 plants
Cis-acting element analysis of the promoter
Alignment of amino acid sequences
Transmembrane domain analysis of protein
RNA extraction and real-time RT-qPCR
Vector construction
Soybean hairy root transformation and subsequent salt treatment or B.
diazoefficiens inoculation
Subcellular localization of GmNAC181 and plasmolysis experiments
3
主要结果
3.1 GmNAC181在结瘤过程中差异表达
为了了解主要共生调节因子GmNINa的转录调控机制,我们进行了酵母双杂交筛选分析,以鉴定与GmNSP1a相互作用的蛋白质。有趣的是,我们鉴定了GmNAC181/NAC11,一种积极调节大豆胁迫耐受性的NAC转录因子,作为GmNSP1a的推定相互作用蛋白(图S1)。为了研究GmNAC181是否介导大豆共生结瘤,我们首先分析了PLANTCARE中GmNA8181起始密码子上游的2-kb启动子序列(图1a)。有许多盐调节元件和几个顺式调节元件响应ABA和盐胁迫,这与先前研究的表达结果一致。值得注意的是,在GmNAC181的启动子区内有12个结核特异性顺式调节元件(NODCON1GM1和NODCON1 GM2)。这些表明,除了在胁迫反应中的作用外,GmNA8181还可能作为大豆根结瘤的调节器。
为了测试GmNAC181在根瘤菌感染和根瘤发育过程中是否表达,我们随后进行了RT-qPCR,以分析用重氮菌USDA110接种(DAI)后10、18和28天叶片、根和根瘤中GmNAC1 81的mRNA丰度。如图1b所示,在每个时间点,GmNAC181在根瘤中表现出比在叶和根中高得多的表达水平。值得注意的是,GmNAC181的表达水平在最年轻的结节中最低,在结节发育过程中GmNA8181的表达逐渐增加,在28天的成熟结节中达到最高水平。这一结果表明GmNAC181在根瘤的发育和功能中具有潜在作用。
为了测试GmNAC181是否对根瘤菌有反应,我们分析了接种根瘤菌的大豆幼苗根中GmNAC1 81的表达。出乎意料的是,我们发现在接种后3、6、12和24个HAI(HAI)时,感染根中的GmNAC181 mRNA水平迅速显著降低,但在72个HAI时却没有降低(图1c)。综上所述,这些结果表明GmNAC181可能与根瘤菌感染、根瘤器官发生和大豆功能有关。
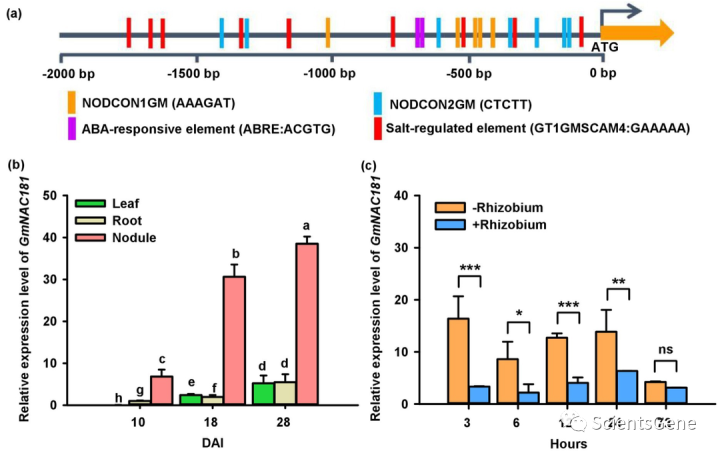
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
3.2 GmNAC181正调控大豆结瘤
为了研究GmNAC181在大豆结瘤中是否具有调节作用,我们对GmNAC1 81过表达(GmNAC 181OE)和敲除(GmNA C181-STTM48)转基因植物进行了表型分析。当GmNAC181过表达时(图2a),每个GmNA81OE根的平均结节数显著增加。对照根平均每根12.1个结节,但GmNAC181OE根结节数增加到每根18.9个结节,与空载体相比增加了56.2%(图2b,c)。
为了确认GmNAC181在结瘤中的作用,我们使用短串联靶模拟物(STTM)敲除该基因。如预期,GmNAC181基因敲除导致结节数量显著减少(图2d-f、S2和S3)。含有空载体的转基因毛状根在28天内平均形成8.9个结节,而GmNAC181-STTM48转基因毛状根平均每根只有3个结节,与空载体相比减少了66.3%(图2f)。这些数据表明,GmNAC181是大豆结瘤的正调节因子。由于GmNAC181与GmNSP1a相互作用并积极调节结瘤,我们推测它可能作为GmNINa表达的辅激活剂。
为了支持这一假设,我们分析了结瘤信号通路的GmNINa和下游结瘤标记基因GmENOD40-1的表达。事实上,GmNAC181的过度表达显著增加了GmNINa的表达水平(达到11.4倍),而GmNAC1 81的敲除导致GmNINa表达的显著下调(图2g,h)。因此,GmNAC181过表达和敲除也显著上调和下调GmENOD40-1的表达水平(至800倍)(图S4a,b)。这些结果表明,GmNAC181可能通过GmNINa激活和下游结瘤基因促进根结瘤。
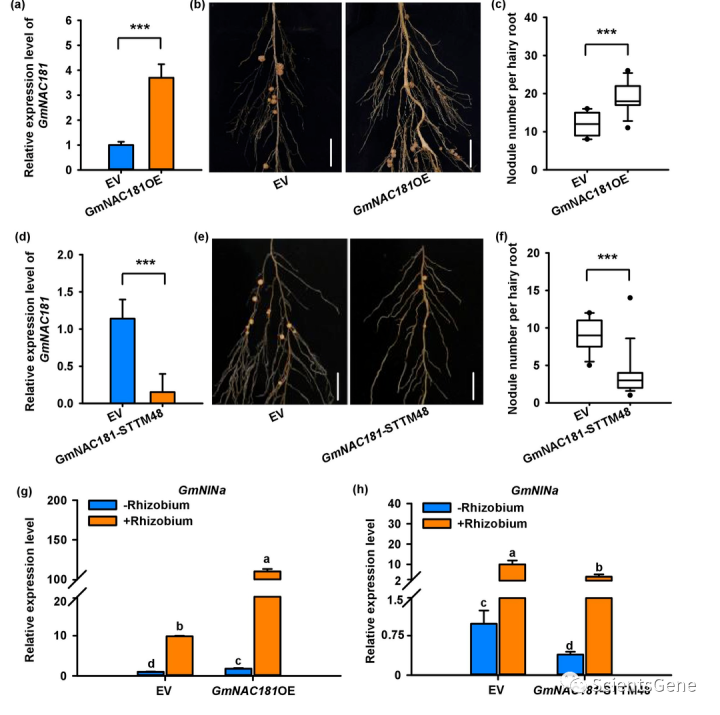
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
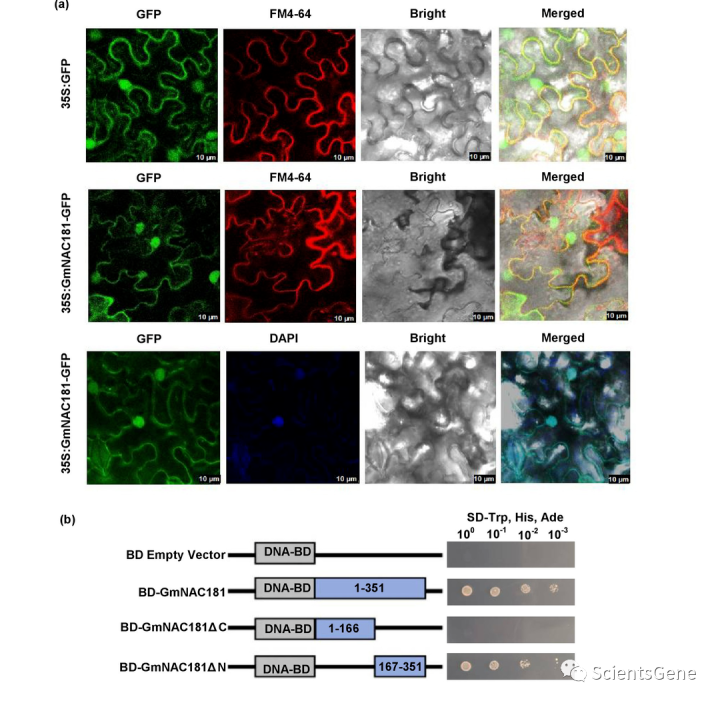
3.3 GmNAC181定位于细胞质和细胞核,是一种转录激活剂
GmNAC11/GmNAC1 81是拟南芥原生质体中的核蛋白。全长351个氨基酸的GmNAC181蛋白在N端含有高度保守的NAC结构域和高度多样的C端结构域(图S5a),这与NAC转录因子的特征一致。此外,GmNAC181蛋白包含一个核定位序列(NLS)和两个假定的跨膜结构域(图S5b),这表明GmNAC1 81可能是一种膜结合转录因子。
为了确定GmNAC181的亚细胞定位,我们在花椰菜花叶病毒(CaMV)35S启动子的控制下在N.benthamiana叶片中表达了GmNA81-GFP融合蛋白。GmNAC181-GFP融合蛋白定位在细胞质和细胞核中(图3a、S6)。进一步的实验表明,GmNAC181 GFP信号存在于质膜中,但不存在于胞浆化叶细胞的细胞壁中(图S7),这表明GmNA8181可能同时存在更多的亚细胞定位。
接下来,我们验证了GmNAC181在酿酒酵母菌株AH109中的转录活性∆C和C末端结构域(氨基酸167-351、BD-GmNAC181∆N) 与GAL4DNA结合结构域(GAL4BD、BD-GmNAC181)的C末端融合。表达BD空载体BD-GmNAC181、BD-GmNAC181的酵母AH109∆C和BDGmNAC181∆生成N。用BD-GmNAC181和BDGmNAC183转化的酵母细胞∆N在不含色氨酸、组氨酸和腺嘌呤(SD/-Trp、His、Ade)的SD培养基上生长良好,而含有空载体和BDGmNAC181的酵母细胞∆C没有生长(图3b)。结果证实,GmNAC181是一种转录激活剂,蛋白质的C末端部分是其转录激活活性所必需的,这与拟南芥原生质体的先前结果一致。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.4 GmNAC181直接与GmNINa启动子结合,刺激其表达
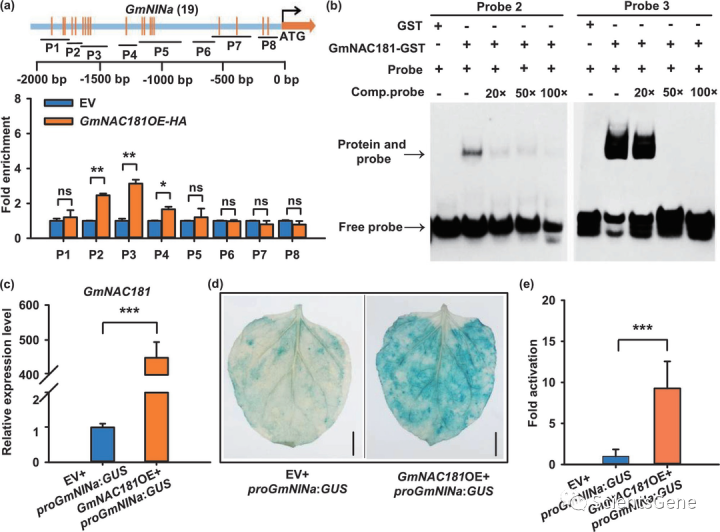
由于GmNAC181正向调节GmNINa的表达(图2g,h),我们假设GmNAC1 81可能直接激活GmNINa基因的表达。由于NAC转录因子通常与包含共有CGT(G/A)基序的特定DNA序列结合,我们首先分析了GmNINa和GmENOD40-1基因的启动子。有趣的是,在GmNINa和GmENOD40-1的2 kb启动子中分别有19和9个NAC结合位点(图4a、S8a)。
接下来,我们使用表达GmNAC181OE HA的转基因毛状根进行ChIP qPCR分析,以确定GmNA8181是否能够与这两个结瘤基因的启动子结合。对于GmNINa基因,选择了8个覆盖启动子区的片段(P1至P8),除P6之外的所有片段都包含一个或两个CGT(G/A)基序。ChIP PCR结果显示,GmNAC181在P2、P3和P4区域有较强的富集,而在GmNINa启动子的其他区域没有检测到明显的富集(图4a)。出乎意料的是,我们在GmENOD40-1的启动子区发现了一个轻微的或没有的GmNAC181富集,尽管它们也包含CGT(G/A)基序(图S8b)。这些结果表明GmNAC181与GmNINa的启动子强烈结合。
为了验证GmNAC181与GmNINa启动子中的CGT(G/A)基序的结合,我们进行了EMSA(电泳迁移率转移分析)。为此,我们纯化了重组GmNAC181谷胱甘肽S-转移酶(GmNAC1 81 GST)融合蛋白,并在ChIP qPCR中优先选择了两个具有较高富集倍数的结合位点(P2和P3),用于测试GmNAC 181与两个寡核苷酸(探针2,30 bp和探针3,33 bp)的结合亲和力。当探针与GmNAC181孵育时,观察到明显的带移(图4b)。GmNAC181似乎对探针3的亲和力比对探针2的亲和力更强。通过向反应中添加未标记的完整探针,验证了GmNAC1 81对这些探针的结合特异性(图4b)。接下来,将携带proGmNINa:GUS和空载体或GmNAC181OE的构建体分别共转化到烟草的叶片中。过表达GmNAC181的叶片比表达空载体的叶片表现出更强的GUS活性(图4c-e)。总之,这些结果表明,GmNAC181转录因子通过在结瘤过程中直接结合和激活GmNINa表达来调节结瘤。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
3.5 GmNAC181在结瘤过程中由盐胁迫高度诱导,并在盐胁迫下促进结瘤
GmNAC181最初被鉴定为大豆耐盐性的盐响应基因和正调节因子。由于根结瘤对盐胁迫敏感,我们假设GmNAC181可能赋予根结瘤耐受盐胁迫。为了验证这种可能性,我们分析了盐胁迫下未感染和感染的大豆幼苗根系中GmNAC181的表达。盐处理后24小时,未感染根中的GmNAC181被盐胁迫高度诱导,这与先前的结果一致。值得注意的是,尽管在正常条件下根瘤菌感染显著下调了GmNAC181的表达,但盐胁迫下受感染根中GmNA8181的表达水平与未受感染和未受胁迫根中的表达水平相当(图5a)。接下来,我们还发现,在75 mM NaCl后24小时,GmNAC181会被结核中的盐胁迫显著诱导(图5b)。在解释GmNAC181在结瘤中的积极作用时,这些结果表明GmNA8181在对盐胁迫的结瘤反应中起着关键作用。
为了研究GmNAC181是否调节盐胁迫下的结瘤反应,我们评估了在盐胁迫下过表达或下调GmNA8181的转基因复合植物的结瘤数。在正常条件下,GmNAC181OE根的长度明显长于空载体对照,因此,GmNAC181OE-复合转基因植物的生长得到了极大的促进,并增强了其对盐胁迫的耐受能力(图S9a-c,S10a-d)。重要的是,GmNAC181的异位过度表达显著增加了结节数量。空载体对照根平均每根约6.1个结节,但在正常条件下,每根GmNAC181OE根的结节数增加了一倍,达到13.7个结节(增加了55.5%)(图5c、d、S11a)。在胁迫下,每个EV根只有3个结节,每个GmNAC181OE根只有13.7个结节,后者与正常条件下的结节数相当(图5c、d、S11b)。这些结果表明,GmNAC181OE在盐胁迫下维持结瘤。
为了证实GmNAC181在盐胁迫下结瘤中的作用,我们还使用STTM敲除了该基因。令人惊讶的是,GmNAC181基因敲除导致结节数量显著减少。含有空载体的转基因毛状根在14DAI时平均形成5.1个结节,而GmNAC181-STM48转基因毛状根茎平均每根只有1.6个结节,与空载体相比减少了68.6%(图5e,f,S11c,d)。在盐胁迫下,每个载体控制根只有3个结节,与正常条件下的空载体相比,减少了41.2%,而敲除GmNAC181基因表达后,盐胁迫下的结节数大大减少到0.6,与空载体相比减少了80%(图5e、f、S11e、f)。因此,我们得出结论,GmNAC181是大豆对盐胁迫的共生结瘤反应的关键调节因子。
事实上,GmNAC181的过度表达显著增加了GmNINa的表达水平(达到3.3倍),而GmNAC1 81的敲除导致GmNINa表达的显著下调(图5g,h)。因此,GmNAC181过表达和敲除也分别显著上调和下调GmENOD40-1的表达水平(图S12a,b)。这些结果表明,在盐胁迫下,GmNAC181可能通过GmNINa激活和下游结瘤基因促进根结瘤。

Fig. 5
04
结论
总之,我们的发现揭示了一种新的分子机制,即GmNAC181在正常生长条件下促进结瘤,并在盐胁迫下维持大豆的根系和结瘤(图5i)。我们的研究结果提出了一种利用GmNAC181作为关键基因提高大豆在盐胁迫下的共生固氮效率、可持续性和产量的遗传策略。进一步了解GmNAC181整合盐信号和结瘤信号通路的分子机制,将有助于全面了解共生结瘤和固氮耐盐性的遗传基础,以及大豆的先进遗传改良,以提高共生固氮效率和产量高盐度条件。由于这些NAC转录因子在豆科作物中高度保守,我们的研究结果将为豆科作物共生固氮的理解和遗传改良提供新的见解。
05
原文获取
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18343
PDF获取:
https://www.scientsgene.com/h-nd-114.html#_np=107_423
文末附件。
赛思基因科技www.scientsgene.com有限公司致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
赛思基因可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。





![[附源码]计算机毕业设计springboot软考刷题小程序](https://img-blog.csdnimg.cn/fb3d8bed9fd749edb1bfb20ebc6d4bf1.png)