文章信息
题目:A Phytophthora capsici RXLR effector targets and inhibits the central immune kinases to suppress plant immunity
刊名:New Phytologist
作者:Xiangxiu Liang,Daolong Dou et al.
单位:China Agricultural University
日期:22 June 2021
摘要
1
受体细胞质激酶亚家族 VII (RLCK-VII) 蛋白是植物模式识别受体 (PRR) 复合物中的中枢免疫激酶,它们协调一系列针对细菌和真菌病原体的复杂防御反应。然而,RLCK-VII 在植物-卵菌病原体相互作用中的作用尚未确定。辣椒疫霉是一种臭名昭著的卵菌病原体,会感染许多重要的农业蔬菜。
在这里,我们报告了 RXLR25 的鉴定,这是P的毒力所需的 RXLR 效应器。 辣椒。RXLR25在植物中的表达显着增强了植物对疫霉病原菌的易感性。RXLR25 严重损害了拟南芥中微生物模式诱导的免疫激活。我们进一步表明 RXLR25 与 RLCK-VII 蛋白相互作用。
使用 9 个rlck-vii高阶突变体,我们观察到 RLCK-VII-6 和 RLCK-VII-8 成员是抗辣椒疫霉所必需的。RLCK-VII-6 成员是疫霉培养滤液 (CF) 诱导的免疫反应所必需的。RXLR25 直接靶向 RLCK-VII 蛋白,如 BIK1、PBL8 和 PBL17,并抑制模式诱导的 RLCK-VII 磷酸化以抑制下游免疫反应。
本研究确定了辣椒假单胞菌的一个关键毒力因子,结果揭示了 RLCK-VII 蛋白在植物-卵菌相互作用中的重要性。
技术路线
2
研究中使用的本氏烟草、拟南芥和辣椒 ( Capsicum annuum L.) 植物在 23°C 和 70% 相对湿度的土壤中,在 10 小时:14 小时、光照:黑暗的循环中进行栽培
将RXLR25编码序列克隆到 pCAMBIA1300-35S-HA-RBS 载体中
农杆菌介导的转化引入 Col-0 植物
疫霉菌感染试验
细菌感染测定
为了沉默辣椒红辣椒中的 RXLR25 ,将来自RXLR25的特定序列(545-1278 bp)扩增并克隆到 pTOR 载体中,并通过聚乙二醇(PEG)介导的原生质体转化引入辣椒辣椒 LT263
氧化爆发测量
RXLR25 相互作用蛋白的质谱分析
免疫共沉淀 (co-IP) 测定
谷胱甘肽-S-转移酶 (GST) pull down
萤光素酶互补测定
主要结果
3
3.1 RXLR25 增强植物对疫霉病原菌的敏感性
Phytophthora病原体部署 RXLR 和 CRN 效应器作为武器来抑制宿主免疫并帮助它们在植物中增殖。为了识别可能干扰宿主免疫系统的辣椒辣椒效应子,我们根据辣椒基因组序列克隆了许多 RXLR 和 CRN 效应子。FRK1是检测植物免疫激活的常用标记基因。因此,我们进行了基于原生质体的报告基因分析,以检查效应子的表达是否可以抑制 flg22 诱导的FRK1启动子-萤火虫荧光素酶 (FRK1::LUC) 活性。
在这些效应子中,RXLR25 显着抑制 flg22 诱导的 FRK1::LUC 活性,而 RXLR2、RXLR5、RXLR11、RXLR14 和RXLR32不能(图 S1a )。PsCRN63 被用作阳性对照,因为据报道它可以抑制 flg22 诱导的 FRK1::LUC 活性。生物信息学分析显示 RXLR25 在大豆假单胞菌、致病疫霉和拟南芥透明孢子菌物种中不保守,表明 RXLR25 可能对辣椒假单胞菌具有特异性(图S1b )。
为了检查 RXLR25 是否可以促进疫霉感染,我们使用农杆菌介导的瞬时表达和接种P. capsici菌株 LT263 或P. infestans TDT-88069在本氏烟草中瞬时表达空载体 (EV) 对照和 RXLR25-HA 。与 EV 对照相比,表达 RXLR25-HA 的一半叶片比表达 EV 的一半叶片表现出更大的病变区域(图 1a),表明 RXLR25 可以促进P. capsici在本氏烟草中的感染。同样,RXLR25-HA 也极大地促进了致病疫霉菌株 TDT-88069 定殖(图 1b)。免疫印迹分析显示 RXLR25-HA 通常在本氏烟草中表达(图 1a,b)。然后我们通过农杆菌介导的稳定转化将RXLR25-HA引入拟南芥,获得了两个独立的转基因株系RXLR25-HA-L1和RXLR25-HA-L2。免疫印迹分析显示 RXLR25-HA 在 T3 代中以相似水平在两个转基因系中表达(图 S2a )。与EV转基因和 Col-0 植物相比,这两个转基因系没有显示出明显的形态差异(图 S2a),说明RXLR25不影响植物生长发育。将转基因植物的叶子与辣椒游动孢子一起培养,记录病变面积。结果表明,两种独立的RXLR25-HA转基因植物对P. capsici感染的敏感性增强(图 1c)。这些结果表明, RXLR25在植物中的表达大大促进了疫霉的感染。
然后我们用细菌病原体Pst DC3000 侵染这两种转基因植物。我们观察到RXLR25-HA转基因株系(RXLR25-HA-L1和L2 )都比EV转基因和 Col-0 植物更容易受到Pst DC3000 感染(图 S2 b)。我们进一步将RXLR25-HA引入Pst DC3000 D36E,这是一种失去所有 36 种效应蛋白但具有功能性 III 型分泌系统的Pst菌株。我们用Pst感染 Col-0 植物菌株并注意到 RXLR25-HA 在Pst DC3000 D36E 中的表达显着增强了其致病性(图 1d)。总之,这些结果表明 RXLR25 可以促进疫霉和细菌感染。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
3.2 RXLR25 有助于提升辣椒疫霉的毒力
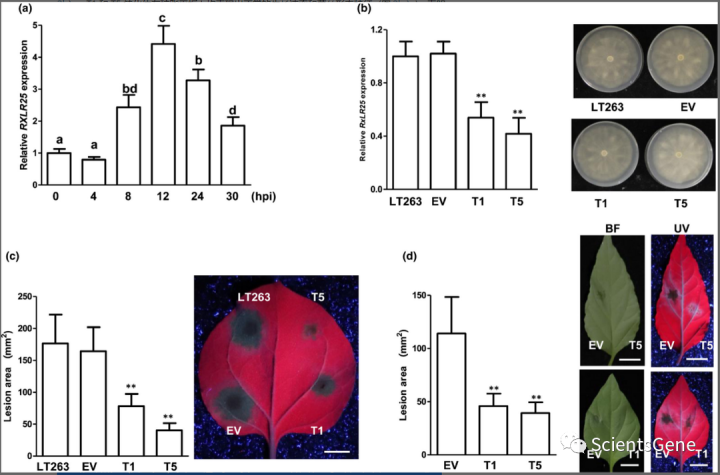
生物信息学分析显示,有 8 个基因与 RXLR25 具有高度同一性(图 S3 a,b)。因此,我们将它们命名为 RXLR25 类效应器 1-8 (RLE1-8)。在 8 个RLE基因中,RLE2编码一个截短的蛋白质,而RLE8丢失了信号肽(图 S3 b)。为了检查RXLR25和RLE的表达模式,我们进行了 qPCR 分析,发现RXLR25转录物在浸润后 12 小时(hpi)被显着诱导(图 2a)。大多数RLE基因在感染过程中也被诱导了 2-4 倍(图 S4)。为了进一步确定 RXLR25 对P. capsici毒力的贡献,我们试图敲除P. capsici中的RXLR25。由于RXLR25在基因组中有多个拷贝,并且 CRISPR/Cas9 方法不可行,我们对RXLR25进行了基因沉默,并获得了一个 EV 转化体和两个独立的稳定转基因系 T1 和 T5。随后的 qPCR 分析显示,对于 T1 和 T5 系, RXLR25转录水平分别降低至野生型水平的 54% 和 42%(图 2b)。T1 和 T5 转化体在琼脂平板上均表现出正常的生长速率和菌丝形态特征(图 2b )),表明RXLR25不影响P. capsici的生长。
我们接下来进行了疫霉感染试验以确定 T1 和 T5 转化体的毒力。本氏烟草和辣椒叶与 LT263 和RXLR25沉默的转化体的游动孢子一起温育。与EV转化体相比,由两种转化体(T1和T5)引起的病变区域显着减少(图 2c,d)。为了进一步证实 T1 和 T5 转化体的毒力降低是由 RXLR25 引起的,我们在本氏烟草叶片中瞬时表达 EV 和 RXLR25-HA,并用 T1 转化体或 WT P. capsici感染植物菌株。我们观察到 RXLR25 在植物中的表达显着恢复了 T1 转化体降低的毒力(图 S5a )。我们接下来检查了P. capsici处理后拟南芥中的防御基因表达,并注意到 T1 和 T5 转化体诱导的FRK1表达高于EV转化体,表明RXLR25沉默的转化体显示出抑制宿主免疫激活的能力降低(图 S5乙)。总之,这些结果表明 RXLR25 对P. capsici毒力至关重要。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
3.3 RXLR25抑制植物先天免疫
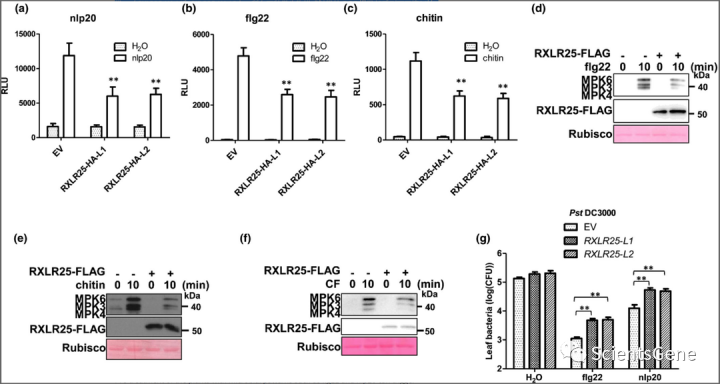
考虑到 RXLR25 可以促进植物中的疫霉和细菌感染,我们推断 RXLR25 可以抑制宿主免疫激活以促进病原体感染。因此,我们系统地检查了 RXLR25 对植物先天免疫的影响。植物细胞可以通过感知保守分子模式来感知微生物的入侵,并触发一系列免疫反应,包括 ROS 爆发和 MAPK 激活。我们首先检查了RXLR25-HA转基因系中的 nlp20-、flg22-和几丁质触发的 ROS 爆发。在RXLR25-HA-L1和RXLR25-HA-L2中,所有三种微生物模式触发的 ROS 爆发都受到严重抑制转基因植物。与EV转基因相比,转基因植物中 ROS 的产生减少了 40-50% (图 3a-c)。与此一致,本氏烟草中 RXLR25-HA 的瞬时表达也严重损害了 flg22 和几丁质触发的 ROS 产生(图 S6 a,b)。接下来,我们在拟南芥原生质体中瞬时表达 RXLR25-HA,并检测了由 flg22、几丁质和 CF 诱导的 MAPK 活化。CF 是来自致病疫霉培养滤液的粗提物,可以被认为是疫霉衍生模式和诱导剂的混合物。我们注意到,RXLR25-HA 抑制了所有三种微生物模式触发的 MAPK 磷酸化(图 3d-f)。
用诸如flg22和nlp20等微生物模式对植物进行预处理可以触发植物免疫系统的激活并导致对病原体感染的抵抗力增加。我们用水、flg22 和 nlp20预处理RXLR25-HA和EV转基因植物 1 天,然后用Pst DC3000 感染植物。我们观察到在RXLR25-HA转基因植物中,flg22 和 nlp20 诱导的对Pst DC3000 的抗性严重受损(图 3g)。总之,这些结果表明RXLR25可以抑制植物先天免疫的激活。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.4 RXLR25 靶向植物 RLCK-VII 蛋白
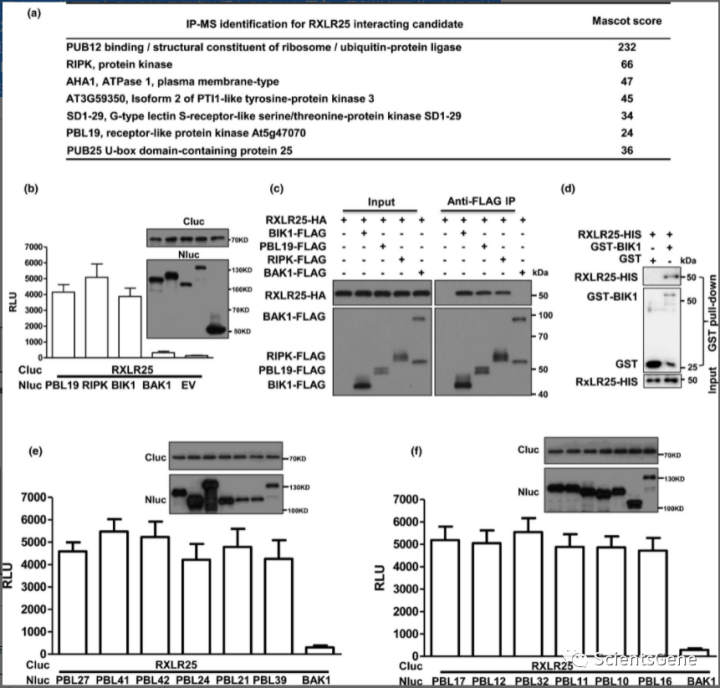
为了鉴定 RXLR25 的宿主靶标,我们在拟南芥原生质体中瞬时表达 RXLR25-FLAG 蛋白或 EV(模拟),用抗 FLAG 亲和凝胶纯化并进行液相色谱-串联质谱(LC-MS/MS)分析。RXLR25-FLAG 组有 1287 个蛋白质,模拟组有 405 个蛋白质(表 S2)。上一段中描述的结果表明,RXLR25 可以阻断多种微生物模式触发的早期免疫反应。因此,我们推断 RXLR25 可能针对上游调节元件。在候选列表中,我们鉴定了许多蛋白质,包括 PUB12、PUB25、RIPK 和 PBL19(图 4a;表 S2),这些蛋白质先前被报道是 PRR 复合物的一部分。RIPK 和 PBL19 都属于 46 个成员的 RLCK 亚家族 VII (RLCK-VII)。RLCK-VII 蛋白,也称为 PBS1 样 (PBL) 蛋白,据报道可与许多 PRR 相互作用并作为中枢激酶来协调 PRR 介导的免疫信号传导,包括 ROS 爆发、钙内流和防御基因表达。
考虑到广泛研究的 RLCK-VII 成员 BIK1 是抵抗细菌和真菌病原体以及微生物模式诱导的免疫反应所必需的,我们推断 RLCK-VII 蛋白可能是最有可能的候选者。荧光素酶互补测定显示RXLR25与RIPK、PBL19和BIK1强烈相互作用,但与BAK1或EV没有相互作用(图 4b)。免疫印迹分析显示蛋白质通常在本氏烟草中表达(图 4b)。通过拟南芥原生质体中的 Co-IP 测定进一步证实了这些相互作用(图 4c)。为了研究 RXLR25 是否直接靶向 RLCK-VII 蛋白,我们进行了体外GST 下拉试验以检查 RXLR25-BIK1 相互作用。结果显示 RXLR25-HIS 与 GST-BIK1 强烈相互作用,但不与 GST 单独相互作用(图 4d)。考虑到 RXLR25 和 RLE 蛋白之间的高度序列同一性,我们推断 RLE 也可能靶向 RLCK-VII。我们检查了 BIK1 和 RLE 蛋白之间的相互作用。令人惊讶的是,荧光素酶互补测定显示没有任何 RLE 蛋白与 BIK1 相互作用(图 S7 a,b)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
我们接下来试图确定 RXLR25 是否可以针对其他 RLCK-VII 成员。如图 4e、f所示,我们随机选择 12 个 RLCK-VII 成员并对它们进行荧光素酶互补测定以分析它们与 RXLR25 的相互作用(图 4e、f)。结果显示RXLR25与所有检查的RLCK-VII蛋白相互作用(图 4e,f),表明RXLR25靶向整个RLCK-VII亚家族。
辣椒疫霉可以感染多种双子叶植物,包括拟南芥、本氏烟草和辣椒植物。我们想知道 RXLR25 是否针对其他植物物种中的 RLCK-VII 蛋白。CaPIK1 是一种辣椒 RLCK-VII 蛋白,它是防御微生物病原体的正向调节因子。因此,我们通过本氏烟草中的荧光素酶互补和拟南芥原生质体中的 Co-IP 测定检查了 RXLR25 和 CaPIK1 之间的相互作用。我们观察到RXLR25 与本氏烟草和拟南芥原生质体中的CaPIK1 强烈相互作用(图 S8 a,b),表明RXLR25 可能靶向不同植物中的RLCK-VII 蛋白。
3.5 植物 RLCK-VII 蛋白是抗辣椒疫病所必需的
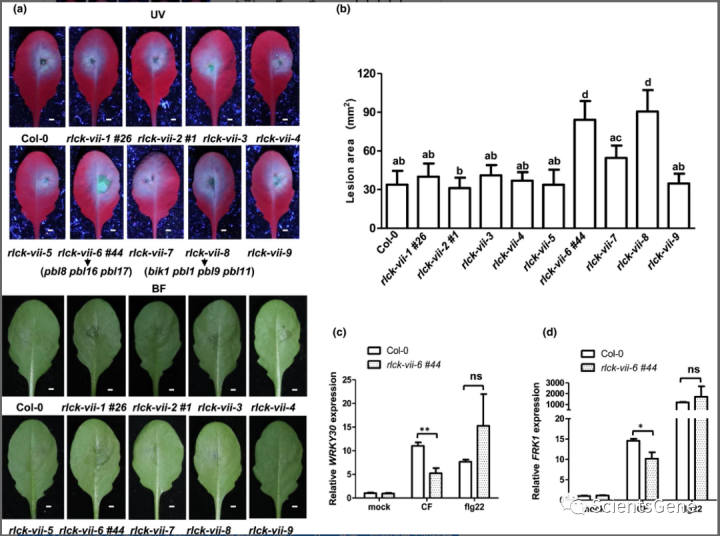
RLCK-VII 蛋白是植物对细菌和真菌病原体的抗性所必需的。然而,几乎没有研究过RLCK-VII 蛋白在抗卵菌病原体(包括辣椒假单胞菌)中的作用。根据系统发育关系构建了9个高阶rlck-vii突变体,命名为rlck-vii-1~rlck-vii-9 ,涵盖了拟南芥RLCK-VII的大部分成员。我们系统地分析了它们对P. capsici的抗性。与 Col-0 相比,rlck-vii-6 #44和rlck-vii-8对P. capsici感染的敏感性大大增强(图 5a)。
定量分析显示,rlck-vii-6 #44和rlck-vii-8的病灶面积明显增加(图 5b)。对于其他rlck-vii高阶突变体,与 Col-0 相比,它们对P. capsici的抗性没有显着差异(图 5a,b)。我们接下来用致病疫霉接种rlck-vii-6 #44和rlck-vii-8突变体,与拟南芥不相容的病原体。尽管突变体和 Col-0 之间没有明显的疾病症状,但 qPCR 分析显示rlck-vii-6 #44和rlck-vii-8突变体具有更高的P. infestans生物量高于 Col-0(图 S9 a)。总之,这些结果表明rlck-vii-6 #44和rlck-vii-8有助于抵抗相容和不相容的卵菌病原体。
rlck -vii-8突变体在四个基因BIK1、PBL1、PBL9和PBL11处含有突变。据报道,BIK1 对抵抗细菌、真菌和昆虫至关重要。因此,BIK1 及其密切的同源物也是对卵菌病原体P. capsici的抗性所必需的也就不足为奇了。有趣的是,我们观察到包含PBL8、PBL16和PBL17突变的rlck-vii-6 #44突变体对辣椒假单胞菌的易感性显着增强,表明,rlck-vii-6 #44突变体不是 flg22 或几丁质诱导的免疫反应所必需的。
为了确定这三个基因是否特别需要抵抗卵菌病原体,我们将rlck-vii-6 #44突变体和 Col-0 植物与细菌病原体Pst DC3000 一起培养。如图所示,rlck-vii-6 #44突变体显示出对Pst DC3000 的正常抗性(图 S9 b)。我们接下来检查了 Col-0 和rlck-vii-6 #44中 CF 和 flg22 诱导的 MAPK 活化,发现rlck -vii-6 #44中 CF 诱导的 MAPK 活化部分降低突变体(图 S9 c)。我们进一步检查了 Col-0 和rlck-vii-6 #44中 CF 和 flg22 诱导的防御标记基因表达。虽然 flg22 诱导的FRK1和WRKY30的表达通常在 rlck-vii-6 #44 突变体中被激活,但rlck-vii-6 # 44突变体中 CF 诱导的两个基因的表达显着降低(图 5c,d)。总之,这些结果表明植物 RLCK-VII-6 和 RLCK-VII-8 亚组成员对于植物对辣椒的抗性是必不可少的。有趣的是,RLCK-VII-6 成员是对疫病病原体免疫所必需的。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
3.6 RXLR25通过抑制RLCK-VII蛋白的磷酸化来抑制植物免疫
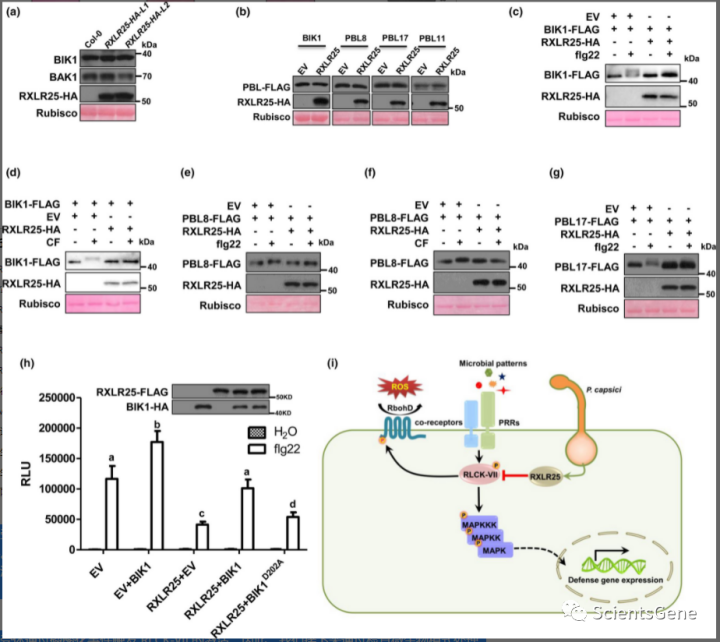
我们接下来试图确定 RXLR25 操纵宿主 RLCK-VII 蛋白的机制。我们首先考察 RXLR25 是否影响 RLCK 的稳定性。我们使用抗 BIK1 免疫印迹检测了RXLR25-HA转基因植物中 BIK1 的体内积累。结果表明,两个独立的转基因植物(RXLR25-HA -L1 和 L2)表现出正常量的 BIK1 积累(图 6a)。作为对照,我们观察到 BAK1 的积累不受 RXLR25 的影响(图 6a)。
为了检查 RXLR25 是否影响其他 RLCK-VII 的稳定性,我们在拟南芥原生质体中与 BIK1-FLAG、PBL8-FLAG、PBL17-FLAG 和 PBL11-FLAG 共表达 RXLR25-HA。免疫印迹分析显示 RXLR25 不影响检查的 RLCK-VII 的积累。
模式识别受体在共受体存在的情况下感知微生物模式,并将信号转导至 RLCK-VII 以激活下游免疫信号传导。因此,我们检查了 RXLR25 对 BAK1-FLS2 和 BIK1-FLS2 相互作用的影响。原生质体中的共免疫沉淀测定表明,flg22 诱导的 FLS2-BAK1 相互作用在 RXLR25-HA 存在下正常发生(图 S10a)。我们进一步注意到RXLR25也不影响拟南芥原生质体中的BIK1-FLS2相互作用(图 S10 b)。
模式识别受体通过磷酸化事件触发 RLCK-VII 的激活。因此,我们接下来通过检查微生物模式处理后的磷酸化状态来分析 RLCK-VII 蛋白的活化。我们在原生质体中与 RXLR25-HA 共表达 BIK1-FLAG,并检查了 flg22 和 CF 诱导的 BIK1 磷酸化。Flg22 可以诱导 BIK1 的磷酸化,这可以通过免疫印迹分析中的带移来检测。令人惊讶的是,我们观察到 flg22 诱导的 BIK1 带位移被 RXLR25-HA 完全阻断(图 6c)。类似地,CF 诱导的 BIK1 带位移也被 RXLR25 抑制(图 6d )。
我们接下来考察 RXLR25 是否可以抑制模式诱导的 RLCK-VII-6 蛋白磷酸化。我们检查了 flg22 和 CF 诱导的 PBL8-FLAG 磷酸化和 flg22 诱导的 PBL17 带位移。如图所示,flg22 和 CF 触发了 PBL8 的带移,并且带移被 RXLR25 阻断(图 6e,f)。与其他微生物模式处理一样,flg22 诱导的 PBL17 带移也被 RXLR25 抑制(图 6g)。我们进一步检查了 RLE 蛋白是否可以抑制 BIK1 磷酸化。与 BIK1-RLE 相互作用结果一致,没有一个 RLE 蛋白抑制 flg22 诱导的 BIK1 磷酸化(图 S11)。这些结果表明 RXLR25 抑制微生物模式触发的 RLCK-VII 蛋白磷酸化。
活化的 RLCK-VII 蛋白磷酸化一系列靶标以激活下游免疫反应。例如,BIK1 在多个位点(例如 Ser39)磷酸化 RbohD,以调节模式触发的 ROS 产生。为了确定 RXLR25 是否通过抑制 RLCK-VII 活化来抑制宿主免疫,我们在原生质体中瞬时表达 RXLR25-FLAG 并通过 pSer39 特异性抗体检测 flg22 诱导的 RbohD Ser39 磷酸化。如图 S12所示, RXLR25 强烈抑制flg22 诱导的Ser39 磷酸化,并且通过BIK1-HA 的过表达恢复抑制作用。该结果表明RXLR25通过抑制BIK1来抑制RbohD磷酸化。接下来,我们在原生质体中瞬时表达 RXLR25-FLAG 以及 BIK1-HA 的 WT 和激酶死亡形式,并分析了 flg22 诱导的 ROS 产生。我们观察到 RXLR25 的表达严重抑制了 flg22 诱导的 ROS 爆发。过量的 BIK1-HA 表达显着挽救了由 RXLR25 引起的 ROS 产生减少,但 BIK1 D202A -HA(激酶死亡)不能恢复(图 6h)。总之,我们证明了 RLCK-VII 蛋白对于植物对疫霉病菌的抗性至关重要。我们确定了一个 辣椒效应子RXLR25抑制宿主 RLCK-VII 蛋白的活化以抑制植物免疫(图 6i)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
结论
4
总之,本研究确定了 RXLR25是辣椒的关键毒力因子。它靶向宿主 RLCK-VII 蛋白。RXLR25 抑制 RLCK-VII 蛋白的磷酸化以抑制宿主免疫激活。我们的研究拓宽了对植物 RLCK-VII 蛋白的认识。虽然 BIK1 及其密切同源物(进化枝 8)是植物对细菌、真菌和卵菌病原体的抗性广泛需要的、PBL8、PBL16 和 PBL17(进化枝 6)尤其是抵抗卵菌病原体所必需的。这一发现不仅加深了我们对疫霉病原菌致病机制的理解,而且揭示了 RLCK-VII 蛋白对于植物-卵菌病原菌相互作用至关重要。
获取原文
5
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.17573
赛思基因www.scientsgene.com有限公司致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
赛思基因可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。
![[附源码]计算机毕业设计springboot拉勾教育课程管理系统](https://img-blog.csdnimg.cn/2979b3c094b9420db4d9f939efb3aa0d.png)

![[附源码]Python计算机毕业设计Django的文成考研培训管理系统](https://img-blog.csdnimg.cn/a91adbc05a72486d9d2abf220033f58c.png)


![[附源码]Python计算机毕业设计Django的玉石交易系统](https://img-blog.csdnimg.cn/2c117505bb3c439f8a6ecdfd6234c089.png)

![[附源码]计算机毕业设计SpringBoot计算机相关专业考研资料管理系统](https://img-blog.csdnimg.cn/ece30d73d864465ca71f7618c4542c2c.png)

![[附源码]SSM计算机毕业设计学术文献分享网站JAVA](https://img-blog.csdnimg.cn/052f1940a5a947d3a318aae00dda77cf.png)