文章信息
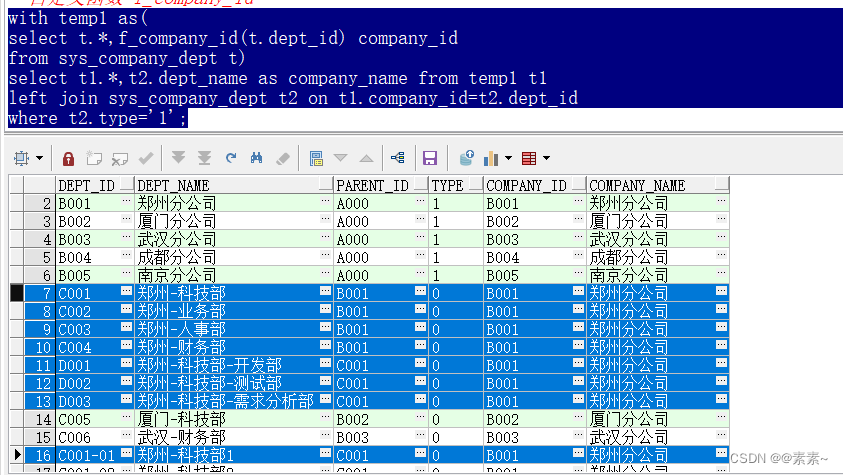
题目:Downregulation of a gibberellin 3β-hydroxylase enhances photosynthesis and increases seed yield in soybean
刊名:New Phytologist
作者:Fang Huang,Zhixi Tian,Deyue Yu et al.
单位:Nanjing Agricultural University
日期:09 April 2022

01
摘要
种子产量主要取决于种子数量和种子重量,是大豆育种的主要目标。识别产量相关性状的基因具有重要意义。
通过联合连锁图谱和100粒重的全基因组关联研究,我们克隆了GmGA3ox1,这是一种编码赤霉素3β-羟化酶的基因,它是赤霉素合成途径中的关键酶。
基因组测序鉴定出一种有益的GmGA3ox1单倍型,有助于提高种子重量,大豆转化子进一步证实了这一点。CRISPR/Cas9产生的gmga3ox1突变体显示出较低的种子重量,但通过增加种子数量提高了种子产量。gmga3ox1突变体减少赤霉素生物合成,同时增强光合作用。GmGA3ox1的敲除导致许多光合作用相关基因的上调,特别是编码核酮-1,5-二磷酸羧化酶加氧酶(Rubisco)活性的GmRCA家族。基本亮氨酸拉链转录因子GmbZIP97和GmbZIP159,在gmga3ox1突变体中均上调,并由赤霉素合成抑制剂尤尼康唑诱导,可与GmRCAβ的启动子结合并激活其表达。对2700多份大豆材料的基因组序列分析表明,GmGA3ox1正逐渐用于现代育种。
我们的结果阐明了GmGA3ox1在大豆产量中的重要作用。这些发现揭示了大豆和其他作物未来高产育种的重要线索。

02
技术路线

The soybean (Glycine max (L.) Merr.) materials were used for trait collection
Population phenotyping analysis
Linkage mapping
GWAS
RNA extraction and quantitative real-time PCR (qRT-PCR)
b-Glucuronidase (GUS) staining
Vector construction for Arabidopsis transformation
Overexpression and knockout of GmGA3ox1 in soybean
Transcriptome profiling
Scanning electron microscopy
Net photosynthesis rate, Rubisco activity and sugar contentdetermination
Yeast one-hybrid (Y1H) assays
Luciferase (LUC) transient expression assays
Phylogenetic analysis\Haplotype analysis of GmGA3ox1

03
主要结果
3.1 联合连锁分析和GWAS鉴定与大豆种子重量相关的qSW7-1
我们从184个RIL(来源于KF No.1和NN 1138-2之间的杂交)的二分群体中收集了三种环境中的100粒种子重量数据。100粒种子的重量在不同环境中表现出很大的差异,NN 1138-22的100粒重量高于KF No.2(表S2)。RIL的频率分布呈正态分布(图S1a),表明种子重量是一个复杂的数量性状,由多个基因控制。
通过连锁图谱鉴定了分布在第7、14、17和19号染色体上的共7个显著QTL(图1a)。其中,只有位于7号染色体上的QTL(命名为qSW7-1)在两种环境中被共同检测(图1a)。其他研究也报道了该基因座。然后,在六个环境中收集了含有211份大豆材料的自然群体的100粒种子重量数据。与RIL相似,自然种群的频率分布也呈正态分布(图S1b;表S3)。GWAS鉴定出49个显著的SNP,分布在第1、2、4、5、6、7、8、9、10、11、16、17、18和20号染色体上(图1b–g;表S4)。在这些SNP中,在所有六种环境中都检测到了7号染色体上最显著的SNP AX-94034903(P=5.29 9 10–7)。
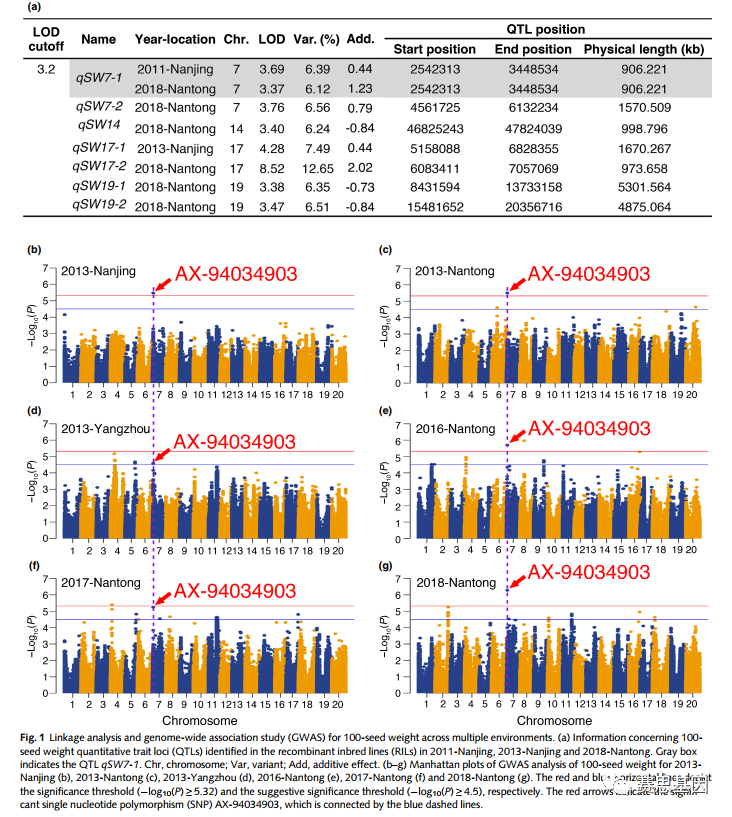
Fig. 1
SNP AX-94034903位于qSW7-1内(图2a)。在多个环境中的两个种群中检测到的重叠区域表明,该基因座对种子重量的控制做出了强大而重要的贡献。

Fig. 2a
3.2 编码GA3b羟化酶的GmGA3ox1是候选基因
通过连锁图谱确定的QTL qSW7-1的置信区间和通过GWAS分析确定的显著SNP AX-94034903显示了7号染色体上123.2kb的重叠区域(图2a)。在该重叠区域中发现了17个基因模型,其中11个基因根据KF No.1和NN 1138-2的全基因组测序显示了亲本系之间的核苷酸序列差异(图2a;表S5)。然后我们测定了这11个基因的转录水平。Glyma07g033800,其序列仅在GmGA3ox1的启动子区域中在两个亲本之间变化(NN 1138-2和KF No.1分别在启动子中插入了7对和20对连续的TA碱基;图2a),在NN 1138-22中的表达比在KF No.1中高出近25倍(图2b)。这表明启动子区13对连续TA的缺失导致Glyma07g033800的高表达。这增加了NN 1138-2中的100粒种子重量。其他10个基因的转录物丰度在亲本系之间没有显著变化(图S2a)。
系统发育分析表明Glyma07g033800是拟南芥AtGA3ox1的直系同源基因(图S2b),它编码一种催化生物活性的GA生物合成的GA3b羟化酶,而其他10个基因未注释为与植物产量相关(表S5)。Glyma07g033800基因被命名为GmGA3ox1,用于进一步研究。
我们检查了GmGA3ox1在不同大豆组织中的表达模式,发现该基因主要在叶和茎中表达(图S3a)。这一发现与通过GUS染色在这两种组织中检测到的GmGA3ox1的强启动子活性一致(图S3b–f)。为了初步检查GmGA3ox1的功能,我们在拟南芥atga3ox1突变体中异位表达GmGA3 ox1,该突变体表现出半干旱表型,种子重量和莲座大小降低(图2c,d)。表型分析表明,GmGA3ox1的过表达显著增加了atga3ox1突变体的莲座大小、1000粒重和种子产量(图2c–g)。总之,GmGA3ox1可能是种子重量的候选基因。

Fig. 2
3.3 GmGA3ox1的自然变异与种子重量相关
为了探索大豆中GmGA3ox1的遗传变异,对373份主要来自中国不同地理区域的材料进行了全基因组测序:该小组包括121种野生大豆植物(G.soja)、197个地方品种和55个品种(图S4a)。在自然条件下对373份材料的田间评估显示,栽培大豆植株的100粒重显著高于野生大豆植株,品种的物候期最大(图S4b)。根据这些重测序数据,在GmGA3ox1的4.2kb基因组区域中发现了19个多态性位点,该区域从启动子延伸到30-UTR。
基于这些结果,定义了30个GmGA3ox1单倍型,并在系统发育上分为两个主要类群,命名为H-I和H-II(图3a,S4c)。含H-I的材料的100粒重显著高于含H-II的材料(图3b),而在H-I和H-II之间没有观察到种子产量的显著差异(图S5a)。这些结果表明,GmGA3ox1的H-I可能是提高大豆种子重量的有益单倍型。
基于GmGA3ox1的关联分析表明,10个多态位点与100粒重显著相关。其中,三个多态性位点位于启动子区,五个多态性位置位于外显子区,导致非同义突变(图S5b,d)。我们检测了69份大豆材料叶片中GmGA3ox1的转录丰度(表S6)。GmGA3ox1表达与100粒种子重量呈正相关(r=0.52,P<0.0001),但与种子产量无关(r=0.21,P=0.1)(图3c,S5c)。图3c中偏离趋势线的几个点可能是由GmGA3ox1中的五个非同义突变引起的(图S5b,d)。此外,H-Ipro单倍型中GmGA3ox1的表达水平显著高于H-IIpro单倍型(图S5e)。总之,这些结果表明,GmGA3ox1表达的差异可能是大豆种子重量表型变异的原因。
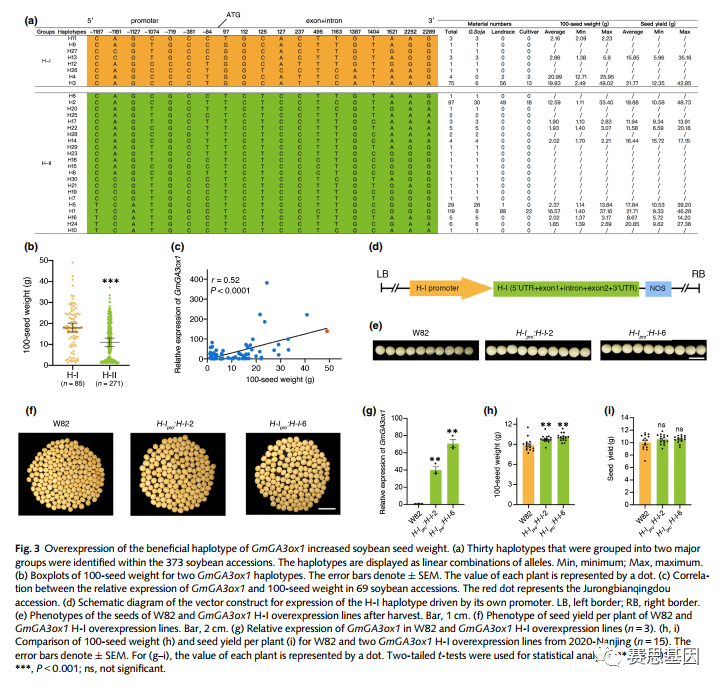
Fig. 3
3.4 GmGA3ox1有益单倍型的应用增加大豆种子重量
将大豆地方品种Jurongbianqingdou 的GmGA3ox1 H-I的4.2kb基因组序列导入具有H-II背景的品种W82;转基因由其自身的启动子驱动(图3d)。与W82相比,转基因系表现出GmGA3ox1的高表达,并在自然条件下表现出更高的种子重量表型(图3e,g,h)。
种子大小的进一步比较表明,转基因系的种子长度长于W82,而种子宽度或厚度没有显著差异(图S6f–i)。H-Ipro:H-I系显著增加了植株高度,但不影响主茎的节数(图S6a,b)。此外,H-Ipro:H-I系略微减少了豆荚和种子数量,因此,尽管100粒种子重量增加,但种子产量略有提高,但没有显著提高(图3f,I,S6c–e)。这些结果表明,GmGA3ox1是调节种子重量的关键基因,可能在控制大豆种子产量方面发挥潜在作用。

Fig. 3e-h
3.5 GmGA3ox1的敲除降低了种子重量,但提高了种子产量
为了进一步验证GmGA3ox1在产量相关性状中的调节作用,我们应用短回文重复序列(CRISPR/Cas9)突变来敲除大豆品种Jack(其单倍型属于H-I组)中的GmGA3 ox1。获得了两个含有四种类型纯合突变的转基因系(命名为KO-1a#、KO-1b#、KO-2a#、KO-2b#);这些突变涉及源自GmGA3ox1第一外显子中大InDel片段的移码(图S7)。
我们在自然条件下测量了gmga3ox1突变体和Jack植物的农艺性状。与Jack相比,GmGA3ox1敲除的大豆植株表现出显著更低的种子重量和长度,但种子厚度和宽度没有(图4a–c,S8c–e),表明GmGA3 ox1正调节大豆种子重量和种子长度。此外,gmga3ox1突变体的分枝、荚和种子数量显著高于Jack,这些增加导致种子产量显著增加(图4a,d–g)。gmga3ox1突变体的株高明显更短,尽管主茎的节数保持不变(图4a、S8a、b)。比较了gmga3ox1突变体和Jack之间节间V的纵向截面;数据显示,gmga3ox1突变体中节间的细胞宽度(而不是细胞长度)明显被压缩(图4h–k)。这些结果表明,GmGA3ox1突变在提高大豆产量方面发挥了重要作用。
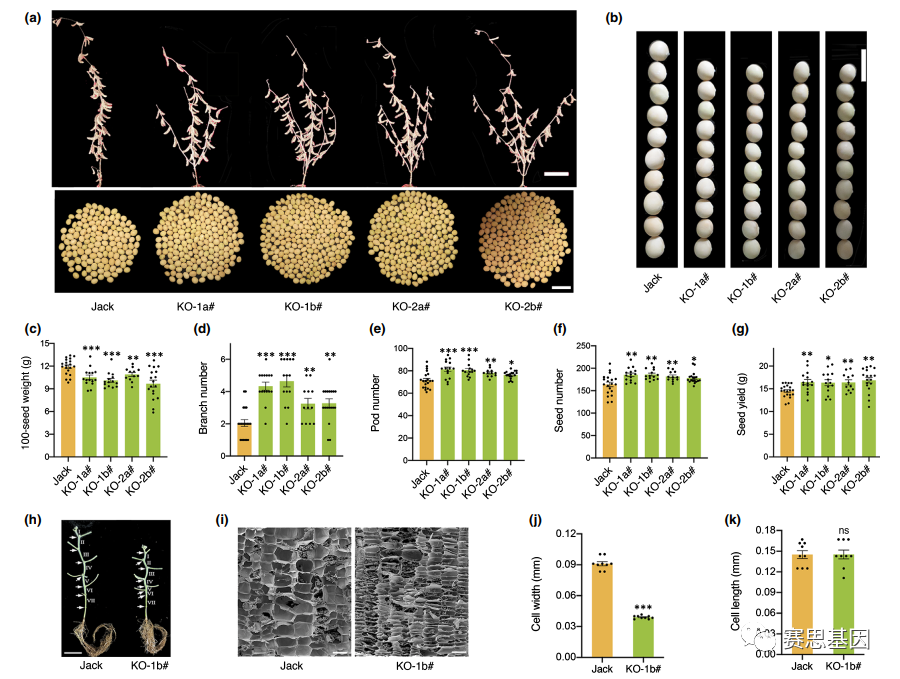
Fig. 4
3.6 GmGA3ox1的敲除降低GA1和GA4含量
为了阐明GmGA3ox1在GA生物合成中的作用,在GmGA3ox1突变体和Jack中测量了8种GA(由GA3ox和前体GA9、GA19、GA20和GA24催化的生物活性GA1、GA3、GA4和GA7)的含量。gmga3ox1突变体中GA1和GA4的含量显著低于Jack,而GA3、GA19、GA20或GA24的含量没有发现差异(图5a、b、S9)。由于大豆中GA7含量低,GA7无法检测,GA9也无法定量。
此外,我们研究了GA应用对gmga3ox1突变体高度的影响。重复施用1mg l -1 GA3引发了gmga3ox1突变体的茎伸长,并使植株高度恢复到对照的高度(图5c,d)。总之,这些结果表明GmGA3ox1的突变抑制了大豆中GA的生物合成。
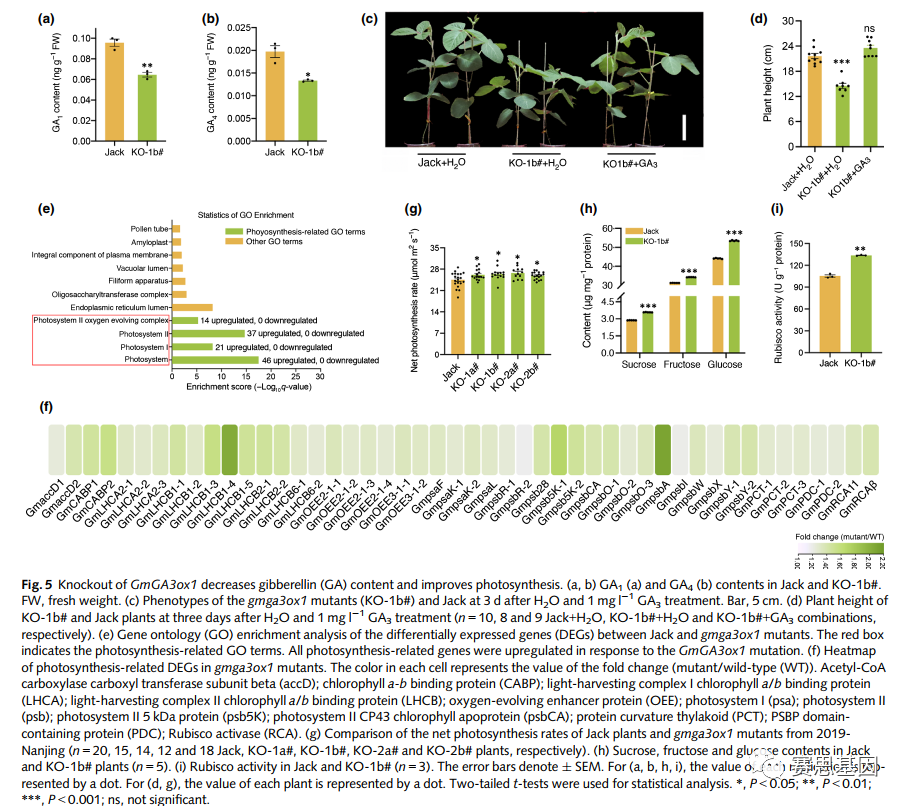
Fig. 5
3.7 GmGA3ox1突变极大地上调了与光合作用相关的基因,从而提高了光合作用
我们使用RNA测序(RNA-seq)来探索gmga3ox1突变体和Jack之间差异表达的基因。与Jack相比,在gmga3ox1突变体中共鉴定出1033个上调的DEG和1445个下调的DEG(表S7)。GO富集分析表明,显著富集的GO大类通常与光合作用有关——光系统、光系统I、光系统II和光系统II氧释放复合体(图5e)。参与光合作用相关途径的所有DEG都上调,包括乙酰辅酶a羧化酶羧基转移酶、光收获复合物I叶绿素a/b结合蛋白、光系统I蛋白、光系II蛋白等(图5f)。特别是,两个Rubisco活化酶基因GmRCAb和GmRCA11在gmga3ox1突变体中上调(图5f;表S7)。此外,共鉴定了189个转录因子,包括21个WRKY、13个bHLH、13个NAC和6个bZIP(表S7)。
鉴于光合作用是决定植物种子产量的重要因素之一,我们测量了gmga3ox1突变体和Jack的净光合作用速率。与Jack相比,GmGA3ox1的敲除显著提高了净光合速率(图5g)。KO-1b#叶片中的蔗糖、果糖和葡萄糖含量高于Jack(图5h)。此外,参与光合作用的关键酶Rubisco的活性在gmga3ox1突变体中显著高于Jack(图5i)。这些结果表明,敲除GmGA3ox1可提高大豆的光合作用。

Fig. 5
3.8 GmbZIPs反式激活Rubisco活化酶基因GmRCAb的表达,该模块由低GA含量高度诱导
鉴于gmga3ox1突变体中光合作用相关途径的DEG都被上调,光合作用速率、Rubisco活性和糖含量也增加,我们接下来研究了潜在的分子机制。RCA编码Rubisco活化酶,在光合作用中催化Rubicso的活化中起着至关重要的作用。我们之前的研究表明,GmRCAb的表达水平与光合作用速率和种子产量呈正相关。GmRCAb和GmRCA11在gmga3ox1突变体中上调(图5f;表S7)。大豆有五个GmRCA基因(GmRCAa、GmRCAb、GmPRCA03、GmRC-A11和GmRCA14),它们彼此具有高度的序列相似性。
我们的研究报告,GmbZIPs可以与GmRCAs的启动子结合。因此,我们随后确定了六种差异表达的GmbZIPs和五种GmRCA之间的调节关系。GmbZIP71和GmbZIP130由于其用于PCR扩增的低表达而被排除。通过Y1H测定,GmRCA11被排除,因为1000 ng/ml 1 AbA不能抑制GmRCA12启动子的基础表达。含有GmbZIP97和GmbZIP159的克隆与GmRCA14pro或GmRCAbpro报告菌株一起在SD/-Leu/AbA250培养基上生长良好,而其他组合,包括涉及pGADT7(AD)空载体的组合,没有生长(图6a),表明GmbZIP77和GmZIP159与GmRC-A14和GmRCAb的启动子相互作用。
此外,烟草中的双荧光素酶报告子测定显示,GmbZIP97和GmbZIP159都增加了GmRCAb的启动子活性,但不影响GmRCA14的启动子(图6b–d)。通过qRT-PCR进一步分析GmbZIP97、GmbZIP159和GmRCAb的表达;结果表明,它们在gmga3ox1突变体中的表达高于Jack(图6e,f)。鉴于GmGA3ox1的敲除抑制了GA生物合成,我们随后检查了GmbZIP97、GmbZIP159和GmRCAb转录物对低GA含量的反应。在用GA合成抑制剂Uni(Jack/Uni)处理的Jack植物中,GmbZIP97、GmbZIP159和GmRCAb的表达水平显著高于用H2O(Jack/H2O)处理的那些植物(图6g–i),表明GmbZIPs–GmRCAb模块在低GA含量的反应中被强烈诱导。gmga3ox1突变体光合作用的增加趋势可能部分归因于GmbZIPs–GmRCAb的高表达。
此外,空间表达谱显示,与其他组织相比,GmRCAb在大豆叶片中高度表达(图S10),这与GmGA3ox1的表达模式一致。我们一起指出了一个假设模型,通过该模型,GmGA3ox1突变体的种子产量增加。在叶片中,GmGA3ox1的敲除降低了生物活性GAs的含量,并增加了GmbZIP97和GmbZIP159的表达。反过来,GmbZIP67和GmZIP159与GmRCAb的启动子结合,并强烈诱导其表达。GmRCAb激活更多Rubisco以增加光合作用。光合作用的增加确保了从叶子到种子的充足能量传输。GmGA3ox1的敲除降低了种子重量/大小,但增加了分枝和荚数,并缩短了植株高度,最终提高了种子产量(图6j)。
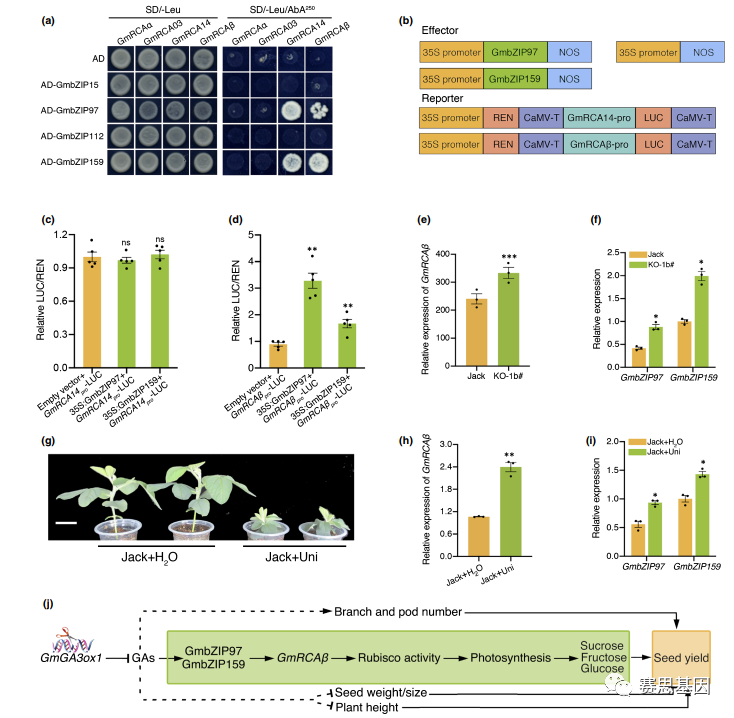
Fig. 6
3.9 在大豆驯化过程中,GmGA3ox1正逐渐用于现代育种
然后,我们使用来自2714份材料的大豆泛基因组组的全基因组测序数据,研究大豆驯化过程中GmGA3ox1的进化史。重新测序数据中GmGA3ox1内一个位点检测到不同碱基的杂合大豆被排除在进一步分析之外。在去除MAF<0.03的多态性后,共鉴定了23个SNP和7个INDEL(插入和缺失)(图S11)。通过分析GmGA3ox1启动子和基因组区域中的核苷酸变体定义了40个单倍型,然后根据系统发育分析将其细分为两组(H-I和H-II)(图7a,S11)。与373份材料的单倍型分析一致,与栽培大豆植株的H-II相比,H-I也显示出显著更大的100粒重(图3b、7b)。从野生大豆植物到栽培大豆植物,尤其是品种,有益H-I的频率大大增加(图7c),这表明GmGA3ox1正逐渐用于现代育种。地理分布分析表明,有益的H-I在南部地区强烈富集,而H-II主要分布在北部地区(图7d)。这些结果表明,北方地区的大多数大豆品种仍然不含H-I,这些品种可以通过引入这种精英单倍型来改良。

Fig. 7

04
结论
在这里,我们结合连锁分析和全基因组关联研究(GWAS)来鉴定一个粒重的主要QTL(qSW7-1),该QTL位于先前报道的大豆7号染色体区域附近。对转化子的表型分析表明,GmGA3 ox1正调节大豆种子重量。GmGA3ox1的敲除通过促进分枝、荚和种子数量以及光合作用,导致种子产量显著增加。进一步分析表明,GmbZIP97和GmbZIP159在gmga3ox1突变体中被诱导,并反式激活Rubisco活化酶(RCA)基因的表达。此外,我们还发现,在大豆驯化过程中,GmGA3ox1正逐渐用于现代育种。GmGA3ox1可作为大豆育种计划的目标。

05
获取原文
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18153
PDF获取:
https://www.scientsgene.com/h-nd-132.html#_np=107_423
文末附件。

END


06
广告
向上滑动阅读正文
赛思基因科技(青岛)有限公司致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
公司可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。