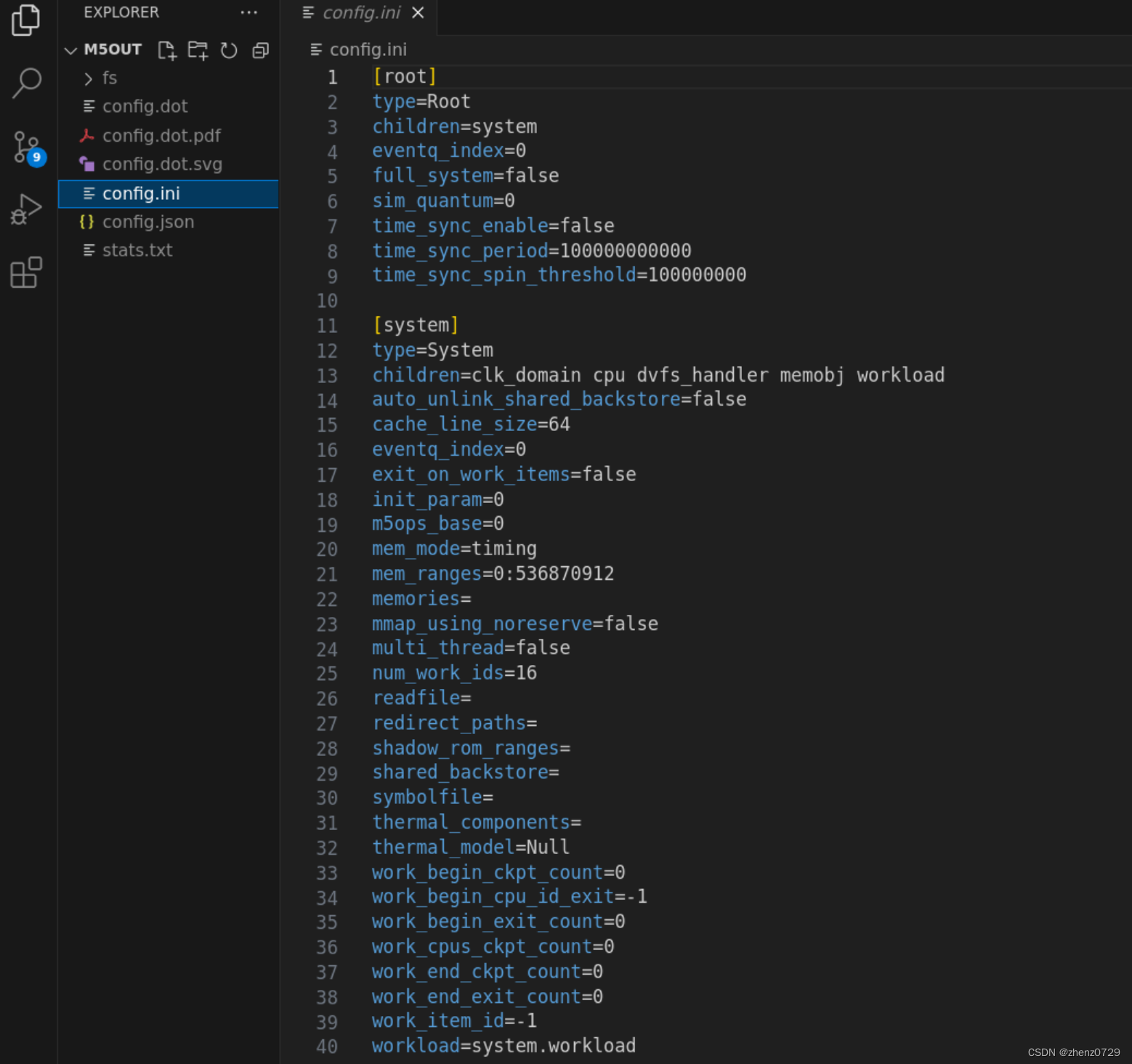
谷禾健康

当地时间12月19日,微软联合创始人、亿万富翁比尔·盖茨发布了对来年的年度预测,称 2024 年将是一个“转折点”。
在这封长达 10 页的信中他展示了对人工智能领域的更多创新、婴儿营养不良问题的突破、气候变化谈判的进展等多方面的期待。
人工智能可以让世界变得更加公平。盖茨对人工智能的预测超越了去年的超声波预测,他断言人工智能的进步将广泛改善全球健康,同时促进创新。
人工智能可以帮助世界各地对抗抗生素耐药性疾病,识别高风险妊娠并估计孕龄等,他预计人工智能在开发新药、诊断疾病和增强教育资源方面将发挥至关重要的作用。
盖茨表示,世界在利用肠道微生物补充剂来解决儿童营养不良方面即将取得突破。
本文我们来看看盖茨眼中的儿童营养不良问题及解法,盖茨预计,随着对微生物组的深入研究,人们将能够开发出以微生物为基础的新型营养治疗方案,这将给解决全球儿童营养危机带来重要进展。
以下是比尔·盖茨年度展望的部分节选
期待已久的营养不良问题的突破即将到来
在盖茨基金会,我们愿意下大赌注。我们知道每一次冒险都可能没有回报,但这没关系。我们的目标不仅仅是逐步取得进展。我们的目标是将我们的努力和资源投入到重大项目中,这些项目一旦成功,就能拯救和改善生命。
当你下一个大赌注时,你往往要等待很长时间才能看到它是否有回报。当你终于意识到它会成功时,那种感觉是难以置信的。我最兴奋的一次豪赌就接近了这一时刻:利用我们对肠道微生物群的了解来预防和治疗营养不良。
经常有人问我,如果只能解决一个问题,我会选择什么。我的答案不变:营养不良。这是世界上最严重的健康不平等现象,大约每四个儿童中就有一个受到影响。如果在生命的头两年得不到足够的营养,身体和智力都无法正常发育。通过解决营养不良问题,我们可以减少导致儿童死亡的最大因素之一。
营养不良的原因远比没有得到足够的食物要复杂得多。大约15年前,研究人员注意到脊髓灰质炎等口服儿童疫苗在营养不良率高的地区效果不佳,他们开始怀疑生活在肠道中的微生物群可能在其中发挥了作用。很明显,有什么东西妨碍了它们被正常吸收。
这种怀疑在2013年得到了证实,当时生物学家杰夫·戈登(Jeff Gordon)发表了一项有里程碑意义的研究,关于马拉维一对双胞胎婴儿的微生物群。微生物群不仅是健康的副产物,还是健康的决定因素。这是第一条重要线索,表明我们或许可以通过改变肠道微生物群来减少营养不良问题。
经常有人问我,如果只能解决一个问题,我会选择什么。我的答案不变:营养不良
在过去的十年里,我们对肠道微生物群的了解比之前的1000年还要多。我们发现,生活在肠道中的细菌可能处于功能失调状态,从而导致炎症,使人无法吸收营养。我们发现,如果及早干预,就能最大程度地改善肠道微生物群。
在人类发育过程中最先出现的肠道细菌之一叫做婴儿双歧杆菌。它能帮助将母乳中的糖分分解成人体生长所需的营养物质。反过来,母乳又为婴儿双歧杆菌和整个肠道微生物群提供食物。这是一个良性循环。但是,如果婴儿一开始没有足够的婴儿双歧杆菌,他们就可能无法从母乳中吸收足够的营养来支持其他必要的肠道细菌的生长。
要克服这种缺陷几乎是不可能的。你可以获得世界上所有富含营养的食物,但这并不管用。如果你的肠道生长路径过早被打乱,你可能永远无法吸收到所需的全部营养。
但是,如果我们能给高危婴儿服用婴儿双歧杆菌作为益生菌补充剂呢?我们能否及早干预,让他们正常发育?
这正是基金会合作伙伴多年来一直在研究的问题——我们终于找到了答案。我们正在对一种可添加到母乳中的婴儿双歧杆菌粉末补充剂进行三期临床。来自5个国家的16000名婴儿参与了试验,研究人员正在对每个婴儿进行跟踪,以确保益生菌既安全又有效。
目前的研究结果令人惊叹:通过给婴儿喂食这种益生菌,可以帮助他们的微生物群进入积极状态,从而使他们能够长大并充分发挥潜力。这对预防营养不良大有裨益。

在婴儿出生前就能改善肠道微生物群,这也让我感到兴奋。新的研究发现,婴儿的微生物群与母亲的微生物群息息相关。解决子宫内的炎症问题会给产妇、胎盘和发育中的胎儿带来更多益处。
如果我们能给准妈妈提供一种益生菌补充剂,让她的孩子从出生第一天起肠道就正常发育,那会怎么样呢?目前还不清楚这些活体生物药到底是什么样的,也不清楚如何给药,这还只是非常早期的研究。但研究表明,健康的微生物群可帮助婴儿在妊娠晚期每天增加5克体重。
在过去十年里,儿童健康领域发展速度超出了我一生中的预期。看到微生物群从一个完全看不见的东西变成解决世界上最大健康不平等之一的关键策略,真是令人惊叹。我迫不及待地期待在接下来一年里我们将学到多少新知识,以及我们将如何运用这些知识来拯救生命...
——比尔·盖茨
儿童营养不良问题的现状如何?带来什么问题?
儿童营养不良问题给全球健康带来巨大挑战,据世界卫生组织和联合国儿童基金会的数据统计,到 2020 年,估计有1.49亿 5岁以下儿童生长发育迟缓(年龄身高低),而 4500万儿童出现消瘦(WLZ 低)。
营养不良及其长期后遗症是该年龄段人群发病和死亡的主要原因。后遗症包括线性生长、免疫和代谢功能以及神经发育的持续损害——所有这些都对当前的干预措施有很大的抵抗力。
从比尔·盖茨的年度总结我们也可以看到,他十分重视肠道微生物对健康的影响,总的来说,微生物方面的研究给儿童健康带来了很大希望。
从肠道微生物组的角度入手,对营养不良儿童进行基于微生物群的相关干预措施,比尔及梅琳达·盖茨基金会已支持多项相关研究。我们来看近期得到该基金会支持的两篇研究文献。
研究一:柳叶刀子刊| 抗生素对严重急性营养不良儿童肠道微生物组的影响
在健康儿童中,肠道微生物组在分类和功能多样性方面稳步增长,直到3岁,其中最明显的变化发生在断奶期间。相比之下,营养不良儿童的肠道微生物组是年龄倒退的,即肠道微生物组与年幼儿童相似。
抗生素是严重急性营养不良的标准治疗方法,因为即使儿童没有出现明显的疾病,他们也可能因急性感染而突然恶化。
在马拉维和尼日尔,与安慰剂相比,短期(即7天)阿莫西林给药已被证明在降低全因死亡率、住院率、腹泻病和改善人体测量方面具有益处。
然而,抗生素治疗对严重急性营养不良儿童的潜在后果(如抗生素耐药性的发展和微生物组破坏)仍存在不确定性。
研究设计
研究人员想要确定 7 天的阿莫西林治疗,对接受严重急性营养不良治疗的儿童肠道微生物组和抗生素耐药组的急性和长期变化的影响。该成果发表在《Lancet Microbe》。

研究人员对尼日尔门诊治疗的严重急性营养不良儿童(6-59 个月)的阿莫西林随机、双盲、安慰剂对照试验 (NCT01613547) 进行了二次分析。从2013年9月23日至2014年2月3日从整个队列中随机选择了161名儿童(n = 2399)进行最初12周的随访。
根据人体测量结果从这161名儿童中选择了一个方便样本,2年后(2015年9月28日至10月27日)进行随访。儿童在基线、第 1 周、第 4 周、第 8 周、第 12 周以及 2 年随访队列中的第 104 周提供了粪便样本。研究人员进行了宏基因组测序,然后对粪便样本进行了微生物组和耐药组分析。38 名无严重急性营养不良的儿童和 6 名与原始队列基线年龄相匹配的严重急性营养不良儿童被用作参考对照。
研究结果
结果表明,营养不良的尼日尔儿童在接受抗生素治疗后,虽然发现克雷伯氏菌属、埃希氏菌属等增加,这些菌可能与更严重的感染相关,但是,微生物组和耐药组扰动的负面影响似乎是短暂的,在三周内完全消失。
进一步观察到阿莫西林治疗的一些意想不到的长期益处,包括改善长期微生物组丰富度,多样性和成熟度。
阿莫西林对长期微生物组成熟的影响

doi.org/10.1016/S2666-5247(23)00213-6
生命头三年肠道微生物组急剧成熟的一些关键驱动因素包括婴儿在出生期间和出生后接触母体微生物、加入牛奶、奶粉以及向固体食物的过渡。在营养不良的儿童中,肠道微生物组的成熟过程和生长都受到阻碍。但在治疗计划中加入抗生素改善了他们的身体测量和微生物组发育。
抗生素可能起到重置的作用,使有助于固体食物消化的微生物群在肠道生态系统中繁衍生息。
“
接受抗生素治疗的效果,对严重营养不良儿童来说算是个好消息,对于这一特定人群,抗生素治疗的益处似乎大于风险,但风险确实存在。研究人员警告说,儿童中已知的耐药细菌和耐药基因的增加不应被忽视。
营养干预措施,如即食治疗性食品,已被证明可以暂时改善肠道微生物组的成熟度和人体测量得分;然而,这种改善并不总是持续的。
在过去的5年里,合理设计的以微生物群为导向的治疗性食品在中度和重度急性营养不良儿童的微生物组恢复和人体测量得分方面显示出了希望。
接下来我们来看对于微生物群为导向的治疗性食品研究的最新进展。
研究二:Nature|针对营养不良儿童的微生物组食品中的生物活性聚糖
生命头两年,肠道微生物群的发育需要与身体其他部分、其他器官系统的发育同步。当这个微生物群不完全形成时,仅仅增加热量是无法修复的。研究人员试图寻找特定的食物成分,以滋养健康的肠道微生物群,希望修复营养不良儿童肠道微生物群的功能失调。
使用传统食疗食品治疗可减少死亡,但并不能实质性改善营养不良的其他长期影响,包括新陈代谢、骨骼生长、免疫功能和大脑发育问题。
近日,来自华盛顿大学医学院的一项研究,已经确定了一种新型治疗食品中天然存在的关键生化成分,以及处理这些成分的重要细菌菌株。
该研究表明,识别这些成分以及作为其治疗靶标的关键促生长肠道细菌菌株,研究强调了了解细菌菌株如何加工特定食物成分的重要性,可以帮助指导当前食品配方的治疗,并可以在未来创造新的、更有效的配方。该研究成果于2023年12月13日发表在《Nature》杂志。

研究人员从试验参与者的粪便微生物群中重建了1000个细菌基因组(宏基因组组装基因组,简称MAG),确定了75个丰度与体重生长(体重长度Z评分变化,简称WLZ)正相关的MAGs。将MAG基因表达的变化表征为治疗类型和WLZ反应的函数,并定量MDCF-2和粪便中的碳水化合物结构。
结果表明,两个与WLZ呈正相关的普雷沃氏菌MAG是MDCF-2诱导的代谢途径表达的主要贡献者,这些代谢途径涉及利用MDCF-2的组分聚糖。
结果强调了微生物组反应的显著菌株特异性,并指出两种普氏菌菌株(MAG Bg0018 和 MAG Bg0019)是 MDCF-2 聚糖代谢和宿主体重生长反应的关键介质。
在生长相关细菌分类群代谢的MDCF中鉴定生物活性聚糖结构,有助于指导关于其在急性营养不良儿童中使用的建议,并有助于开发其他制剂。
在这项工作的基础上,世界卫生组织与比尔及梅琳达·盖茨基金会正在支持一项大型多站点临床试验,研究这种新的治疗性食品——MDCF-2,或微生物组导向的补充食品。
MDCF-2 治疗性食品包括哪些食物成分?
在 2021 年的临床试验中,MDCF-2 治疗性食品作为膳食补充剂提供,以提供儿童每日能量需求的约 20%。
- MDCF-2的成分包括鹰嘴豆粉、大豆粉、花生酱和捣碎的青香蕉果肉;
- 传统高热量即食辅食包括大米、扁豆、奶粉
Prevotella copri 两个菌株对MDCF-2干预改善营养不良的关键作用
研究人员发现:普雷沃氏菌Prevotella copri与儿童的生长发育呈正相关。
P. copri是拟杆菌门的成员,该门的成员含有一组叫多糖利用基因座(PUL)的基因,这些基因介导特定聚糖或一组聚糖的检测、导入和代谢。
它们在利用MDCF-2治疗食品中有益的生物活性碳水化合物结构的代谢途径中表现出活性的增加。
与接受传统治疗性食物的儿童相比,接受MDCF-2的儿童血液中支持肌肉骨骼生长和神经发育的某些蛋白质水平较高,与炎症有关的蛋白质水平较低。也表明,微生物群修复的作用远不止于肠道。
研究人员对这些儿童的粪便样本进行了广泛的基因组分析,了解对这些食物成分有反应的细菌,以及这些细菌对治疗的反应所具有和表达的代谢能力。事实证明,许多与儿童生长密切相关的细菌富含碳水化合物代谢的途径。
分析不同食物中的关键有效成分
在该研究中,通过质谱分析MDCF-2和RUSF两类食品,确定其组成成分。
MDCF-2、RUSF 及其食品成分中的多糖

DOI: 10.1038/s41586-023-06838-3
对这些食物详细分析表明,MDCF-2食物中L-阿拉伯糖、D-木糖、L-岩藻糖、D-甘露糖和D-半乳糖醛酸 (GalA) 显著更丰富(P < 0.05)。
也就是说,MDCF-2含有更多的多糖,即半乳聚糖和甘露聚糖。而传统的治疗性食物RUSF含有更多的淀粉和纤维素。
MDCF-2 有效提高营养不良儿童生长
尽管MDCF-2的热量密度比高热量食物低15%,但与接受传统补充食物的儿童相比,接受MDCF-2治疗的儿童表现出更高的生长速度。
与MDCF-2治疗相关的生长增加与儿童微生物群中某些普氏菌菌株中存在的代谢途径的表达增加有关,这些途径与生物体利用MDCF-2中存在的多糖有关。
“来自食物频率问卷的信息表明,对MDCF-2反应最大的儿童也食用了更多的坚果和豆类作为他们日常饮食的一部分” ,研究人员表示,“这些坚果和豆类具有一些与MDCF-2相同的多糖。这表明可能有机会调整MDCF-2的成分和剂量,以进一步增强其治疗效果”。
营养不良儿童“微生物组修复”的一个定义是,重新平衡有益菌的表现和表达功能,使其呈现出更有利于健康微生物组-宿主共同发育的构型。
以这种方式将膳食聚糖和微生物代谢联系起来,为基于培养的计划提供了一个起点,这些计划旨在检索这些“效应”类群的分离物,用作潜在的益生菌制剂,或者如果与他们渴望的关键营养素相结合,修复对单独基于食物的干预反应不足紊乱的微生物群,提供合生元配方。
当然,P.copri菌株和MDCF-2聚糖之间的关系并不排除其他宏量或微量营养素对MDCF-2在增重方面优于RUSF的贡献。
总之,为改善微生物群的营养干预提供了一种新的见解。
这些和其他研究的结果有助于加深我们对微生物如何与人类细胞和器官合作,从而影响发育生物学的理解,帮助相关产业科研人员开发微生物组导向疗法的方法,帮助开发构建儿童营养健康的新策略,以确保在出生后的头几年形成健康的微生物组,尽可能规避儿童营养不良风险。
同时,随着人工智能技术及高通量测序等先进技术的不断发展,整合食物-微生物-人体交互作用研究,通过对婴幼儿的肠道菌群进行定期检测,可以帮助家长更好地监测儿童肠道菌群的变化,及时发现异常,采取相应的纠正措施,有利于促进儿童的身心健康发育。