分子水平的筛选更多的是检测酶/受体功能的改变或探针/蛋白质结合的抑制,或是检测蛋白质-配体结合的结构、动力学和亲和度。
下面将介绍了荧光偏振、荧光共振能量转移、酶联免疫吸附、表面等离子共振和核磁共振技术几种方法。
■ 荧光偏振
荧光偏振是一项在高通量筛选中应用广泛的技术,适合研究不同质量分子之间的结合。荧光偏振通常与结合物质的百分比成线性比例,由此定量地测定 IC50 值。其多应用于蛋白-分子 (配体)、蛋白-蛋白相互作用,核酸杂交等方面,几乎可以应用于所有蛋白类型,包括 GPCR、核受体及酶等。
Ali Camara 团队将荧光偏振技术应用到高通量筛选中,对 FDA 上市化合物、天然产物等 9680 种活性化合物进行筛选,得到了第一个 HYPE 腺苷转移酶的小分子调节剂。
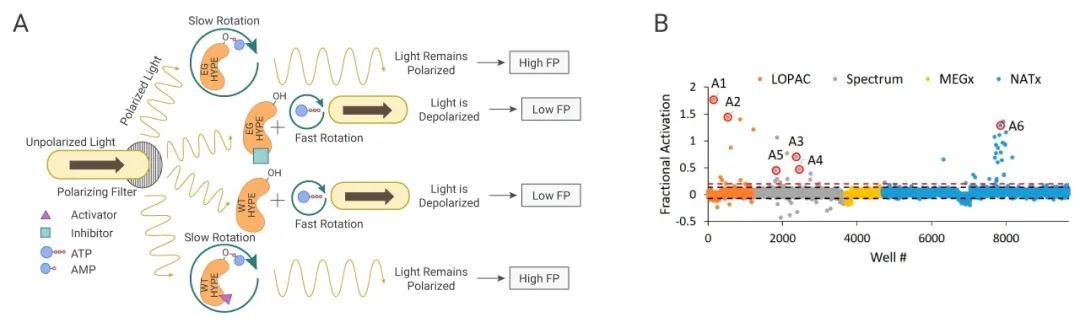
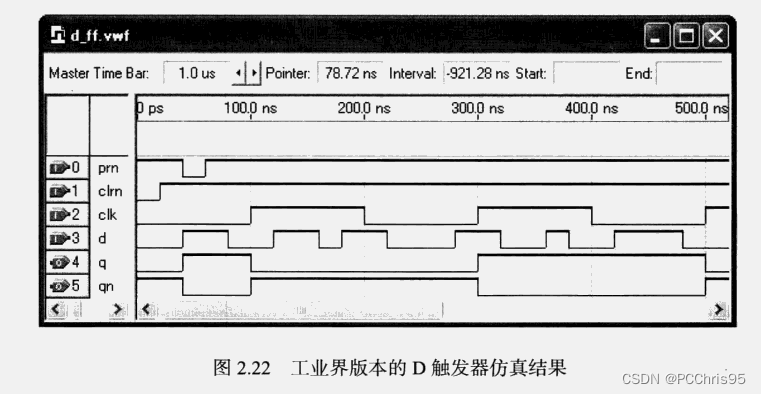
图 1. HYPE 腺苷转移酶的小分子调节剂筛选[3]
目的蛋白的表达和纯化 → 优化分析系统 → 高通量筛选 → 结果分析 → 二次筛选 → 发现了至少两种有效的 HYPE 腺苷转移酶活性调节剂
■ 荧光共振能量转移
荧光共振能量转移适用于检测两个蛋白质之间亲和力的变化,或因其结合构象的变化引起的蛋白质-蛋白质相互作用方式的改变。荧光共振能量转移中来自荧光供体的能量通过偶极-偶极相互作用被受体吸收,而其中能量转移的效率很大程度上取决于供体和受主之间的光谱重叠,以及它们之间的距离和相对方向。
Yoshitomo Shiroma 团队通过构建 DNA strand exchange fluorescence resonance energy transfer (DSE-FRET) 系统,对 NF-κB 特定亚型抑制剂进行筛选,从 32914 种化合物中,获得了 RelA 特异性抑制剂。通过这种筛选方法,甚至能区分 NF-κB 的具体某个亚基。
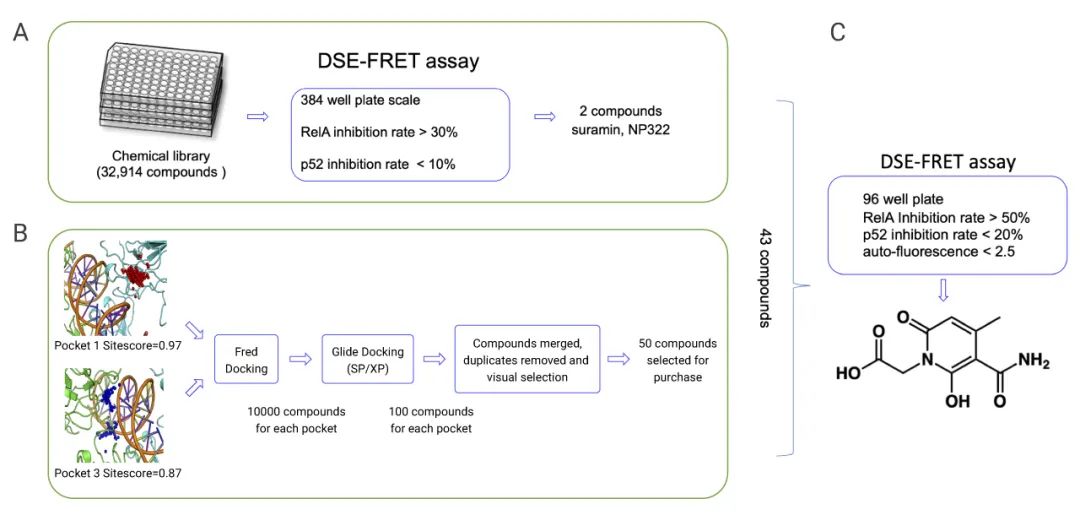
图 2. 使用计算机和 DSE-FRET系统筛选 RelA 特异性抑制剂[7]
a. 首先通过高通量筛选从32914种化合物中筛选出2个化合物,b. 同时通过虚拟筛选选出 41 个相近化合物. c. 最后用DSE-FRET对43种化合物进行复测, 获得了 RelA 特异性抑制剂。
■ 酶联免疫吸附
酶联免疫吸附试验是最常用的实验方法之一,可检测和定量如抗体、蛋白质和激素等物质。但该方法存在灵敏度低等缺点,可以通过减少样品体积,增加控制和吞吐量等方法优化。
氧化应激已被证实参与许多病理生理过程,而抗氧化防御系统中的几个关键酶,包括血红素加氧酶1 (HO-1)、超氧化物歧化酶 (SOD) 和谷胱甘肽s -转移酶(GST)等,主要受到Keap1和Nrf2调控,所以作用于 Keap1-Nrf2 的抑制剂被认为是治疗慢性氧化和炎症应激的重要途径。
Yan Wang 团队建立了一种新的基于酶联免疫吸附的方法,对 1500 种 FDA 批准上市化合物高通量筛选,获得了三种对 Keap1-Nrf2 蛋白相互作用抑制效果较好的小分子。
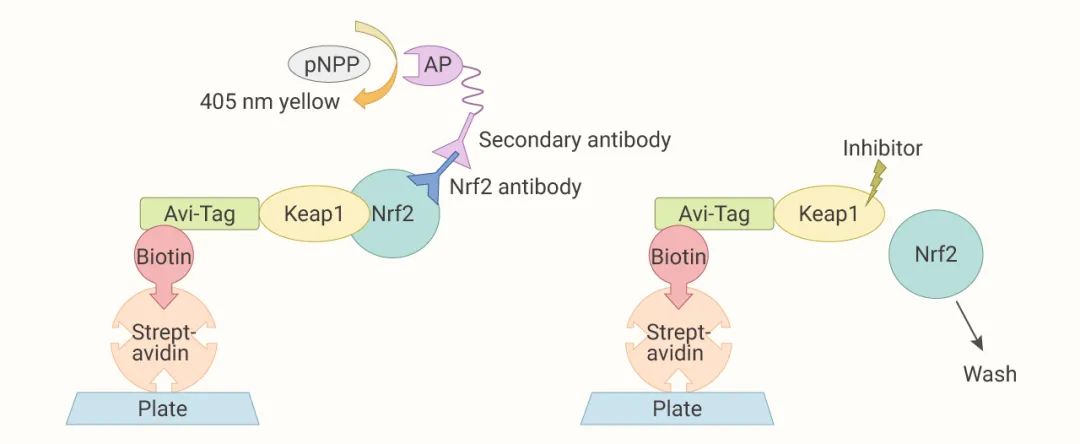
图 3. 评估化学物质对 Keap1-Nrf2 相互作用的抑制作用[12]
Keap1 蛋白用 Avi 标签标记,连接生物素。生物素化的 Keap1 通过生物素-链霉亲和素相互作用与链霉亲和素包被的板结合。Nrf2 添加到板上并被 Keap1 捕获。
■ 其他方法
以上三种高通量筛选方法均利用荧光检测,目前还有其他非荧光途径的检测方法,在实际应用中,多种方法联合使用。
例如,Carlos Alvarado 团队就先后使用表面等离子共振和核磁共振技术两种检测方法,先从 189 个片段化合物库中筛选出 19 个化合物,再经过核磁共振二次筛选出 11 个对局灶黏附激酶的局灶黏附靶向域起作用的化合物。
其他方法还有声雾电离-质谱分析和闪烁接近分析法等。例如 Arseniy M. Belov 等人在 Acoustic Mist Ionization-Mass Spectrometry: A Comparison to Conventional High-Throughput Screening and Compound Profiling Platform 一文中向我们展示了声雾电离-质谱分析的应用,开发了一个高通量能与之兼容的方法,用以检测组蛋白乙酰转移酶活性的抑制。
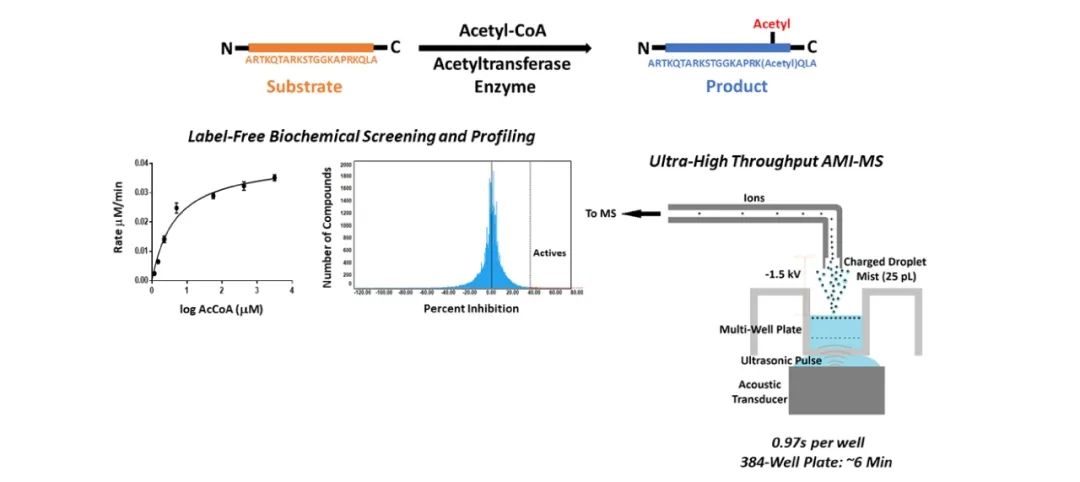
图 4. 声雾电离-质谱分析联用[9]
高通量筛选有许多可用的技术,在选择检测方法时,最重要的标准是先对实验进行构思,再设计适当的筛选方法来检测。例如,在寻找某种酶的抑制剂时,可通过更加直观的分子水平的筛选方法。
两期文章中列出的检测方法虽已经可以涵盖目前发现中的大多数方法,但随着我们对潜在疾病的生物学过程的理解的深入,需要不断开发新的技术和分析方法来研究这些日益复杂的系统。
| 相关产品 |
| 生物活性化合物库 MCE 收录了 11000+ 种具有明确报道的、活性已知、靶点明确的小分子化合物,包括天然产物,新型化合物,已上市化合物及处于临床期化合物等,可以用于信号通路研究,新药研发,老药新用等不同的筛选目的。 |
| FDA 上市库 MCE 收录了 2300+ 个批准上市的化合物,这些化合物已经完成了广泛的临床前和临床研究,具有良好的生物活性、安全性和生物利用度。 |
| 天然产物库 MCE 收录了 2800+ 种天然产物,包括糖类和糖苷,苯丙素类,醌类,黄酮类,萜类,类固醇,生物碱,酚类,酸和醛等,天然产物化合物库是一种有用的药物开发工具。 |
| 片段化合物库 MCE 可以提供 15703 种片段化合物,这些化合物均符合“类药 3 原则 (RO3)”,MCE 片段化合物库是先导化合物的重要来源。 |
| 老药新用化合物库 MCE 老药新用化合物库包括 3500+ 种批准上市药物及临床Ⅰ期以后化合物,这些化合物已经完成了广泛的临床前和临床研究,具有良好的生物活性、安全性和生物利用度,特别适合药物新适应症的研究。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
除以上预制库之外,MCE 还可以根据你的不同需求提供定制库。
更多化合物库请参考:化合物库, 分子库 | 药物筛选, 文献引用 | MCE
参考文献
1. Vincent Blay. High-Throughput Screening: today's biochemical and cell-based approaches. Drug Discov Today. 2020 Aug 12;S1359-6446(20)30305-6.
2. Wendy A Lea. Fluorescence polarization assays in small molecule screening. Curr Opin Biotechnol. Expert Opin Drug Discov. 2011 Jan;6(1):17-32.
3. Ali Camara. A Fluorescence Polarization-Based High-Throughput Screen to Identify the First Small-Molecule Modulators of the Human Adenylyltransferase HYPE/FICD. Int J Mol Sci. 2020 Sep 27;21(19):7128.
4. David W Piston. Fluorescent protein FRET: the good, the bad and the ugly. Trends Biochem Sci. 2007 Sep;32(9):407-14.
5. Yoshitomo Shiroma , Go Fujita , Takuya Yamamoto , Ryou-U Takahashi . Identification of a Selective RelA Inhibitor Based on DSE-FRET Screening Methods. Int J Mol Sci. 2020 Nov 30;21(23):9150.
6. Praveen Bandaru, Dafeng Chu Wujin Sun . A Microfabricated Sandwiching Assay for Nanoliter and High-Throughput Biomarker Screening. Small. 2019 Apr;15(15):e1900300.
7. Lowela Siarot . Identification of human immunodeficiency virus type-1 Gag-TSG101 interaction inhibitors by high-throughput screening. Biochem Biophys Res Commun. 2018 Sep 18;503(4):2970-2976.
8. Carlos Alvarado. Development of a Fragment-Based Screening Assay for the Focal Adhesion Targeting Domain Using SPR and NMR. Molecules. 2019 Sep 14;24(18):3352.
9. Arseniy M Belov, Joseph Kozole, Mark F Bean, Carl A Machutta, Guofeng Zhang, Enoch N Gao, Luke Ghislain , Sammy S Datwani , Melanie Leveridge, Roland S Annan. Acoustic Mist Ionization-Mass Spectrometry: A Comparison to Conventional High-Throughput Screening and Compound Profiling Platforms. Anal Chem. 2020 Oct 20;92(20):13847-13854.
10. Shaogui Wu , Bailing Liu. Application of scintillation proximity assay in drug discovery. BioDrugs. 2005;19(6):383-92.
11. Mohammed A Kashem . A high-throughput scintillation proximity assay for sphingosine-1-phosphate lyase. Assay Drug Dev Technol. 2014 Jun;12(5):293-302.
12. Yan Wang, Chu-Ying Xiao, Huang-Quan Lin, et al. Development of an enzyme-linked immunosorbent assay for Keap1-Nrf2 interaction inhibitors identification. Redox Biol. 2020 Jul;34:101573.




![[附源码]java毕业设计基于篮球云网站](https://img-blog.csdnimg.cn/669010b0ed304d2c8347016b811079c1.png)