文章信息
题目:Alcohol acyl transferase genes at a high-flavor intensity locus contribute to ester biosynthesis in kiwifruit
刊名:Plant Physiology
作者:Edwige J F Souleyre et al.
单位:New Zealand Institute for Plant and Food Research
日期:02 August 2022
01
摘要
挥发性酯是常见水果,包括苹果(Malus domestica)、草莓(Fragaria spp.)和香蕉(Musa sapientum)风味强度的关键化合物。在猕猴桃中,丁酸乙酯和其他酯被认为有助于提升商业品种的果味和甜味。
在这里,我们研究了中华猕猴桃定位种群(AcMPO)中猕猴桃酯产生的遗传基础。在第20号染色体上的高香味强度(HiFI)基因座上发现了产生多种酯的主要数量性状基因座。该基因座与Red5基因组中的八个串联排列的醇酰基转移酶基因共定位,这些基因以与酯产生对应的成熟特异性方式表达。
生化特征表明,HiFI基因座上的两个基因,醇酰基转移酶16-b/c(AT16-MPb/c),可能对丁酸乙酯的产生起了最大作用。第三个基因AT16 MPa可能对丁酸己酯和己酸丁酯的产生有更多贡献,这两种酯在AcMPO中分离。AcMPO的感官分析表明,来自高酯浓度分离系的水果通常被描述为“果味”,而不是“豆味”。
RNAi对AT16 MPa–c的下调使成熟“Hort16A”果实中的酯产量减少了90%以上。气相色谱嗅觉测定表明,丁酸乙酯造成的主要“水果”气味消失。将未改良的猕猴桃种质与商业品种的种质进行比较表明,选择高浓度烷基酯(而不是绿色调醛)的果实可能是猕猴桃栽培中的一个重要选择性状。了解HiFI位点的酯生成是保持和改善猕猴桃风味强度的关键步骤。
02
技术路线
kiwifruit AcMPO F1 population was obtained from an intraspecific cross
Volatile analysis of AcMPO
Mapping analysis
Cloning and sequencing from AcMPO
Red5 RNA extraction and volatile sampling
RT–qPCR
Cloning and transient expression of AATs in N. benthamiana
Cloning and expression of AATs in E. col
AAT activity assays
Transgenic plant growth and analysis
GC–O analysis
Sensory analysis of AcMPO
Analysis of volatiles in Actinidia germplasm and domesticated material by purge and trap
03
主要结果
3.1 中华猕猴桃种群中挥发性酯类的定位
通过GC–MS分析获得了两个挥发性数据集,这两个数据集使用了一个双杂交获得的中华猕猴桃制图种群(AcMPO)中125个个体的成熟果实。鉴定出60种挥发性化合物,包括29种酯和9种醇(补充表S1A)。最丰富的化合物是丁酸乙酯,它在所有绘图群体成员中都检测到。源自丁酰CoA的丁酸酯是主要的酯,占成熟水果中平均总酯的95%,而乙酯和甲酯(分别源自乙醇和甲醇)的总和占94%(补充表S1A)。(E) -2-己烯醛是AcMPO中的主要醛,1,8-桉叶醇是主要萜烯(补充表S1A)。
溶剂萃取后,鉴定出104种挥发性化合物,包括48种酯和13种醇(补充表S1B)。观察到类似的定性模式,丁酸乙酯是最丰富的化合物,丁酸酯占平均总酯的63%,而乙酯和甲酯占73%(补充表S1B)。在溶剂分析中检测到其他化合物,包括硫代酯(例如3-(甲硫基)丙酸乙酯)、羟基酯(例如苯甲酸3-羟基丁酯)、辛酸和丁酸以及萜烯哌啶酮(补充表S1B)。相关矩阵(补充表S1C)显示,多种酯的产量呈正相关(例如,丁酸己酯与五种其他丁酸酯的产量相关,丁酸丁酯与四种丁酯的产量相关),而萜烯1,8-桉叶醇的产量与大多数酯的产量呈负相关。
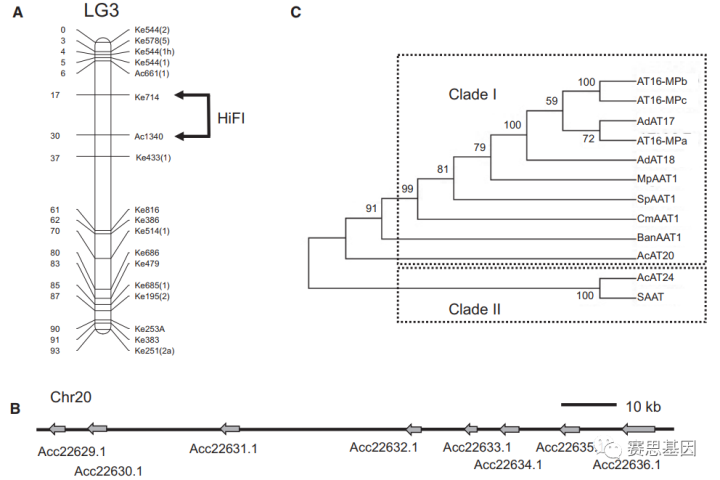
使用非参数Kruskal–Wallis(K–W)检验对挥发性数据进行分析,确定了与17种单酯和7种醇的产生相关的24个数量性状位点(QTL)。影响多个酯化合物的QTL与羊草连锁图谱上LG3上的标记Ke714和Ac1340(补充图1A和补充表S2A)相关,而在LG20和27上观察到单酯的其他QTL(补充表S2B)。
对于酯,包括己酸丁酯(K–W P=2.27 E–07)、丁酸己酯(8.20 E–11)、丁酸戊酯(4.42 E–08)和己酸甲酯(6.08 E–05),观察到与母体Ke714标记物的显著Kruskal–Wallis关联(补充表S2B)。尽管在种群中观察到丁酸乙酯和丁酸甲酯浓度的显著变化(41000倍,补充表S1),但没有标记物与这些化合物相关。
在LG7上鉴定了三种醇((E)-己-3-烯醇、己醇和(E)-2-己-2-烯醇)的QTL。苄醇的QTL与LG3上酯的QTL相关。LG3上的Ke714标记位于Red5基因组组合中20号染色体的近端,为2.67 Mbp,而Ac1340标记无法定位。Ke714标记附近(2 Mbp以内)的基因扫描(补充表S3)确定了一个复杂的AAT基因簇,包括8个串联排列的基因模型(Acc222629–Acc22636),从3684900到3791830 bp(补充图1B)。8个基因簇被指定为高风味强度(HiFI)基因座。还观察到可能参与酯生物合成的另外六个候选基因(例如羧酸酯酶基因、酮酰基CoA合成酶和酰基CoA结合蛋白)(补充表S3);然而,最佳的候选基因被认为是HiFI基因座的八个AAT基因模型。
根据补充图S1中的比对,HiFI基因座的所有八个基因模型具有446–457个氨基酸的完整ORF,除了Acc22631.1和Acc22632.1,前者的ORF较短,为398个氨基酸,后者似乎缺失了50末端的大部分,导致293个氨基酸的截短蛋白(补充表S4)。八个基因模型共享AAT基因家族的特征,如HXXXD活性位点和保守基序DFGWG。为AAT分支I成员鉴定的PLLLQVT保守位点也存在于所有基因模型中,除了不完整基因模型Acc22632.1(补充图S1)。
3.2 Red5中HiFI位点基因的表达和酯挥发物的释放
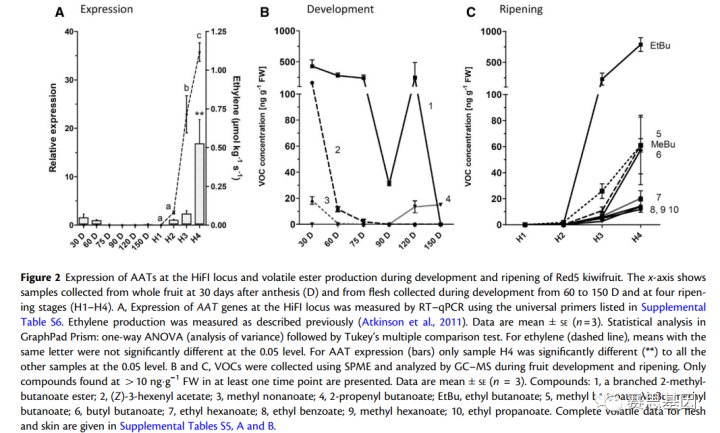
为了研究HiFI基因座AAT基因的表达,基于该基因座的所有全长AAT基因模型设计了一对通用引物,并在六个发育阶段(开花后30-150天[DAA])和四个成熟阶段(H1–H4)监测Red5中的表达。结果表明(图2A),在Red5中,来自HiFI基因座的AAT表达与果实成熟密切相关。
在75至150 DAA的果实发育期间或收获时(H1)未检测到表达。AAT基因表达在H2成熟阶段显著增加,此时首次检测到乙烯的产生(图2A)。在食用成熟水果(H3)和水果进一步成熟(H4)时,表达随着乙烯产量的增加而继续增加。H1和H4成熟阶段的基因特异性表达分析表明,只有两个AAT1基因模型Acc222629.1和Acc222632.1在HiFI基因座表达(补充图S2)。在H1成熟阶段几乎没有检测到这两种基因的表达,但在产生乙烯的成熟果实(H4)中表达较高。
鉴于Acc222632.1是一个截断模型,Acc222629.1可能是Red5中HiFI基因座上最重要的成熟相关AAT。使用SPME研究了Red5中挥发性酯的排放,然后在用于基因表达分析的相同发育阶段(图2B)和成熟阶段(图2C)进行了GC–MS分析。酯对成熟的Red5猕猴桃中发现的挥发性有机化合物有很大贡献,在果肉中检测到26种酯(95.1%为H3阶段的乙酯和甲酯,补充表S5A),在H3阶段在皮肤中检测到23种酯(83.2%为乙基和甲酯,补充表S5B)。酯浓度在食用成熟阶段H3显著增加(占总挥发物的40.3%),在阶段H4达到最大排放量(占果肉中总挥发物总量的81.2%,图2C;补充表S5A)。在H3阶段,主要的酯是丁酸酯和苯甲酸酯,分别占总酯的80.6%和10.6%,其次是己酸酯(4%,图2C)。在H4阶段,酯达到最高浓度,丁酸乙酯占总酯的74.4%,最高产量为786.1 ngg–1 FW,其次是苯甲酸甲酯和丁酸甲酯(均为60.9 ngg–2 FW)和丁酸丁酯(57.4 ngg–3 FW,图2C)。13种酯的产生与HiFI基因座AAT基因的表达相匹配。
然而,乙酸3-己烯基酯和支链2-甲基丁酸酯在30 DAA时达到峰值,并在整个成熟过程中降低,而2-丙烯基丁酸酯在120 DAA时最高达到13.4 ngg–1 FW(图2B)。这表明,在果实早期发育过程中,其他位点的AAT可能参与了这些化合物的合成。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
3.3 作图群体中HiFI位点AAT的特征
从AcMPO(命名为MPM)的母本和13个个体后代的成熟果实中获得cDNA。成功扩增了三个AAT基因,与Red5中HiFI基因座的七个完整基因模型具有86.4%–97.2%的同一性(引物见补充表S6),表明这些是成熟AcMPO果实中表达的相应AAT基因。三个AcMPO AAT彼此显示出89.9%–98.5%的氨基酸同一性,并且与成熟的Red5水果中表达的基因模型Acc222629.1显示出最高的同一性(补充图S2)。AcMPO中的一个基因与先前在A.chinensis中鉴定的AcAT16相同,命名为AT16 MPa。来自AcMPO的另外两个基因被命名为AT16 MPb和c.AATs,包括来自美味中华猕猴桃的AdAT17和来自软枣的AaAT18,也显示出485%的同一性,这表明来自HiFI基因座的基因在多个猕猴桃物种中表达(补充表S7)。
基因特异性表达分析表明,AT16 MPa、b和c在成熟的MPM果实中以相似的水平表达并高度表达(补充图S3)。猕猴桃AAT与其他水果AAT的系统发育分析揭示了两个主要类群(图1C)。AT16-MPa–c聚集在AAT分支I内,这是一组AAT,显示参与苹果、香蕉、番茄和甜瓜中的果酯生物合成。第二个分支包含来自草莓“Elsanta”的SAAT,已知其参与酯生物合成,以及一个未表征的推定猕猴桃AAT(AcAT24)。
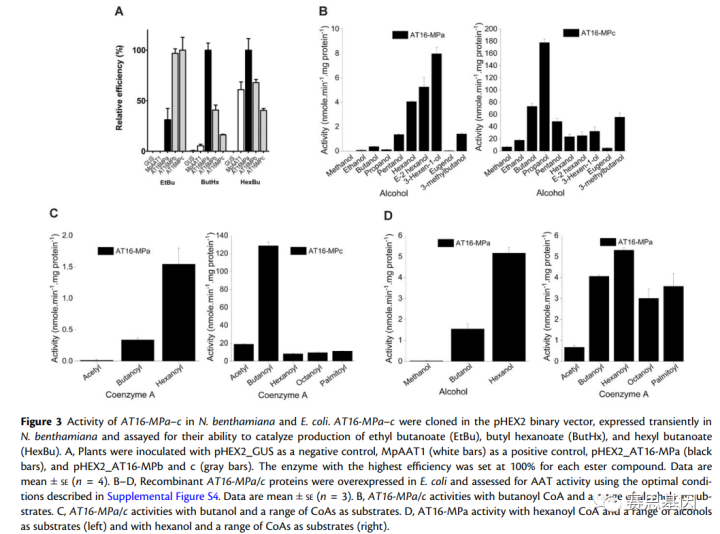
AT16 MPa–c被克隆到pHEX2二元载体中,并在烟草叶片中瞬时过表达,通过GC–MS评估了每种酶产生丁酸乙酯、丁酸己酯和己酸丁酯的能力。AT16 MPb和c均以相似的效率催化丁酸乙酯的生产,而AT16 MPa在相同条件下仅以三分之一的效率催化了丁酸乙酯的产生(图3A)。相反,AT16 MPa比AT16 MPb(效率为40%–70%)和AT16 MPbc(15%–40%;图3A)更有效地催化己酸丁酯和丁酸己酯的生产。阳性对照MpAAT1(来自苹果)主要产生丁酸己酯,不利于丁酸乙酯的产生,这一结果与先前的研究结果一致。
使用pHEX2-GUS构建体的酯产量可忽略不计。AT16 MPa和c在大肠杆菌中过表达,并确定了活性测定的最佳条件(30 c/pH 7;补充图S4)。AT16 MPb没有进一步研究,因为它与AT16 MPc相比仅显示了五个氨基酸差异,并且在植物中瞬时过表达时产生了类似的酯(图3A)。
当用丁酰基CoA或己酰基CoA测试时,AT16-MPa表现出对6碳链醇的偏好(图3,B和D)。当供应丁醇和己醇时,AT16 MPa对己酰CoA产生最高活性(图3,C和D)。当使用丁酰基CoA进行测试时,AT16 MPc通过使用广泛的直链醇以及支链醇和丁香酚合成了广泛的酯,最高的活性是对丙醇(图3B)。当提供长链CoA和丁醇作为底物时,AT16 MPc产生了广泛的挥发性酯,其中最高的活性是丁酰基CoA(图3C)。与AT16 MPa相比,当供应丁酰基CoA时,AT16 MPc对乙醇和甲醇显示出更大的活性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.4 HiFI位点AATs的下调降低了成熟猕猴桃中挥发性酯的产生
为了确定HiFI基因座的AAT基因对猕猴桃挥发性酯产生的重要性,以AT16 MPa–c为靶点,通过RNAi下调产生转基因A.chinensis var.chinensis“Hort16A”植物。pTKO2_AT16构建体中的301 bp发夹区预计会下调AT16 MPa–c,因为它们共享490%的核苷酸同一性,而不是其他中华猕猴桃AAT基因,例如AcAT20(AAT基因与HiFI基因座最密切相关;图1C),其显示50%的核苷酸同同一性。产生了10个转基因系,其中4个在密闭温室条件下开花和结果。转基因品系与在相同条件下生长的对照品系无法区分。尽管在封闭条件下生长的所有植物的结实率都很低(每株葡萄结5–15个果实),但除以下所述外,敲除品系在发育或成熟过程中没有观察到明显的表型变化。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
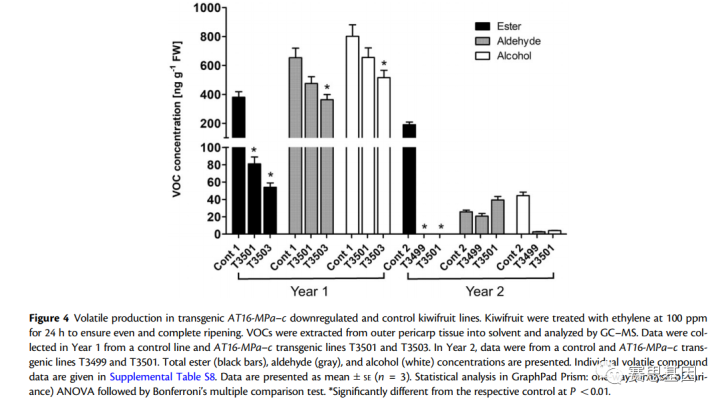
基因表达分析表明,三个品系(T3499、T3501和T3503)在成熟水果中AT16 MPa–c基因表达降低了490%(补充图S5)。然后通过GC–MS分析这三个转基因品系和匹配对照的溶剂提取物,以确定成熟水果中的挥发性产生(图4;补充表S8)。
与两个评估季节的对照相比,各品系的挥发性酯总产量减少了80%-100%。在转基因系中未检测到丁酸甲酯和丁酸丁酯,丁酸乙酯的浓度降低了85%–100%。相反,转基因品系和对照品系之间的醛和醇产量没有一致的差异。气相色谱-质谱分析用于评估六种挥发性化合物对成熟猕猴桃香气的贡献:四种酯(丁酸乙酯、丁酸甲酯、乙酸丁酯和丁酸丁酯)、醛己醛和萜烯1,8-桉叶醇。使用密闭温室种植的成熟“Hort16A”水果的溶剂提取物。
在“Hort16A”水果提取物中,丁酸乙酯的香气强度很强,具有甜美的果香。两种转基因水果提取物中的参与者基本上没有检测到丁酸乙酯。这些结果表明,通过下调AT16 MPa–c降低丁酸乙酯浓度,影响了转基因系成熟果实中猕猴桃香气的感官感知。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
3.5 酯浓度对猕猴桃的风味强度很重要
Ke714标记与HiFI基因座紧密相连。为了进一步改善这种联系,设计了两个进一步的高分辨率融合(HRM)标记,以检测候选HiFI基因座本身内的变体(一个母亲标记和一个父亲标记)。这些基因用于对AcMPO子代进行基因重组。第一个标记(ID1170)在一个6-bp的母体indel上扩增,两个等位基因都可以被评分。第二个父系标记(SNP10)的引物以多态性核苷酸结束,因此仅扩增了1/2后代中的一个亲本等位基因,另一半为阴性。
当比较母体基因型时,群体中明显分离出多种酯类。高酯类中这些分离酯的平均总酯浓度比低酯类高411倍(表3)。与Ke714标记一样,丁酸乙酯和丁酸甲酯的生产没有与母体HiFI标记分离。
为了研究分离酯对猕猴桃感官特性的贡献,对AcMPO 84个成员的2–12个成熟水果进行了五个变量的评估:可溶性糖含量(%SSC)和四个感官属性(甜度、酸度、质地和总体感官评分)。
PCA(图5)显示了与高酯类相关的项主要分布在右象限,而与低酯类相关联的项集中在图左半部分的x轴上。第一个主成分由更积极的变量(总体感官得分、感官甜度、感官质地、SSC)正向分离(在x轴零点的右侧),而由感官酸度得分略微负向分离(在x轴零点的左侧)。描述高甜度、含糖量和平衡酸度的形容词,如“甜”、“果味”、“水果甜”、”糖甜“、”微酸“,与高酯类最相关。位于右上象限的“霉味”和“霉味甜”等术语最常用于水果在感官分析之前或期间开始过度成熟。过度成熟导致猕猴桃含糖量高,口感发霉,因此与SSC变量轴对齐。诸如“硬”、“酸”、“豆”和“草”等形容词是属于低酯类的最负面词汇。它们位于PCA的左侧,在那里投射了感官酸度可变轴。最喜欢的水果的感官描述符与整体感官得分的轴对齐,位于图的右下象限。诸如“甜水果”、“糖”和“平衡”等术语大多是指酸度和甜味平衡的理想猕猴桃。这些术语主要是在品尝高酯类水果时注意到的。
正在上传…重新上传取消
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
3.6 酯作为猕猴桃驯化过程中的选择性状
为了测试驯化是否影响了猕猴桃的风味强度,通过吹扫和捕集收集了成熟的果实挥发物,并通过GC–MS从一组来自中国紫荆和美味紫荆的“未改良”种质材料中进行分析,并与每个物种的一组“改良”品种/品种进行了比较。改良材料来自新西兰、日本和中国的育种计划。
挥发性分析的重点是HiFI基因座产生的两种关键挥发性酯(丁酸乙酯和丁酸甲酯)和两种关键醛((E)-2-己烯醛和己醛)的浓度,这两种醛在几乎所有猕猴桃品种的成熟果实中都有发现。
两种关键醛类和酯类的浓度在美味中华鲟果实中通常高于中华猕猴桃(图6;补充表S10)。在中华猕猴桃(图6A)和美味猕猴桃(图6B),醛浓度范围很窄,在改良和未改良材料之间,(E)-2-己醛和己醛的平均浓度之间没有观察到统计学上的显著差异。
这些数据表明,与未改良的种质相比,改良材料中两种酯的平均浓度高于未改良材料。值得注意的是,改良材料中的丁酸乙酯浓度显著高于未改良材料(图6A)。这表明,与野生种质相比,中华猕猴桃品种的风味更浓郁,更甜,酯含量更高。
正在上传…重新上传取消
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
04
结论
为了在面临Psa抗性和长期储存的选择压力时保持猕猴桃的高风味强度,了解有助于消费者感知的化合物并定义其生产的基因位点是很重要的。本文中的数据证明了一类关键挥发物(酯)对猕猴桃感官感知的重要性,并将其产生与HiFI基因座联系起来。了解该基因座基因之间的功能冗余和特异性将使我们的结果能够通过标记辅助选择应用于培育新的猕猴桃品种。
05
获取原文
原文链接:
https://academic.oup.com/plphys/article-abstract/190/2/1100/6653309?redirectedFrom=fulltext#
PDF获取:
https://www.scientsgene.com/h-nd-133.html#_np=107_423
文末附件。
赛思基因www.scientsgene.com有限公司致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
赛思基因可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。


![[附源码]计算机毕业设计springboot健身房预约平台](https://img-blog.csdnimg.cn/3d27a133a24549d88f11ac57a3e53a6e.png)



![[附源码]计算机毕业设计springboot基于微信小程序的网络办公系统](https://img-blog.csdnimg.cn/0bdec4ef02fb45b68759d8c7eee2f73b.png)

![[附源码]计算机毕业设计springboot咖啡销售平台](https://img-blog.csdnimg.cn/d8b39b105c684714a1dcfd6e738cb930.png)