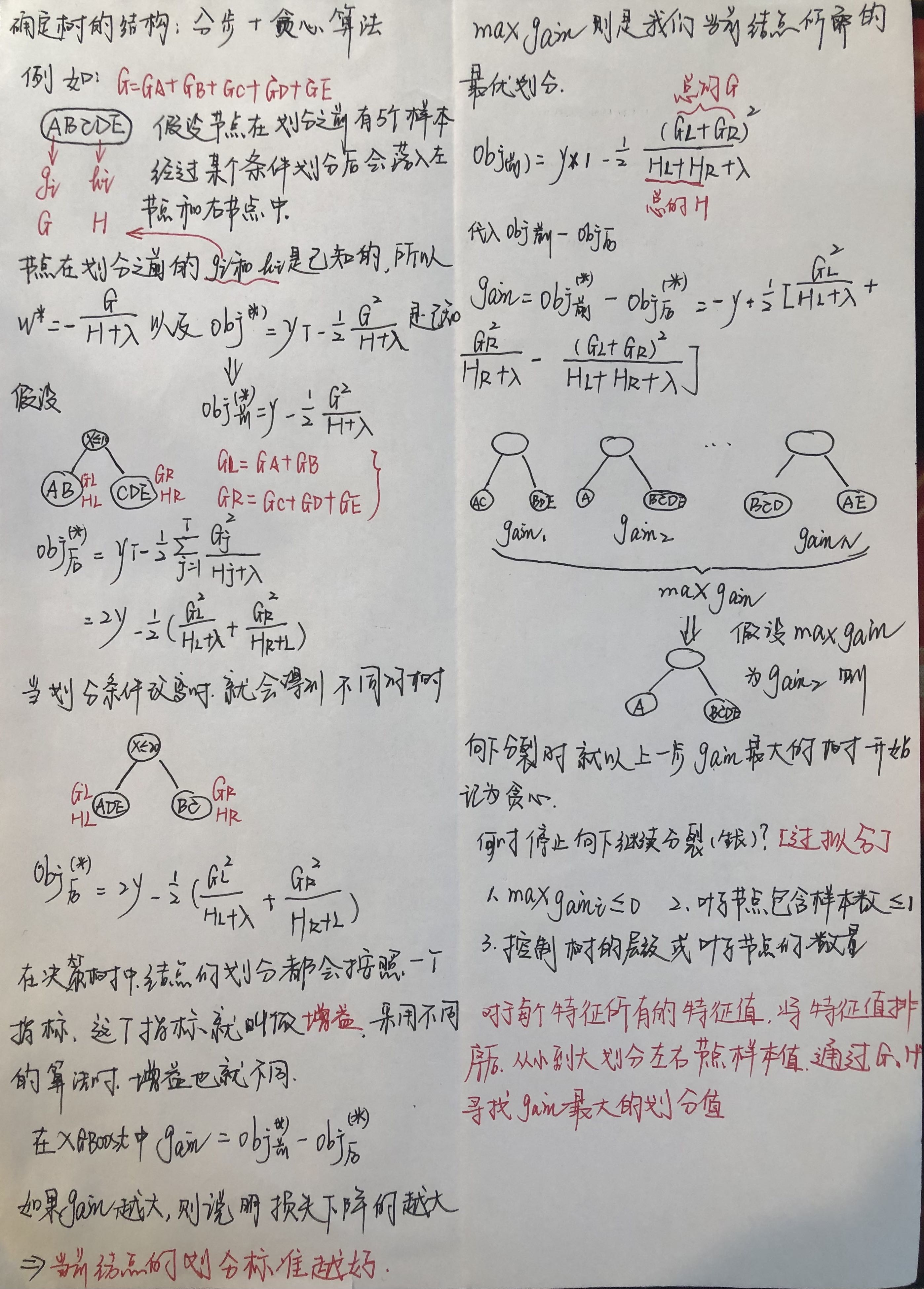
文章标题:Metabolomic and transcriptomic analyses provide insights into metabolic networks during cashew fruit development and ripening
发表期刊:Food Chemistry
影响因子:9.231
作者单位:海南大学
百趣生物提供服务:植物阿趣广靶®代谢组学、发现代谢组学HD-MIX版
- 百趣代谢组学分享—研究背景
腰果树(Anacardium occidentale L.)是一种原产于巴西亚马逊雨林的热带常绿乔木。自腰果树发现以来,便被引入世界各地的热带地区广泛种植。腰果树的果实有上、下两部分,上部分呈现梨果状,是假果,叫“Apple”;下部分呈现肾状,是真果,叫“Nut”,也就是备受人们欢迎的坚果之一——腰果(在后文中,统一称为“Apple”和“Nut”)。
迄今为止,人们对“Nut”的研究主要集中在它的营养价值上。“Nut”富含不饱和脂肪酸,它的脂肪成分中,约60%来自单不饱和脂肪酸(Monounsaturated Fatty Acid, MUFAs),20%来自多不饱和脂肪酸(Polyunsaturated Fatty Acids, PUFAs)。由于MUFAs和PUFAs可有效调控总胆固醇和低密度脂蛋白水平,因此食用腰果有助于预防心血管疾病。而相比“Nut”的高价值,多汁的“Apple”更像是一种农业副产品,工业用途有限,通常被用于果汁加工、浓缩粉生产以及乙醇生产。
果实发育和成熟是相互协调、精细调控的生物学过程。代谢组学分享,尽管前人对“Nut”以及“Apple”的化学成分进行了研究,但“Nut”以及“Apple”发育成熟过程中的代谢变化和相关调控机制尚不明晰,本研究主要探索腰果发育周期中代谢是如何变化的,并挖掘转录调控的潜在机制。
2.百趣代谢组学分享—研究设计
腰果树的果实发育具有很典型的阶段性,开花后大约一周,腰果花就开始发育成微小的假果,即“Apple”;同时,绿色的真果“Nut”,也开始长在“Apple”的底端。代谢组学分享,之后,整个果实迅速生长直至成熟期。基于这样的特点,作者以时间为轴线,结合了代谢组学和转录组学来探索腰果树果实的代谢变化过程。
作者采集开花后15、23、31、39和45天的果实,分别对“Apple”和“Nut”取样,进行实验。对应这5个果实发育阶段,样本命名为A1-A5(Apple)和N1-N5(Nut),其研究思路详见图1。
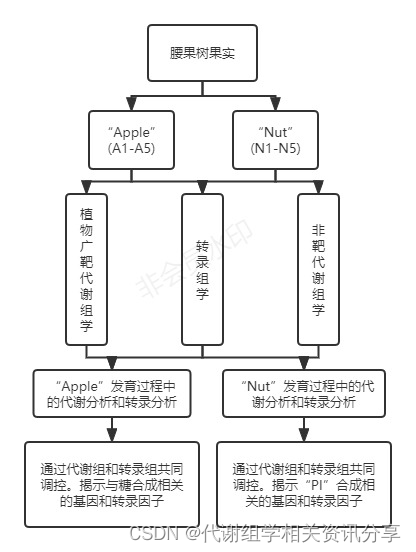
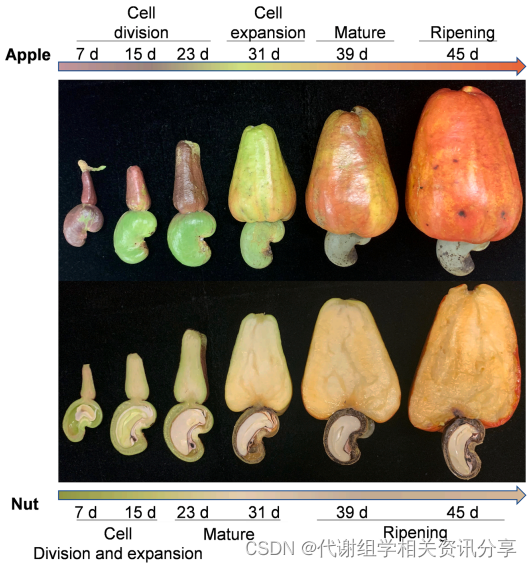
图1. 技术路线图以及腰果果实开花后“Nut”和“Apple”部位的外观变化。
3.百趣代谢组学分享—研究结果
腰果树果实发育成熟过程中的代谢特征
本研究通过代谢组学检测发现“Nut”共鉴定出1137个代谢物,而“Apple”共鉴定出567个代谢物。从主成分分析(Principal Component Analysis,PCA)可以看出,“Nut”和“Apple”的代谢物数据可以明确分为5组,对应各个发育阶段,说明“Nut”和“Apple”中代谢物的积累与不同发育阶段有着密切的关系,详见图2B。
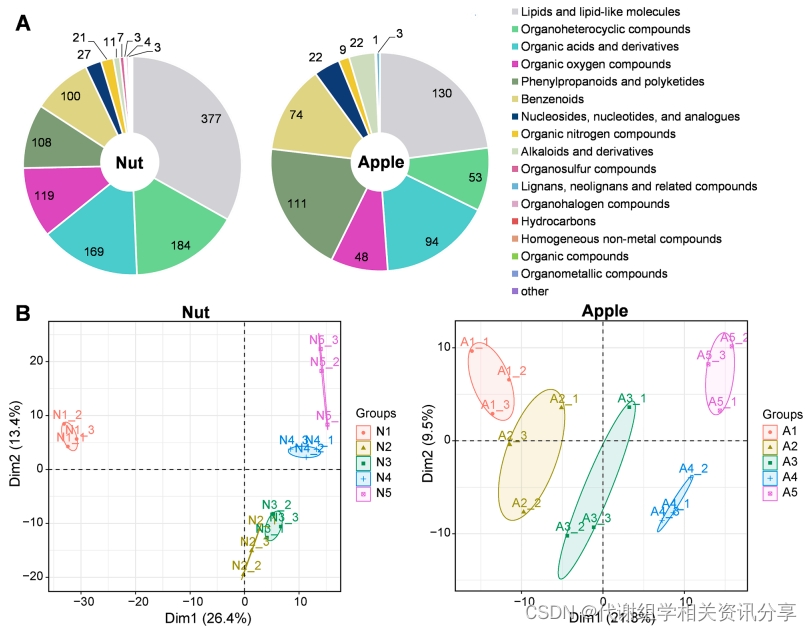
图2. “Nut”和“Apple”五个发育阶段的代谢组学分析。(A)代谢物的数量和分类;(B)“Nut”和“Apple”代谢组数据的主成分分析。N1-N5和A1-A5表示在开花后15、23、31、39和45天采集的“Nut”和“Apple”样本。
腰果树果实发育阶段的脂质分析
“Nut”因含有丰富的脂质种类而闻名。在本研究中,作者利用脂质组学全面测定了“Nut”的脂质情况。研究发现,“Nut”中含量最高的脂质物质为Ethyl dodecanoate。此外,还有161种常见脂质,这些脂质可分为五大类,即脂肪酰基(Fatty Acyls, FAs)、甘油磷脂(Glycerophospholipids, GPs)、甘油脂(Glycerols, GLs)、糖脂(Sophorolipids, SLs)和鞘脂(Sphingolipids, SPs)。从图3A可以看出,FAs和GPs占总脂类含量的97%以上。
在FAs中,游离脂肪酸(Free Fatty Acid, FFA)是最主要的成分;在GPs中,磷脂酰肌醇(Phosphatidylinositol, PI)和磷脂酰甲醇(PMeOH)的含量最高;在FAs中,饱和脂肪酸(Saturated Fatty Acids, SFAs)的含量高于MUFAs和PUFAs。代谢组学分享,从图3B可看出,在“Nut”发育过程中,MUFAs是GPs中的优势组分。从图3C可看出,在“Nut”发育过程中,FFA(16:0)含量相对稳定,FFA(18:1)和FFA(18:2)含量逐渐降低,PI(16:0/18:2)的含量下降,而PI(18:1/18:1)和PMeOH含量明显上升。
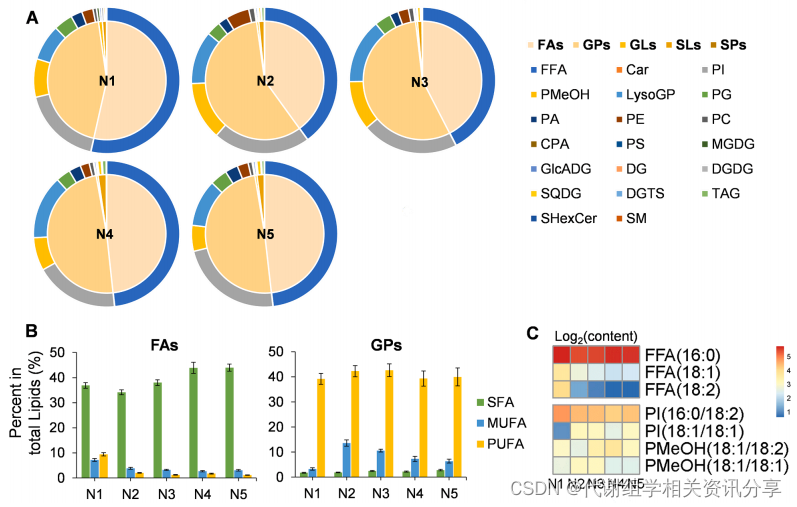
图3. “Nut”五个发育阶段的脂体组分析。(A)不同脂质家族和种类的含量;(B)FAs和GPs的分布,Bars表示标准差;(C)FAs和GPs中优势组分的相对含量。
果实从发育到成熟过程中的转录组分析
在转录组分析中,作者将TPM(Transcripts Per Million)>0的基因定义为表达基因,将绝对值Log2(TPM的差异倍数)>1的基因定义为差异表达基因。代谢组学分享,经分析,“Nut”中的基因表达量是36911个,其中有24017个基因在至少两组样本中为差异表达基因;而“Apple”的基因表达量为37624个,其中有17647个在至少两组样本中为差异表达基因。
作者进一步进行Z-Score归一化表达分析,Z-score值热图(图4A)显示,“Nut”和“Apple”的基因表达模式与果实发育阶段息息相关。PCA(图4B)结果中,N1和A1比较接近,表明在果实发育早期,“Nut”和“Apple”具有相似的转录模式;而到了果实成熟阶段,“Nut”和“Apple”有显著的差异。综上说明,腰果树的基因表达模式具有组织和发育阶段的特异性。
代谢组和转录组在不同阶段的簇中共同调控
为了进一步揭示腰果果实发育过程中的代谢变化,通过K-means聚类分析(图4C和4D)可知,“Nut”的1137个代谢物和“Apple”的567个代谢物分为6个和5个聚类簇。在“Nut”中,簇1的代谢物在整个果实发育过程中逐渐积累,簇2的代谢物在果实成熟后期富集,簇6的代谢物仅在发育早期有较高积累,簇2、簇3以及簇5的代谢物在发育中期积累较多。代谢组学分享,在“Apple”中,簇2的代谢产物在整个果实发育过程中逐渐积累,簇3的代谢产物在成熟后期显著积累,表明其与果实成熟密切相关。
为了研究基因表达与代谢物累积之间的关系,我们对代谢组和转录组数据进行了共表达分析。从图4C可看出,“Nut”中共鉴定出23,980个与至少一种代谢物共调控的基因,它们和1137个代谢物分成6个共表达簇。图4D可看出,在“Apple”中,则鉴定出有20591个基因与567个代谢物共调控,它们分成5个基因簇。这两个组学的共表达分析表明,基因的表达模式与腰果树果实发育过程中的代谢途径有关。
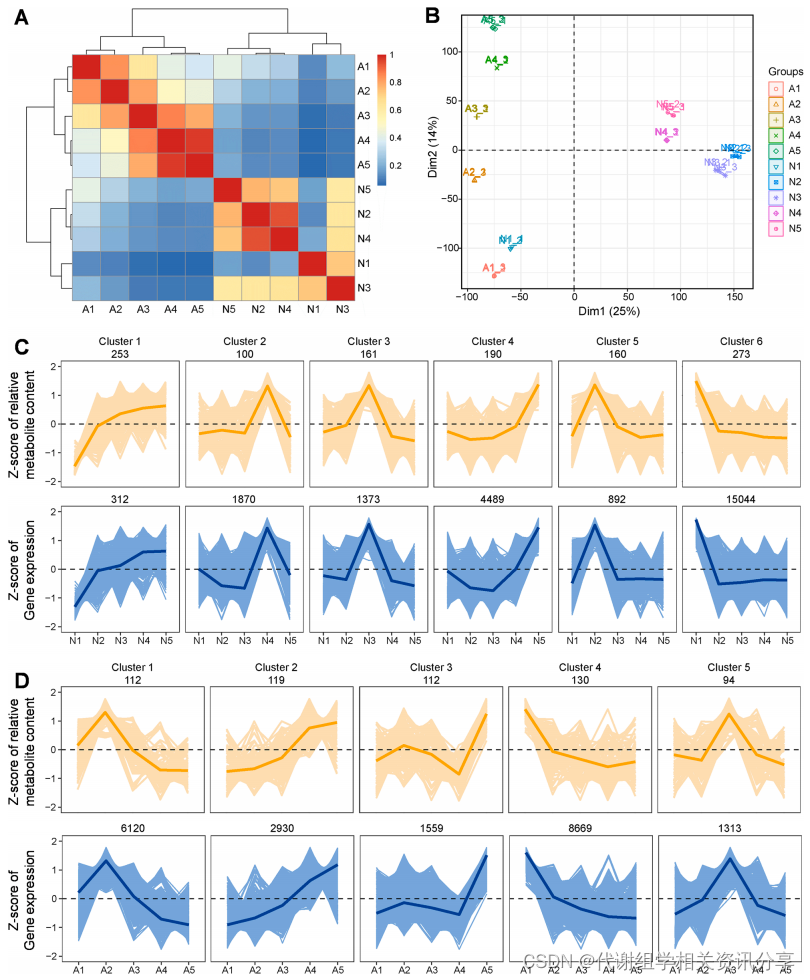
图4. 代谢物和基因的转录组分析和k-Means聚类分析。(A)“Nut”和“Apple”5个发育阶段表达层次聚类分析。颜色尺度0-1表示Spearman相关系数;(B)转录组的PCA分析;(C)和(D)k-均值聚类分析代谢物和基因。×轴描述了来自五个发育阶段的“Nut”和“Apple”,y轴描述了标准化的每个代谢物(橙色)和基因(蓝色)的Z-score。每个方框中显示的数字来自每个聚类中的代谢物和基因的数量。N1-N5和A1-A5表示花后15、23、31、39和45d采集的“Nut”和“Apple”样品。
识别调节PI(Phosphatidylinositols, 磷脂酰肌醇)生物合成的潜在基因和转录因子
“Nut”中主要的不饱和脂肪酸是GPs,尤其是PIs。作者利用K-Means聚类和KEGG分析,进一步挖掘PI的合成途径的调控因子。研究发现17个属于簇1的基因在PI的合成通路中富集,包括9个甘油-3-磷酸酰基转移酶(GPAT),5个1-酰基甘油-3-磷酸酰基转移酶(AGPAT),2个磷脂酰基转移酶(CDS)和1个磷脂酰肌醇合成酶(PIS)的编码基因。
由于“Nut”和“Apple”在果实发育早期阶段具有相似的转录模式(图4B),因此作者只对N2-N5组进行基因表达分析。
代谢组学分享,从图5A可看出,在以上的17个基因中,大部分基因在“Nut”发育过程中逐渐上调,表明它们参与了PI合成。此外,研究者还鉴定簇1的一个基因(anoc .0013 s0182),这个基因能够编码转录因子WRKY11,而这个转录因子与PI含量密切相关。进一步的分析也表明(图5B),GPAT和AGPAT的编码基因与WRKY11具有很强的共表达。作者还检测了GPAT和AGPAT的编码基因的启动子区域,确定了W-box的存在,表明WRKY11可能参调控PI的合成。

图5. “Nut”PI生物合成基因的表达模式及调控转录因子的鉴定。(A)“Nut”PI生物合成相关结构基因在5个发育时期的表达,基因的表达水平采用Z-score标准化;(B)通过注释的WRKY11与结构基因之间的相关性构建网络,每个基因对的加权Pearson相关系数值用实线(正)和虚线(负)表示。
鉴定调控蔗糖代谢的潜在基因和转录因子
蔗糖等可溶性总固体(Total Soluble Solid, TSS)是果实成熟的关键指标。代谢组分析结果显示,成熟的“Apple”中最主要的成分——蔗糖(在簇2代谢物中)在腰果树果实成熟过程中逐渐积累。基于此,作者研究了参与蔗糖代谢途径的潜在的关键基因,在簇2的基因中检测到15个与蔗糖代谢和淀粉水解相关的关键基因(包括4个蔗糖双向转运蛋白基因(SWEETS)、2个转移酶基因(INVS)、3个蔗糖合成酶基因(SUSS)、1个果糖激酶基因(Frk)、1个己糖激酶基因(HXK)、1个蔗糖磷酸酶基因(SPP)和3个β-淀粉酶基因(BAM))。从图6A可以看出,这15个基因在果实发育过程中均逐渐上调,尤其是在成熟阶段高度上调。
此外,作者从基因簇2中鉴定出19个与蔗糖代谢密切相关的转录因子(包括4个MYB,2个WRKY,2个乙烯响应因子(ERF)、1个热激转录因子(HSF)和7个与器官发育相关的转录因子),这些转录因子均与上文参与蔗糖代谢的15个基因高度相关(图S6)。在这19个转录因子中,有三个转录因子被注释为WRKY、ERF和MYB(anoc .0207 s0003、anoc .0002 s0035、anoc .0004 s1381)(图S5),从图6B可以看出,它们的表达随着果实的成熟而显著升高。代谢组学分享,通过构建并可视化这三个转录因子介导的潜在调控网络(图6C),进一步证明这三个转录因子与蔗糖相关基因之间存在高度的连通性,表明它们可能在蔗糖代谢和果实成熟过程中发挥作用。
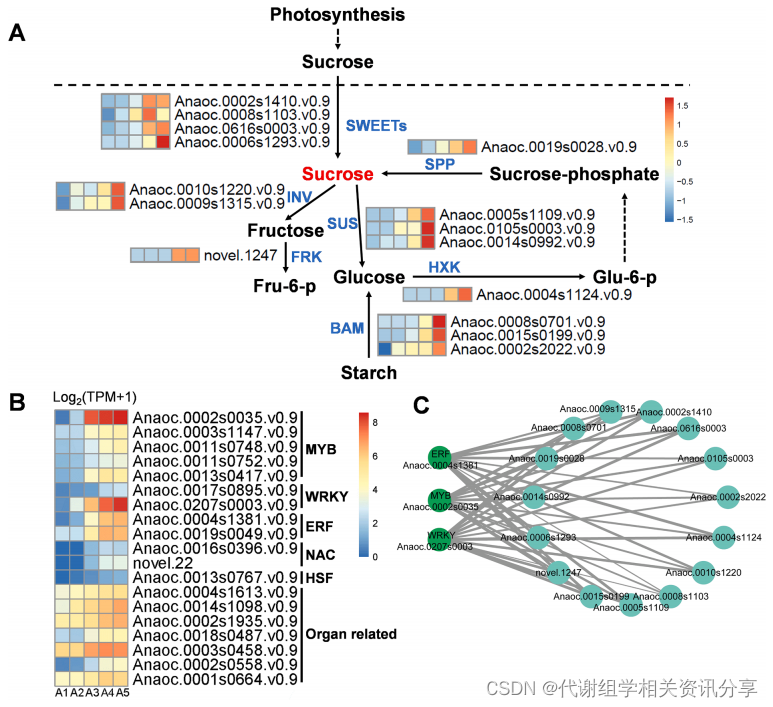
图6. “Apple”蔗糖代谢基因的表达模式及调控转录因子的鉴定。(A)“Apple”5个发育时期蔗糖代谢相关结构基因的表达模式,基因的表达水平采用Z - score标准化;(B)鉴定转录因子的表达模式;(C) 3个鉴定的转录因子(MYB、ERF、WRKY)与蔗糖代谢基因的共表达网络分析,每个基因对的加权Pearson相关系数值用实线(正)和虚线(负)表示。SPP:蔗糖磷酸酶;SWEET:双向糖转运蛋白;SUS:蔗糖合成酶;INV:转化酶;FRK:果糖激酶;HXK,己糖激酶;BAM:β -淀粉酶。
4.百趣代谢组学分享—总结
本研究基于UHPLC-Q-Exactive-MS的非靶实验,检测到“Nut”有1137个代谢物,这些代谢物中,脂质可分为5大类,而最主要的脂类是FAs和GPs。代谢组学分享,除了探讨了某些特定脂质在发育过程的代谢变化外,作者从PI是GPs的主要成分为切入点,结合转录组的数据,通过分析相同变化趋势的代谢物和基因的聚类簇,发现17个参与PI合成的基因,还确定了能够潜在调控PI合成的转录因子WRKY11。
基于UHPLC-QTRAP-MS/MS(MRM)的广靶分析,本研究检测到“Apple”有567个代谢物,TSS是果实成熟的关键指标,作者从成熟的“Apple”最主要的成分——蔗糖为切入点,结合转录组数据,通过分析相同变化趋势的代谢物和基因的聚类簇,揭示了与糖合成相关的15个代谢基因和19个转录因子。
总体而言,该研究在腰果树果实的发育研究中,引入了代谢网络相关的新视角,为进一步研究腰果育种提供了宝贵的资源。
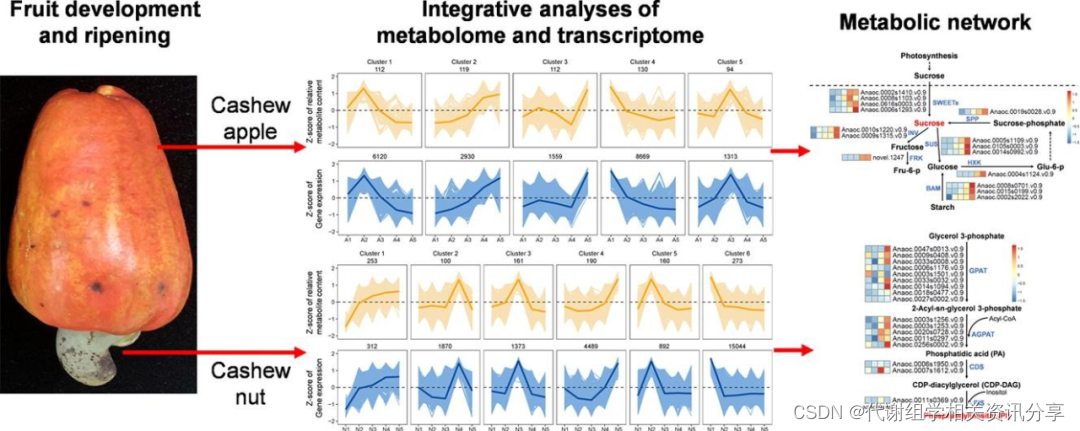
图7. 图形概要。
![推荐系统[八]算法实践总结V0:腾讯音乐全民K歌推荐系统架构及粗排设计](https://img-blog.csdnimg.cn/b935ff75e3e84d7f88de39613bb02bad.png)