谷禾健康

细菌耐药性
抗生素耐药性细菌感染的发生率正在上升,而新抗生素的开发由于种种原因在制药行业受重视程度下降。
最新在《柳叶刀-微生物》(The Lancet Microbe)上,科学家提出了基于细菌适应性、竞争和传播的生态原则的跨学科研究方法,可能开辟新途径来对抗抗生素耐药性感染。
许多兼性细菌病原体使用人类粘膜表面作为其主要储藏库,并在微生物组和宿主的某些病理状态下诱发传染病,以帮助其横向传播到新的宿主生物体。
有益的细菌共生体可以战胜特定的病原体,从而降低病原体传播和引起严重感染的能力。然而,尽管具有临床相关性,但对其自然栖息地中的共生-病原体相互作用的了解仍然很少。
本文将在人类微生物组和宿主生物学背景下讨论细菌病原体和共生体之间相互作用的研究最新内容,为预防和治疗传染病提供一些新视角。
01
人类微生物组完整性作为健康要求
The Gut Microbiome
对人类微生物组完整性作为健康需求的日益认可,正在极大地改变人们对细菌微生物组成员及其相互作用的评价,无论是微生物之间的互动还是与宿主的互动。这种理解的变化使得微生物生态学的原则成为了预防和治疗主要人类疾病的创新方法的核心。
从海量数据中分析推断出的微生物组特征正被考虑作为不同疾病诊断中的生物标志物,这些疾病包括各种类型的癌症,如结肠癌或乳腺癌,以及自身免疫性疾病,如类风湿性关节炎或银屑病。
粪便微生物移植在治疗艰难梭菌感染方面已被有效使用,而补充微生物组成员(例如AKK菌)或微生物组产品(例如短链脂肪酸),已显示出在改善代谢紊乱和癌症的健康结果方面的潜力。
然而,环境与人类相关的微生物生态系统之间存在根本性差异。许多环境微生物组代表了广阔、不受限制的生态系统,通常具有无限的生命周期,对微生物扩散几乎没有障碍。相比之下,与宿主相关的微生物组,如人类肠道中的微生物组,是受限的生态系统,具有较短的生命周期。
与宿主相关的微生物组需要特定的细菌机制来在个体和世代之间传播,并在其首选的生活条件之外暂时持续存在。
此外,宿主将微生物定殖者暴露于环境栖息地以外的压力源中,特别是通过其粘膜免疫系统。
02
微生物共生与致病性:动态变化与识别挑战
Microbial Symbiosis and Pathogenicity
▸ 过去,对共生体和病原体的理解不全面
从历史上看,对与宿主相关的微生物生态系统的研究,曾局限于不同研究团队分别对中性或共生的细菌共生体和有害病原体进行的独立调查。因此,对这些不同组的与宿主相关细菌的当前理解高度不对称,且存在对病原体的强烈偏见,这阻碍了对人类微生物组生态的全面理解。
虽然这些细菌组在自然栖息地中有广泛的相互作用,但关于共生菌和病原体相互作用的实验研究却很少。例如,典型的病原体可以被发现几乎是人类微生物组的驯化成员,而共生菌则可以与病原体勾结,这会像多重微生物感染中那样。
▸ 共生菌和致病菌的区分较复杂
尽管在感染医学中,共生菌和致病菌之间的传统区分仍然是一个重要标准,但在生态学上下文中,这两组微生物固有的属性重叠使得这种区分变得不够充分。
有益的共生现象和对立的致病性代表了细菌行为范围的两个极端(下图),尽管很少有细菌微生物组成员表现出真正的致病行为。多细菌物种或菌株可以根据其环境背景和宿主生理状态动态改变其作为共生体或病原体的能力,这进一步使区别变得复杂。

Maier L, et al. Lancet Microbe. 2024
例如,微生物组失调和宿主免疫缺陷,可以将肠球菌(Enterococcus faecium)从一个几乎无害的肠道微生物组成员转变为血流感染的原因。
单个水平基因转移事件可以改变共生生活方式和致病生活方式之间的平衡,例如,当预测的编码毒素成为肠出血性大肠杆菌或皮肤定植和口咽定植的白喉杆菌的主要毒力因子时。这意味着,原本可能是相对无害的微生物,在获得某些特定基因后,其生物学性质和行为可能发生显著变化,从而增加了其致病潜力。这种基因的转移和表达可以使这些微生物在宿主体内表现出更强的侵袭性和病原性,从而对宿主健康构成更大的威胁。
03
重新定义“感染”:探讨条件性细菌病原体中共生与致病性的动态变化
Redefining "Infection"
条件性细菌病原体之间的共生与致病性的动态变化,这挑战了当前对“感染”一词的使用,这种使用往往不一致。
《柳叶刀-微生物》全体作者建议仅将“感染”这个术语,保留用于由特定器官组织中出现的细菌菌株引起的病理状态。例如下列情况:
- 食源性或水源性志贺氏菌(Shigella flexneri)在结肠中引起腹泻
- 金黄色葡萄球菌(Staphylococcus aureus)在皮肤中引起脓肿
- 肺炎链球菌(Streptococcus pneumoniae)在肺中引起肺炎
因此,在这篇个人观点文章中,我们也建议将常规引起感染的细菌称为病原体,而不常引起感染的细菌称为共生菌,尽管这些术语有其局限性,并不能适当描述所有类型的微生物与宿主之间的对抗关系。
目前病原体与共生菌之间的界限模糊,也挑战了科赫的假说,该假说提出了特定微生物与相应疾病之间的单一因果关系。然而,实际上,有些疾病是由多种细菌种类的间接效应引起的,当微生物群落失衡而不仅仅是这些种类的存在,导致了一种特定的病理状态,而这种状态目前并不被视为典型的感染。
04
整合微生物学:跨学科研究推动了对细菌病原体与共生菌的全面理解
Understanding of Bacterial Pathogens and Symbiotic Bacteria
微生物组科学,尤其测序技术的快速进展以及新技术的出现,为微生物学开启了一个新阶段,这一阶段的研究将细菌病原体和共生菌整合在一起,超越了简化的研究方法。
为了探究环境变化如何影响细菌微生物组成员的动态行为变化,来自不同背景的微生物学家应当合作,并结合系统生物学、天然产物化学、粘膜免疫学和临床传染病等互补学科的专业知识。这些新方法可能有助于回答一些最相关和明显的问题:
- 为什么只有少数与宿主相关的细菌将大量遗传信息用于操纵和伤害宿主细胞?
- 这些专业病原体表达毒力因子有什么生态优势?
- 为什么一些共生菌在微生物组组成受到干扰或宿主免疫防御受损时,会变成偶发性病原体,导致疾病?
- 目前对生态原则的了解如何用于开发预防和治疗感染的有效方法,尤其是那些由抗生素耐药和难以治疗的病原体引起的感染?
- 微生物组是否可以优化,以促进促进健康的益生菌或特定地解除病原体的武装,同时允许共生菌保持无害?
05
未来受病原体研究启发的共生细菌研究
Future Research on Commensal Bacteria
由于其高度的临床相关性以及培养和操控相对容易,像S. flexneri(志贺氏菌)、S. aureus(金黄色葡萄球菌)和 S. pneumoniae(肺炎链球菌)这样的主要细菌病原体已经被研究了几十年,远超过典型的宿主相关共生菌。相比之下,主要的人类相关共生菌,例如来自属如拟杆菌属、梭菌属(Clostridium)、Cutibacterium,仅被少数实验室研究。
实际上,大多数人类微生物组成员仍然难以培养,并且在遗传上不易处理。在特定情况下可以成为偶发性病原体的一些共生菌,如医院获得性大肠杆菌、粪肠球菌(E.faecium)或表皮葡萄球菌(Staphylococcus epidermidis),已经在一定程度上被研究。但为什么这些特定的细菌比其他更无害的共生菌更频繁地引起侵袭性感染,这一点仍然不清楚(如下表)。


Maier L, et al. Lancet Microbe. 2024
06
共生细菌在人类健康中重要作用及其应用潜力
The Important Role of Symbiotic Bacteria in Human Health
越来越多的证据表明,一些共生细菌对人类健康至关重要。
▸ Blautia producta 抑制粪肠球菌
例如,Blautia producta 的共生菌株通过产生特定的抗菌化合物,可以抑制并排除粪肠球菌(E.faecium),而Staphylococcus lugdunensis的共生菌则可以抑制并排除金黄色葡萄球菌。
▸ 枯草芽孢杆菌阻止金黄色葡萄球菌
肠道中的枯草芽孢杆菌(Bacillus subtilis)释放一种抑制性化合物,可以阻止金黄色葡萄球菌的定植能力,或抑制肠球菌(Enterococcus faecalis)的毒力因子表达。
一些共生菌还能产生对宿主有直接益处的化合物,例如促进肿瘤疗法的成功。病原体的研究可以帮助理解这些有益共生菌的生物学特性,并利用它们来对抗细菌感染。
共生菌的许多重要特性在不同菌株间可能会有所不同,这取决于例如获得或丢失移动遗传元素,如编码抗性或适应性特征的基因岛。用于病原体菌株特异性分类的现有方法,如序列分型方案,也可以应用于共生菌。这些方法可以帮助提升当前的诊断策略,达到个性化感染医学的新水平,不仅监测特定有害病原体的存在,还监测如那些保护免受潜在病原体定植的特定有益共生菌的缺失。
07
细菌病原体和共生体的适应和宿主特异性
bacterial pathogens and symbiotes
▸ 共生菌的宿主特异性适应
与许多主要的细菌病原体一样,很多共生菌也特定于特定的宿主物种。这种适应过程导致宿主特异性,可能作为一种策略来增加细菌在与其他适应性较差的微生物竞争中的生存能力。这些基础机制对于病原体来说理解得很少,对于非致病性共生菌来说则基本上是不清楚的。
▸ 共生菌的粘附与持续定殖机制
特定宿主的持续定殖往往依赖于有效地粘附到上皮细胞的结合基序,如表面蛋白、蛋白多糖或糖脂。尽管在许多主要病原体中已经在一定程度上研究了相应的细菌粘附素,但现在才开始探索共生微生物中的这些机制。
▸ 共生菌与宿主免疫系统的相互作用
细菌在上皮表面的生存受到粘膜宿主防御机制的限制,这些机制包括IgA、抗菌肽和脂质以及活性氧和氮化合物的产生。先天和适应性免疫机制,通过感知与微生物相关的分子模式分子或通过粘膜白细胞检测微生物抗原来启动,有助于粘膜免疫过程,导致促炎或抗炎信号和效应分子的释放。
宿主的持续定殖依赖于细菌耐受抗菌免疫效应分子的能力或通过诱导免疫耐受来减少它们的表达。具有对抗菌宿主效应分子增强耐受性的细菌甚至可以诱导和利用抗菌宿主反应来消除更易感的竞争者。
根据宿主免疫反应,与微生物群其他成员的拮抗干扰已在表皮葡萄球菌和鼠伤寒沙门氏菌中得到记录。广泛的研究揭示了主要病原体的免疫逃避机制,但共生菌是否使用类似或不同的策略仍然未知。
▸ 共生菌免疫调节的复杂性及其潜在影响
例如,一些肠道共生菌通过产生非炎症性鞭毛蛋白来钝化先天免疫反应,这些蛋白抑制人类的Toll样受体5,或产生可以在粘膜表面诱导调节性T细胞的短链脂肪酸,以促进免疫耐受。然而,这些潜在的控制机制可能会被干扰,并可能在宿主无法启动耐受并以炎症反应的情况下导致疾病,例如当口腔共生菌异位定殖在肠道时。

doi.org/10.1016/S2666-5247(24)00049-1
总的来说,宿主相关生态系统中的细菌间的相互作用很大程度上依赖于分泌的因子,这些因子可以通过专门的分泌系统以单独的可溶性分子的形式释放出来,或者作为膜囊泡的组成部分释放出来(上图)。
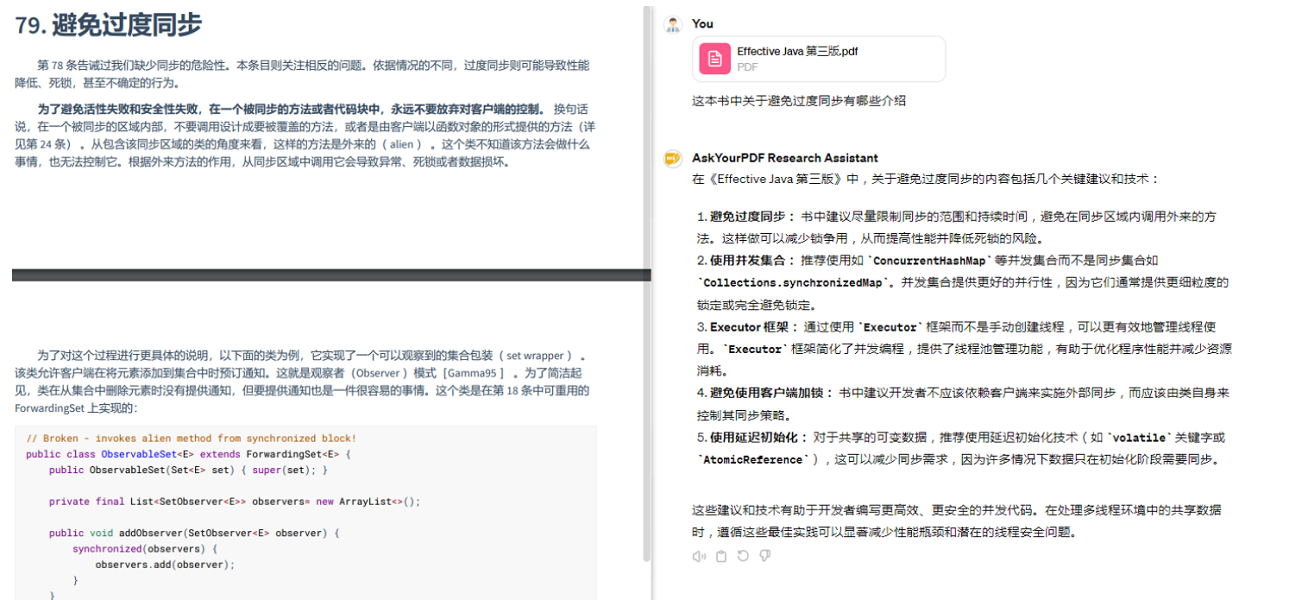
因此,细菌病原体的分泌毒力因子已经被广泛研究。相比之下,共生菌分泌的初级或次级代谢产物或蛋白质介质如何调节与病原体和宿主的相互作用的研究较少。这些研究显示,例如一些共生菌可以释放杀菌素等分子,消灭金黄色葡萄球菌等病原体,或产生营养物促进艰难梭菌等病原体的扩展,由此凸显了宿主相关微生物生态系统中的一个新的复杂层面。
08
探索兼性人类病原体的适应性机制知识
Fitness mechanisms of facultative human pathogens
许多主要的人类细菌病原体不是专性病原体,而是作为常见微生物组成员定植于人类或动物体表面,但不会引起疾病(下表)。

doi.org/10.1016/S2666-5247(24)00049-1
事实上,在大多数兼性病原体的共生生活方式中,急性感染是罕见的。然而,研究主要集中在S.flexneri、金黄色葡萄球菌、肺炎链球菌等病原体的毒力机制上,而在共生行为期间引导这些生物体与其他微生物组成员竞争的适应性的机制仍然被忽视。
从微生物的角度来看,感染是否以及哪些类型确实对细菌有利,或者应该被视为偶然事件,而不利于它们在几代宿主中的长期进化成功,目前尚不清楚。
09
深入理解细菌感染的重要性日益凸显
Importance of a Deep Understanding of Bacterial Infections
现在比以往任何时候都更需要深入理解细菌感染,因为全球抗菌药物抗性和细菌感染的负担日益增加。目前对细菌感染的了解主要限于少数模型病原体,如金黄色葡萄球菌和肺炎链球菌。相比之下,一些臭名昭著的抗生素抗性细菌种类,根据以下病原体种属的首字母被命名为ESKAPE病原体,包括粪肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、假单胞菌和肠杆菌,这些病原体的研究细节远不够充分。
▸ ESKAPE病原体的持久抗性与适应性进化
抗生素抗性机制在某些情况下可能会给细菌带来适应性的负担,即抗性可能会影响细菌的其他生存能力,但在没有抗生素的环境中,这种抗性通常会消失。然而,一些被称为ESKAPE病原体的细菌已经进化出了一种能力,使它们能够在医疗环境之外保持这种抗性特征。补偿性突变可以帮助这些细菌克服由于抗性而带来的适应性负担,从而促进抗性菌的成功和抗性的传播。
▸ 社区相关的抗性细菌扩散
这就是为什么社区相关的甲氧西林抗性金黄色葡萄球菌(MRSA)和万古霉素抗性屎肠球菌(VRE)等细菌,能够如此有效地在社区中扩散和扩张,甚至以牺牲它们对抗生素敏感的同类为代价,这一现象仍然是科学界未解之谜。这表明这些细菌可能已经发展出了一些未知的机制来维持和增强其抗性,即使在抗生素使用减少的环境中也是如此。这种现象需要进一步的研究来解明其背后的具体机制和因素。
10
细菌传播机制与生态学成功的关系
The Relationship Between Bacterial and Ecological Success
生态学概念在普通微生物学和环境微生物学领域很常见,但尚未广泛应用于对病原菌的理解。
细菌在与其他微生物组成员的竞争中的成功依赖于多种机制,包括利用生长限制性营养物质的能力,从其他细菌那里获取促进生长的共同物质如聚合物水解酶或微量金属捕获剂,抵抗由微生物群体成员释放的抗菌分子,或者附着在少数上皮细胞附着点上。
一个细菌种类或菌株的长期生态成功来自于该种类在特定宿主体内的增殖和向新宿主体传播的综合效应。为了研究一个种类在特定宿主体内的增殖,应采用一系列研究策略,从共生菌的研究到对主要专业和偶发病原体的调查。
细菌有两种主要的传播方式:垂直传播和横向传播。
- 垂直传播就像是遗传,细菌通过父母把自己的基因传给后代。这种方式通常发生在那些与人体和谐相处、形成共生关系的细菌身上。
- 横向传播则像是感冒在人与人之间传播,细菌通过接触等方式在不同个体间传播。这在致病细菌中比较常见。
每个人体内都有大量细菌,它们组成了独特的微生物组。这些细菌有的倾向于垂直传播,有的倾向于横向传播,不同细菌的传播方式和速度是不一样的。
2022年的一项研究就发现,微生物组中的细菌在这两种传播方式的偏好上有所不同。我们已经对一些常见的致病细菌的横向传播有了较多了解,比如幽门螺杆菌、肺炎链球菌、金黄色葡萄球菌等。它们能在人群中快速传播,传播过程也被很好地监测和记录。但目前对这些细菌是如何在人体外存活,又是如何进入新的人体的,还不太清楚。
11
病原体流行扩散与感染特性的关联
The association between the epidemic spread of pathogens
主要病原体的流行扩散很可能与它们引起的感染类型和严重程度有关(下图)。
▸ 感染类型
疾病特性对细菌传播的贡献在引起腹泻的病原体(如志贺氏菌)中最为明显,这类病原体通过污染的污水传播而获益。

其他常见的感染表现可能也具有类似的作用。例如,金黄色葡萄球菌引起的典型感染——化脓性皮肤和伤口感染,会导致大量的S.aureus细胞在体表出现,从而支持通过皮肤接触的宿主间传播。
类似的机制也可以使尿生殖道病原体,如淋病奈瑟菌Neisseria gonorrhoeae在宿主间迅速传播。引起呼吸道感染的病原体,如百日咳博德特氏菌Bordetella pertussis、化脓性链球菌Streptococcus pyogenes或肺炎链球菌S pneumoniae则通过咳嗽或打喷嚏的个体释放的气溶胶传播。
▸ 严重程度
关于疾病的严重程度如何通过支持传播来增强病原体的适应性已有讨论,例如在SARS-CoV-2的背景下,但尚未对细菌病原体进行系统性评估。值得注意的是,大多数专业化的细菌病原体并非人类微生物组的核心成员,它们只是暂时性地定植在人类体内(见表1),这就需要它们具备有效的横向传播机制。
专业人类病原体(如志贺氏菌和淋病奈瑟菌N.gonorrhoeae)的持续定植在人群中较为罕见,或仅在人群的一小部分(如金黄色葡萄球菌)或特定年龄组(如化脓性链球菌或肺炎链球菌)中发现,这表明维持广泛的致病力涉及与其他微生物组成员竞争时的重大适应性负担。
诸如粪肠球菌(E.faecium)和表皮葡萄球菌( S.epidermidis )等偶然病原体表达的因子有助于其免疫逃避能力,但几乎不表达任何侵袭性毒素,这可能导致这些病原体在人类微生物组中比大多数专业病原体具有更高的患病率和持久性。
由于偶发性病原体主要在免疫力低下的个体中引起感染,它们也常被称为机会性病原体。然而,这一术语也经常用于诸如金黄色葡萄球菌和肺炎链球菌等专业病原体,这些病原体在免疫力低下的个体中引起的感染类型不同且更为严重(通常是血流感染),而在免疫力正常的个体中则不然。因此,专业病原体有时也可能引起偶发性感染,这种感染并不促进病原体的传播。偶发性人类感染也可以由适应于非人类宿主的病原体如军团菌(Legionella pneumophila)或霍乱弧菌引起,这些病原体只在特定的环境条件下感染人类。
12
综合理解细菌共生体和病原体的适应性可以帮助预防感染
The association between the epidemic spread of pathogens
在自然环境中同时研究共生菌和病原体,可以帮助我们更好地控制微生物,对抗感染以及其他与微生物组相关的疾病。
共生细菌对传染病的影响远比先前假设的要复杂得多。一些共生菌种采用主动防御策略,如释放抗菌肽或通过依赖接触的V型、VI型或VII型分泌系统消除其他细菌,这些系统在针对特定目标物种的特异性上可能有很大差异。此外,共生菌还可以使用更微妙的抑制策略来增加其在抗击病原体定植方面的生态成功,这基于代谢干扰。
共生细菌群落可以以依赖于群落多样性及其与病原体的代谢重叠的协作方式,阻止诸如克雷伯肺炎菌和鼠伤寒沙门氏菌等病原体获取营养物。
病原体的排除可能是由于共生菌释放的金属载体螯合必需的微量金属,或产生抑制性代谢产物而产生的。例如,一些肠道共生菌可以将原生胆酸转化为抑制肠道病原体艰难梭菌C difficile孢子生长的次生胆酸代谢产物。
13
微生物组恢复与粪菌移植治疗的策略及挑战
Challenges in Fecal Microbiome Transplantation Treatment
粪便微生物组移植(FMT)是治疗艰难梭菌感染的一种有效策略。粪便微生物组移植成功至少部分是由于恢复了有益细菌群及其代谢产物,这些代谢产物能抑制艰难梭菌的生长。然而,粪便微生物组移植难以标准化,其对抗其他病原体的效果仍不明确。
目前,临床前和临床试验正在评估使用基于共生菌的生命治疗产品来预防处于风险中的个体被抗生素耐药病原体定植。然而,那些防止病原体定植的共生菌往往比目标病原体更易受抗生素影响,这可能会消除共生菌的有益效果,并在抗生素治疗期间加剧与菌群失调相关的疾病。
因此,研究人员需要平衡使用共生菌治疗产品的风险和好处。深入了解不同共生菌菌株对抗生素的敏感性,以及这些菌株如何与目标病原体相互作用。只有通过深入的研究和严格的监测,才能确保共生菌的治疗潜力得到充分发挥,同时避免不良后果的发生。
系统评估关键共生菌群的抗生素敏感性,并将这些知识纳入个性化的、基于微生物组的抗生素管理方案中,对于最小化广谱抗生素对微生物组的附带伤害至关重要。
除了我们通常使用的抗生素之外,许多针对人类的其他药物也可能意外地影响到人体肠道中的有益细菌。这种药物的副作用在未来的医疗实践中需要被特别注意,特别是对于那些需要同时使用多种药物治疗多种疾病的患者。此外,人体内的微生物群体本身可能是一种新型抗菌剂的重要来源。通过系统地研究和描述这些微生物产生的创新化合物,我们可能会发现新的药物,这些药物有望用于预防或消除病原体在人体内的定植。
14
抗生素治疗中的抗性问题与生态学策略的应用
Antibiotic Resistance Issues in Treatment
在现代医疗中,我们常用的广谱抗生素不仅攻击病原体(引起病症的微生物),还会影响到人体内的有益共生细菌。这种广泛的攻击会导致细菌之间的抗药性基因传递,特别是通过一些可以在不同细菌间转移的元素,如质粒和噬菌体。这种基因的传递可能导致抗生素更难以消灭病原体。
由于这种抗药性基因的传递,需要更好地监控不仅是病原体的抗药性发展,也要监控那些可能是抗药性传播者的共生菌。这样可以更有效地控制病原体的传播和抗药性的发展。
此外,通过理解这些微生物之间的生态关系,可以更好地发现病原体的弱点,从而开发出新的治疗方法。
这些方法不仅限于传统的抗生素,还包括能够利用有益共生菌或宿主防御机制的新型药物。这些新药物的开发需要在模拟真实生态环境的实验模型中进行,比如使用人类挑战模型,这种模型允许我们在受控的环境中测试病原体和治疗方法。
总之,通过更好地理解微生物之间的相互作用和生态平衡,可以开发出更有效的策略来对抗病原体,同时减少对有益共生菌的损害。这种方法有助于限制病原体的传播和疾病的爆发。
主要参考文献:
Maier L, Stein-Thoeringer C, Ley RE, Brötz-Oesterhelt H, Link H, Ziemert N, Wagner S, Peschel A. Integrating research on bacterial pathogens and commensals to fight infections-an ecological perspective. Lancet Microbe. 2024 Apr 9:S2666-5247(24)00049-1. doi: 10.1016/S2666-5247(24)00049-1. Epub ahead of print. PMID: 38608681.