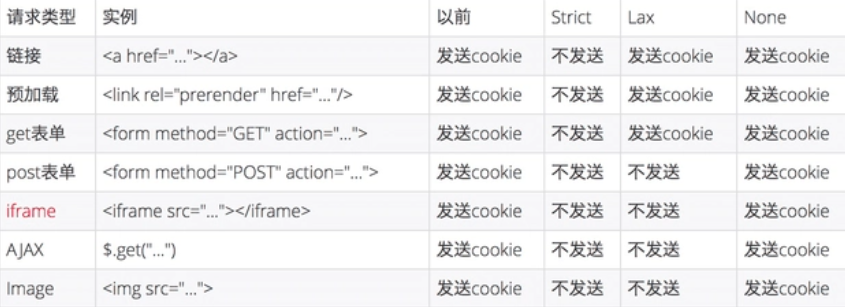
ICH人用药品技术要求国际协调理事会,英文全称为"The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use"。
① ICH简介
于1990年由欧、美、日三方政府监管发起的一个国际非盈利组织,依照瑞士法律成立于2015年10月。截止2024年5月该组织包括 21 名成员和 37 名观察员。宗旨是通过技术要求的国际协调提高公众健康,这些技术标准有利于及时为患者提供新药品并保证患者可持续获得已获批药品,防止人体临床试验的不必要重复, 以高效和具成本效益的方式研发、注册和生产安全、有效和高质量的药品,及在不折损安全性和有效性的前提下尽量少的使用动物试验。
2017年ICH会议通过了中国国家食品药品监督管理总局(原CFDA)的申请,总局成为正式成员。2018年中国国家药品监督管理局(现NMPA)当选为ICH管理委员会成员。 2021年当局再次当选为ICH管理委员会成员。
②ICH指导原则类别及内容
ICH指导原则有四个类别,包含(Q)质量指导原则-Quality Guidelines、(S)安全性指导原则-Safety Guidelines、(E)有效性指导原则-Efficacy Guidelines和(M)多学科指导原则-Multidisciplinary Guidelines。其内容分别包含化工、医药、质量保证相关指导原则;实验室动物实验等临床前研究相关指导原则;人类临床研究相关指导原则;内容交叉涉及以上三个分类,不可单独划入任何一类的指导原则。
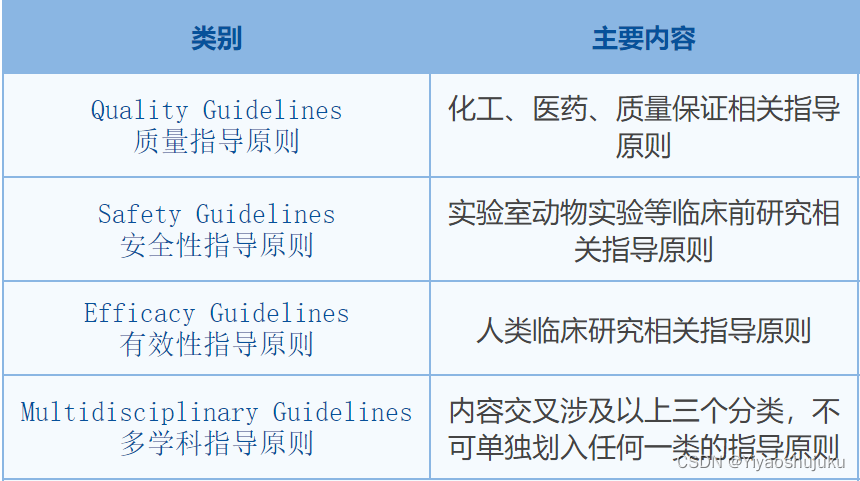
截止2024年5月30日,ICH指导原则共63个。国家药监局已发布公告明确实施时间点的共有59个ICH指导原则,其中Q系列17个,E系列21个,S系列15个,M系列6个。63个ICH指导原则中已实施59个。
③ICH指导原则官网查询与下载
ICH指导原则的查询除了通过CDE官网中的ICH指导原则数据库之外,也可以通过药融云-ICH指导原则数据库进行在线免费查询,详细查询路径:药融云-->个人版数据库-->生产检验-->ICH指导原则数据库
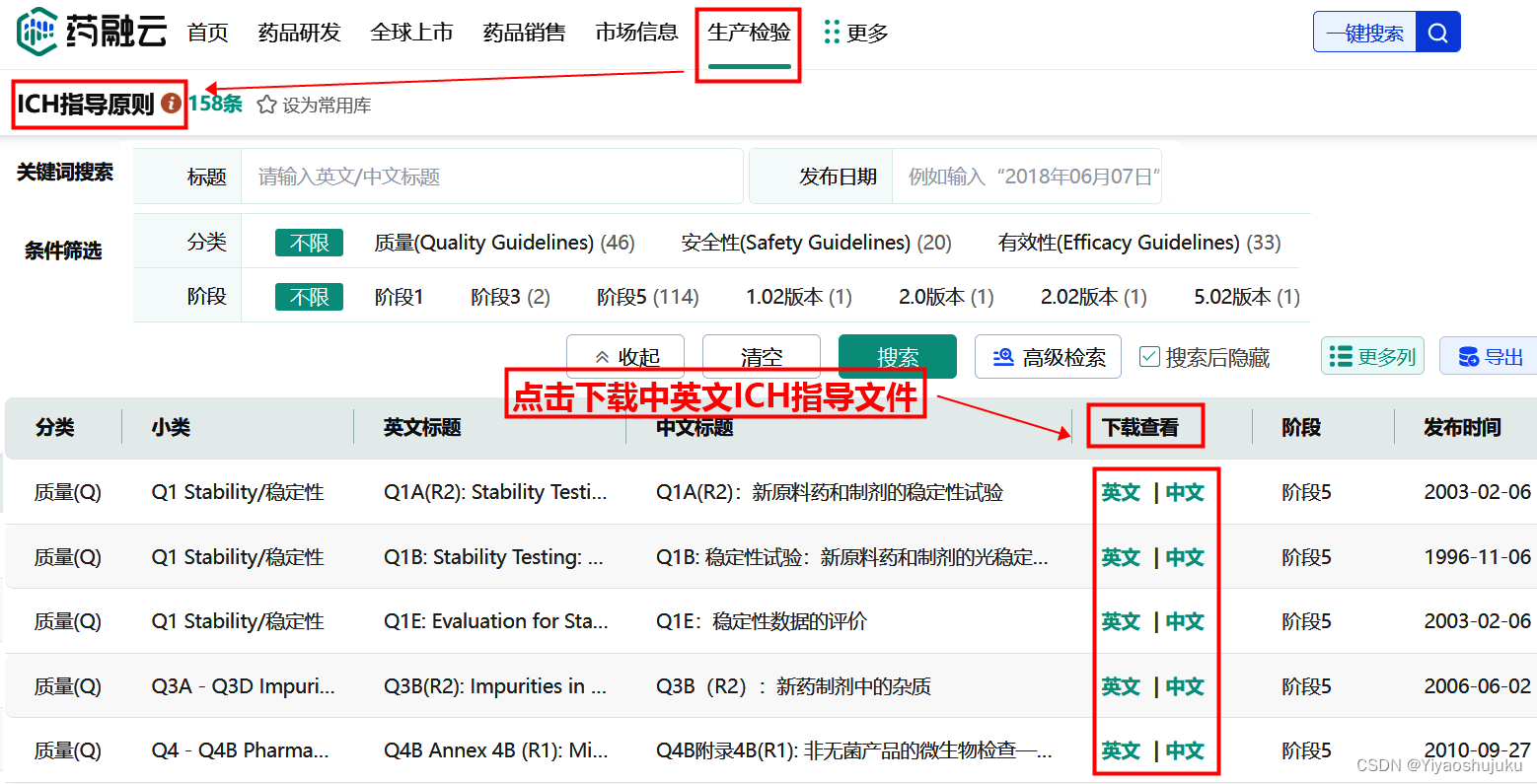
药融云-ICH指导原则数据库免费提供查询与下载功能,目前收载了ICH有关质量、安全性和有效性的指导原则包括指导原则及其问答文件;多学科指导原则中还包括概念文件、工作计划及相关规范性文件等,其中指导原则文件12个,其他文件49个。在CDE官网基础上,提供更全面的检索方式供用户查询相关信息。数据库支持关键词搜索和条件筛选,可以通过标题(中/英文)和发布日期检索相关信息,还提供相关文件全文下载。可供用户了解欧盟、美国和日本注册产品的技术要求中存在的不同点,为课题技术协调提供参考等。
④ICH指导原则修制定程序
ICH指导原则制修订过程分为5个阶段:
第1阶段构筑共识:新议题提案经大会批准成为新议题后,成立专家工作组。专家工作组依据概念文件和业务计划不断讨论形成第1阶段技术文件 (Step 1 Technical Document),即指导原则草案的基础;
第2a阶段确认共识:第1阶段的技术文件经大会批准后,全体成员大会成员将会对技术文件共识进行确认,形成第2a阶段终版技术文件 (Step 2a Final Technical Document);第2b阶段采纳指导原则草案:根据第2a阶段终版技术文件制定第2b阶段指导原则草案(Step 2b Draft Guideline),并由ICH大会监管机构成员确认的过程。
第3阶段监管机构征求意见和讨论:ICH各地区/国家的监管机构对指导原则草案公开征求意见。根据反馈的意见,专家工作组进行讨论,修改指导原则草案。
第4阶段采纳指导原则:大会监管机构成员对指导原则草案达成最终一致,并通过。
第5阶段实施指导原则:ICH各地区/国家监管机构通过各自行政程序实施指导原则。