《Protein Actions Principles and Modeling》-《蛋白质作用原理和建模》
本人能力有限,如果错误欢迎批评指正。
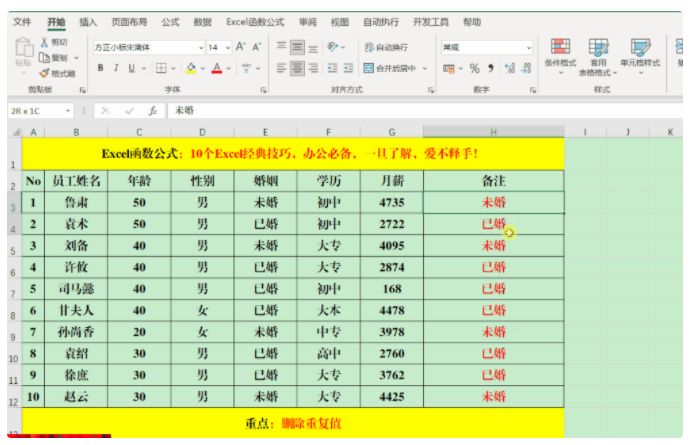
第四章:Protein Binding Leads to Biological Actions
(蛋白质的结合会产生生物作用)
-在变构中,构象变化和结合时同时进行的,即协同结合
结合过程的发生会导致一个蛋白质构象的变化,从而调控其他的结合过程。这是一个重要的蛋白质机制。在变构过程或变构调节中,与蛋白质上的一个位点结合的效应配体可能会影响这个蛋白质其他位点的结合过程:配体与变构位点的结合会引发对应构象变化,从而影响其他位点与配体的结合。我们将通过一个简单的协同结合来解释这个过程。
在两个位置会产生协同的结合过程。想象一个,配体X以K1的平衡常数与蛋白质P结合,然后第二个配体X以K2的平衡常数与蛋白质复合物PX结合:
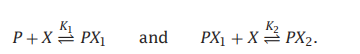
当反应以这种形式写出来时,平衡常数是:
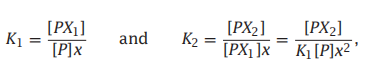
那么结合多项式为:
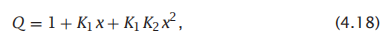
那么描述配体浓度与结合状态的结合曲线则为:
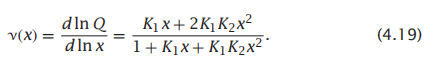
这个方程描述了每个P分子的占用率,即每个P分子的预期配体数量。平衡常数K1和k2决定了v (x)。在某些情况下,我们可能会观察到K2 = K1。在这种情况下,一个配体的结合过程是独立于另一个配体的结合过程的。在其他情况下,你可能会观察到K2>K1(称为正协同性):第一个配体的结合促进或激活第二个配体的结合。在另一类情况下,你可能会观察到K2<K1(负协同性):第一个配体的结合阻碍或抑制第二个配体的结合。正负协同作用是蛋白质抑制剂和激活剂以及调节机制的基础。Hill模型描述了多个配体的高度耦合结合。
如果配体的结合是高度协同的,也就是说,如果P一次结合了0个分子或恰好是n个配体分子,那么Hill模型为:
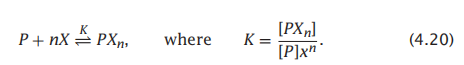
在这种情况下,n,它被称为Hill系数,是协同性的指标。P状态之和为:
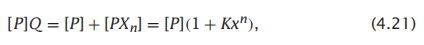
所以结合多项式是
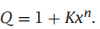
然后:
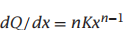
最后,每个分子P上集合的配体平均数量为:
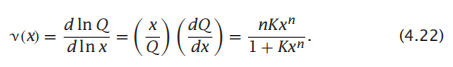
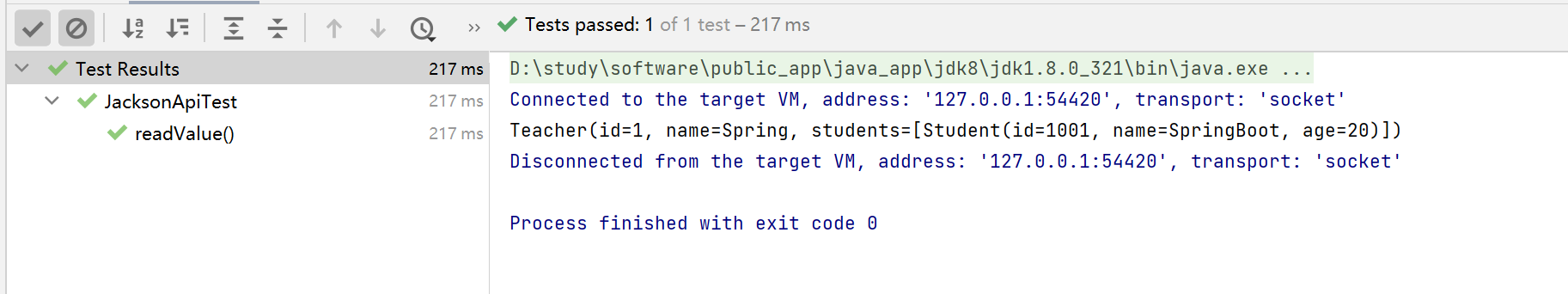
对于Hill过程,ν与x的曲线图将是s型的(图4.6)。转变的斜率随n的增加而增大。
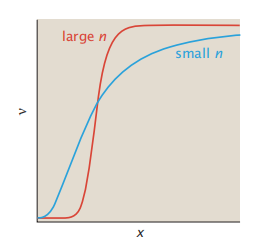
图4.6协同结合的Hill模型。这张图显示了ν的s型增加,配体填充的比例,相对于配体浓度x。Hill系数n越大,得到的曲线就越陡。
以下是进行结合模拟的方法。为了符合实验数据,从我们可以最简单的模型(即参数最少的模型)开始,这个模型与数据以及任何已知的潜在分子结构对称性相一致。然后,利用该模型的结合多项式,计算结合配体分子的数量作为配体浓度的函数,调整模型参数以最佳拟合数据。如果该模型在可接受的误差范围内不符合数据分布,我们可以换一个不同的模型。结合多项式本身并不能给出关于分子结构的信息。然而,结合多项式模拟与已知的对称性可以提供结合结构的信息。接下来,我们以血红蛋白的建模为例进行分析。
氧与血红蛋白的结合是一个合作的过程。血红蛋白是一种四聚体蛋白质,可以在体内结合和运输氧气。血红蛋白有四个亚基,其中,每一个都可以结合一个氧分子。假设你假设血红蛋白上有四个相同的独立结合位点,每个位点都有亲和力K,那么其结合多项式:
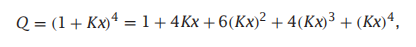
其中,x表示氧气浓度。这就是个n=4的具有4个位点的朗缪尔模型,其中:
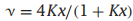
这个表达式中的二项式系数体现了你将给定数量的配体结合到这四个位点上的方式数量:4!/(4!0!)=1是四聚体没有配体或四个配体结合的排列数。有4个!/3!1!=以4种不同的方式在这四个位点上分配一个或三个配体,以及4!/2!2!=有6种分配两种配体的方法。你可以使用一个可调参数k来拟合你的结合曲线。但早期的实验表明,氧与血红蛋白的结合是协同的,第四种氧的亲和力比第一种高500倍,因此并不符合这个独立位点模型。
Monod, Wyman, and Changeaux(MWC) 和 Koshland, Némethy, and Filmer (KNF)提出了更好的建模方式。他们都对变构作用的分子机制提出了自己的想法。这两种模型(MWC,KNF)都使用了基于结构的结合描述,并且都假设四面体血红蛋白的四个亚基都有两种构象状态:非配体和配体。对于血红蛋白来说,这些状态被称为T(紧张)和R(放松),对应于单个亚基的无氧和无氧结合状态。我们先了解一下MWC模型。
在MWC模型中,T(紧张)和R(松弛)构象是同时存在的,并且遵循动态平衡:

配体X对这两种蛋白质构象具有不同的亲和力(图4.7):
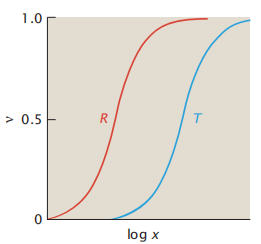
图4.7 在血红蛋白中,配体(氧)对R构象的亲和力比对T的亲和力更大。
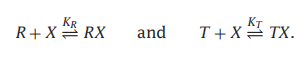
在配体缺乏的情况下,T比R稳定,也就是说配体与R的结合比T更紧密。在这种情况下,增加配体会促使系统从T态转变成R态。
为了理解这个原理,我们可以从最简单的情况开始思考:一个配体的结合过程。那么该系统会有四种可能的状态:R、T、RX和TX,其中R和T没有配体,RX和TX各有一个配体结合。结合多项式Q是T和R的所有配体状态的和:
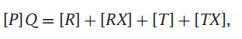
其中
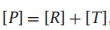
[R]为未结合的R构象的浓度,[T]为未结合的T构象的浓度,[RX]和[TX]分别为配体结合的R和T分子的浓度。至于平衡常数:
[T] = L[R], [RX] = KR[R]x,[TX] = KT [T]x = KT L[R]x
其中,x表示配体的浓度。式4.23则转变为:

R状态(配体结合或未结合)的比例fR为
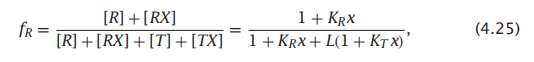
而T状态(配体结合或未结合)的比例fT为
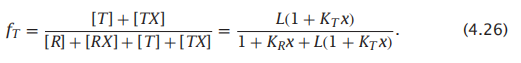
用式4.26除以式4.25:
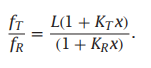
图4.8显示增加氧浓度会使平衡从T转变到R,从而获得KT/KR <<1。这两种状态在配体浓度x = (L − 1)/(KR − LKT )具有相同的比例。并且随着x的增加,R状态的占比变得越来越高。
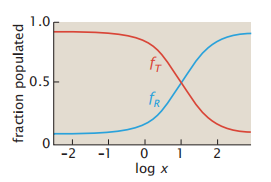
图4.8 配体浓度x的增加导致了从T到R的构象变化(公式4.25和4.26)。
到目前为止,我们只考虑了血红蛋白上的一个结合位点。在单个亚基中,血红蛋白可以随着稳定R状态的配体浓度的增加而从一种状态(T)转变到(R)状态。然而,大多数变构蛋白是多聚性的(如血红蛋白),而这导致亚基的T→R转换之间的协同作用。MWC模型假设分子经历了一个全有或全无的转变,其中所有的亚基要么处于R状态,要么处于T状态(图4.9A)。MWC模型在以下方面与KNF模型有所不同。KNF模型假设T和R状态之间有一个顺序的过渡,每次有一个亚基(见图4.9B),这样T和R状态下的亚基可能共同存在再同一蛋白质中。实验表明,在血红蛋白的情况下,四聚体蛋白确实有两种可观察的状态,四个亚基的全-R或全-T状态。该实验结果与MWC模型的理论假设一致。

图4.9 两种不同的变构模型:MWC和KNF。每个血红蛋白亚基的T状态是正方形的;R状态是圆的。(A) MWC模型。四个亚基都处于T状态或四个都处于R状态。配体选择并稳定所有亚基都处于R状态的构象。在这种构象中,所有亚基对额外配体亚基的亲和力都增加了,似乎这些亚基以一种一致的方式转变。(B) KNF模型。与配体结合只诱导一个T单体转移到R态。要切换下一个亚基,还需要第二个配体。因此,这个模型中的子单元以一种顺序的方式进行切换。
虽然所有亚基的构象同时转变并不一定意味着同时结合(相反,它意味着转换为一种对结合后续配体具有高亲和力的状态),但为了简单起见,我们假设所有配体之间也存在协同结合。因此,血红蛋白的MWC结合多项式就变成了:
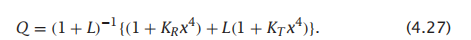
在这种情况下,结合配体的平均数ν为:
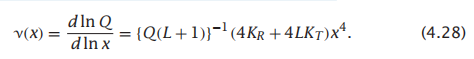
因此,MWC模型可以很好地解释化学增幅(chemical amplification)现象:例如,溶液中氧浓度的微小变化可以导致与血红蛋白结合氧量的巨大变化。根据MWC模型,这种增幅效应来自于一种协同行为(concerted action):这四个亚基都在T和R两个状态间波动。第一个配体结合稳定了全R状态,从而有利于其他配体与蛋白质的结合。结合的平均数量随着配体浓度的四次幂而增加。因此,实验中观察到的状态以T或RX4为主,而结合中间态的数量可以忽略不计。这种全或无的转变可以通过结构对称来促进:由于紧密的包装和整体耦合结构,当一个蛋白质的结构变化以多米诺效应传播时,蛋白质的所有亚基都倾向于协同转变。另一个关于MWC化学增幅的例子详见box4.3,结合神经递质的作用导致在神经细胞中的离子通道蛋白受体打开,允许电流通过该通道。

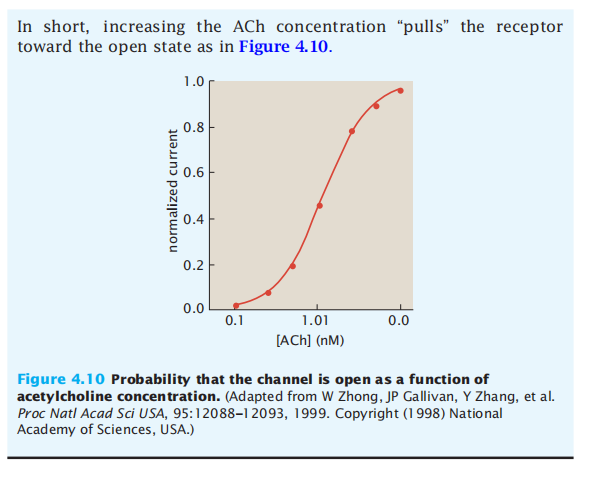
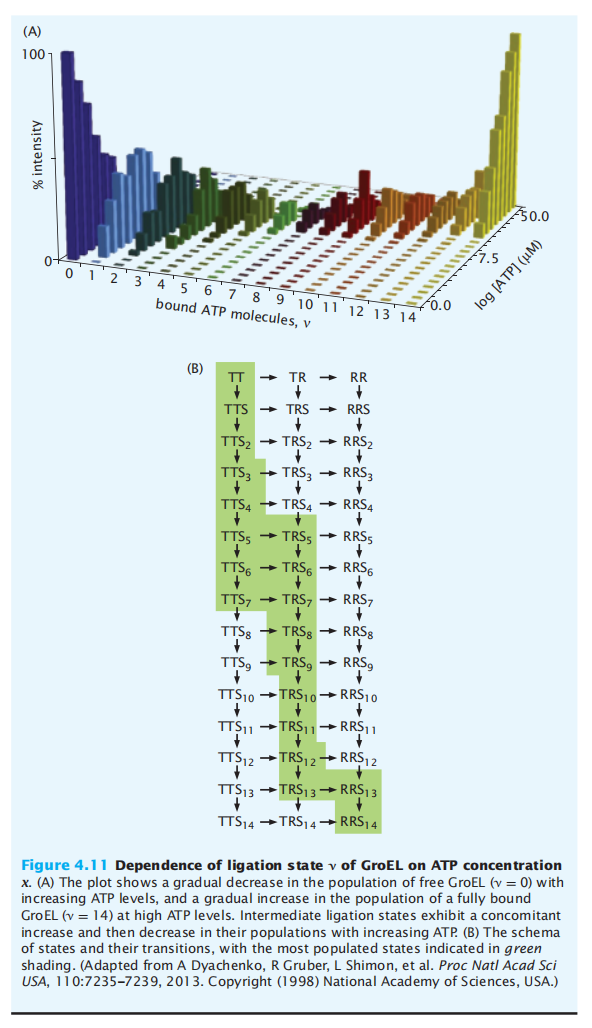
当伴侣机器与ATP结合时,也可以观察到另一个类似于MWC的协同过程(Box 4.4)。

-------------------------------------------
欢迎点赞收藏转发!
下次见!