Tips:
组学时代的循环肿瘤细胞:我们离实现“奇点”还有多远?(Br J Cancer,IF:9.075),原文链接: https://pubmed.ncbi.nlm.nih.gov/35273384/
循环肿瘤细胞的生物学、脆弱性和临床应用(Nat Rev Cancer,IF:69.800),原文链接:https://pubmed.ncbi.nlm.nih.gov/36494603/
CTC 与单细胞测序
大体上来说,液体活检主要可以分为 CTC和 ctDNA。CTC 起源于肿瘤自发或者由于外科手术的原因脱落并渗入外周血循环系统。自从 1869年首次发现 CTC 以来CTC 在癌症生物学、分子谱分析和肿瘤液体活检精准医学中的关键和多方面作用得到了越来越多的认可。特别是,随着单细胞多组学技术和人工智能领域的飞速发展。极大的加速了 CTC 在基础和临床研究的进度。与ctDNA相比,细胞是一个更完整的生物实体,可以在转录组学、基因组学和蛋白质组学水平上以大量或单个细胞的形式进行分析,甚至理论上可以进行体外培养或者类器官培养,进行绝对精准化的个体化药物筛查(这部分是我猜的)。
譬如,
-
2014年6月,发表在Nature Medicine上的一篇题为Tumorigenicity and genetic profiling of circulating tumor cells in small-cell lung cancer的研究,证明了 CTC 可以在体外培养,在免疫缺陷型小鼠上进行异种移植。并在单细胞测序水平上验证了CTC 和异种移植后的细胞的一致性。进一步的说明,只要技术够硬,我上面的猜测完全可以实现,使用 CTC 进行类器官培养,或者体外培养,然后进行个体化的药物筛选。
-
2017年1月,发表在 Nature Medicine上的一篇题为Molecular analysis of circulating tumor cells identifies distinct copy-number profiles in patients with chemosensitive and chemorefractory small-cell lung cancer 的研究,阐述使用单细胞全基因组测序分析技术,对患者进行无创的药物敏感性鉴定,准确率超过 80%。研究也重点表面,CTC 的检测其优势在于可以重复获取,并进行实时的动态监测,帮助患者进行更加精准的治疗避免重复、过度医疗。
-
2019年 5 月,发表在 Nature Communication 上的一篇题为 Hydro-Seq enables contamination-free high-throughput single-cell RNA-sequencing for circulating tumor cells 的研究,证明了在乳腺癌中使用 CTC 代替活检进行分子靶标鉴的可行性。
-
2021年 7 月,发表在 Nature Communication 上的一篇题为 Dissecting spatial heterogeneity and the immune-evasion mechanism of CTCs by single-cell RNA-seq in hepatocellular carcinoma 的研究,阐述肝癌的 CTC 通过激活 CCL5等趋化因子进行免疫逃逸以及肝癌 CTC 的空间异质性。
-
2022 年12月,发表在 Nature Communication 上的一篇题为Deep transfer learning enables lesion tracing of circulating tumor cells的研究,阐述了深度学习方法在 CTC 溯源中的应用。
目前来说,阻碍 CTC 临床应用的主要原因有两个 :
- CTC 含量实在太低,捕获难度大的一匹
- 肿瘤间和肿瘤内的异质性过强,没有统一的 marker,虽然目前公认的是 EPCAM,但是在转移的过程中 CTC 的形态非常难以确定,捕获难度极大。
2013 年 9 月,发表在Science上的一篇题为Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition 的研究。阐明,
- 原发性肿瘤细胞同时表达间充质和上皮标志物但是间充质细胞标记物在 CTC 中高度富集。
- 间充质细胞标记物的高度表达会引起 CTC 簇的形成。
- 间充质CTC 簇形成的原因可能是 EMT 转换后,自我复制后行程的簇,也有可能是脱落的 CTC 被已经存在的 CTC 簇诱导形成。
- 文章强调,CTC 会与血液中的血小板结合,并且血小板释放转化生长因子 β (TGF-β)诱导 CTC 产生 EMT 转化
因为这篇 Science 的内容太多,以后做更加细致的讲解
因此开发出一些独立于 EPCAM 的生物标记物
- 2018年 8 月,发表在Nature Communication上的The VAR2CSA malaria protein efficiently retrieves circulating tumor cells in an EpCAM-independent manner的文章提出使用疟疾 rVAR2 蛋白捕获 CTC。因为疟疾 rVAR2 蛋白可以与肿瘤细胞上的硫酸软骨素特异性结合,并且证明了rVAR2 能够有效地捕获来自肝癌、肺癌、胰腺癌和前列腺癌患者的 CTC。
当然也有其他的方法,比如负富集,电荷分类法等等
CTC 转移和 CTC 簇
CTC 的转移过程主要有 5 个阶段
- 第一阶段,从原位肿瘤中脱落
- 进入 TME
- 渗入血液系统
- 传播
- 驻留在组织器官
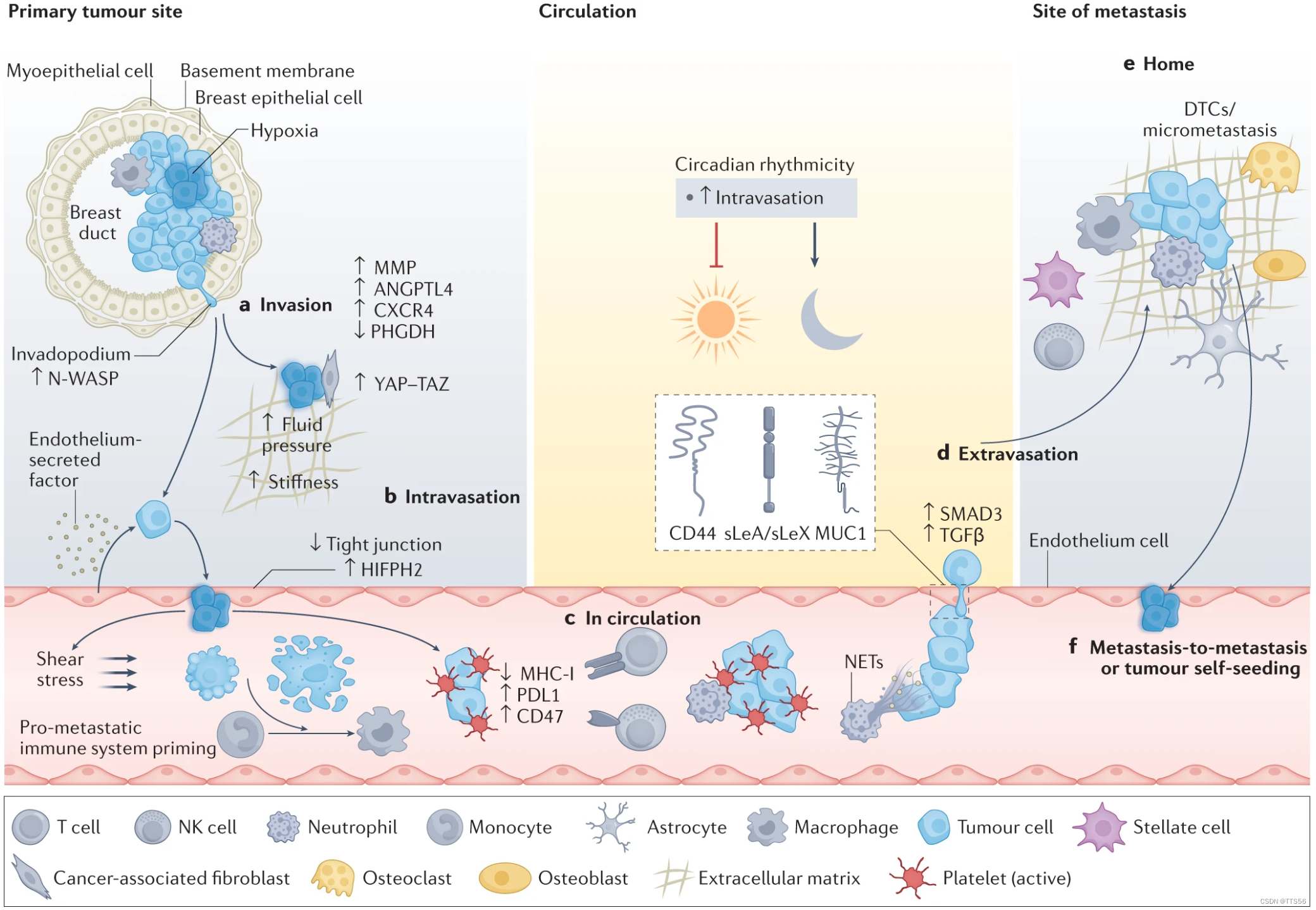
并且,CTC 转移的方向和过程是多向的,甚至会出现自我转移的现象(就是通过血液循环转移了一大圈又回到原点,俗称转移了个寂寞)。
2009 年 12月发表在 Cell 上,题为Tumor self-seeding by circulating cancer cells
但是,实际上,自我转移并非转移了个寂寞,上面提到,Science 那篇文章就指出,在血液循环过程中,CTC 会被血小板黏住,并且血小板会分泌一些东西使得 CTC 在循环过程中发生进化,因此自播种可以通过种子衍生因子加速肿瘤生长、血管生成和间质募集。
并且,这里甚至可以强行得出一个结论(我瞎猜的,因为我没有找到靠谱的结论)。CTC 无论是定向移植还是自我移植必然都是刻在 CTC 内部的 DNA。通俗来说,我认为,CTC 的转移就是宿命论,CTC 在转移的那一瞬间就已经决定了他的转移目的地,不然无法解释结为什么结直肠癌会发生高频肝转移,黑色素瘤、肺癌会发生高频脑转移。
2001年 5 月发表 Nature 上的一篇题为 Involvement of chemokine receptors in breast cancer metastasis 的文章指出,乳腺癌通过表达 CXCR4 进行骨髓定向
实际上,关于这部分的研究结论还是挺多的,但是很多的结果不是很robust就不列举了
上面也讲到,CTC 在转移的过程中,不仅以单个 CTC 的形式存在,甚至会以 CTC 簇的形式进行转移,与单个 CTC 相比,其转移潜能增加了 100 倍。
2015年 12月,发表在PNAS上的一篇题为Polyclonal breast cancer metastases arise from collective dissemination of keratin 14-expressing tumor cell clusters,CK14在 CTC 簇中高度富集,且是远端转移的重要因素之一。
这里就设计到 CTC 簇,CTC 簇实际上可以有两种类型,同型 CTC 簇(肿瘤细胞黏在一起)和异型 CTC 簇(肿瘤细胞和其他细胞黏在一起)。同型 CTC 簇容易粗发表观遗传学变化,这会导致肿瘤细胞群出现干性,增加其迁移和浸润能力。异型 CTC 簇,主要是和血小板,中心粒细胞或者肿瘤成纤维细胞等结合,使得肿瘤细胞实现免疫逃逸侵袭等功能。
CTC 的预后和预测价值
目前,CTC 的研究已经开始爆发式的增长,包括在前列腺癌,乳腺癌,肺癌,结直肠癌等。虽然,在临床上 CTC 的检测和研究存在假阴性的结果,但是大多数的结论都支持 CTC 或 CTC 簇可以用来评估患者的预后以及实现肿瘤的早期诊断。 多向干预性研究也表明,CTC 和单细胞多组学技术结合使用,能够帮助乳腺癌靶向治疗决策,以及预测前列腺癌患者靶向治疗的预后。此外,CTC 已被纳入WHO 肿瘤分类第五版:乳腺肿瘤和AJCC 癌症分期手册第七版中。总之,CTC 的真正力量在于它们代表高转移性肿瘤亚克隆的潜力,以及它们作为分子和功能研究的最新生物标志物来源的丰富性