*仅供医学专业人士阅读参考
最近一段时间,新型冠状病毒感染(Covid-19)人数的激增,让全国多地迎来了重症“冲击波”,医疗卫生系统承受着极大的压力。
在新冠治疗药物方面,我国当前情况如何?最近Paxlovid(奈玛特韦-利托那韦)可是热度极高、各种报道、讨论和争议不断,也能反映出大家对这个问题的关注程度,是否会有国产新药火线驰援呢?
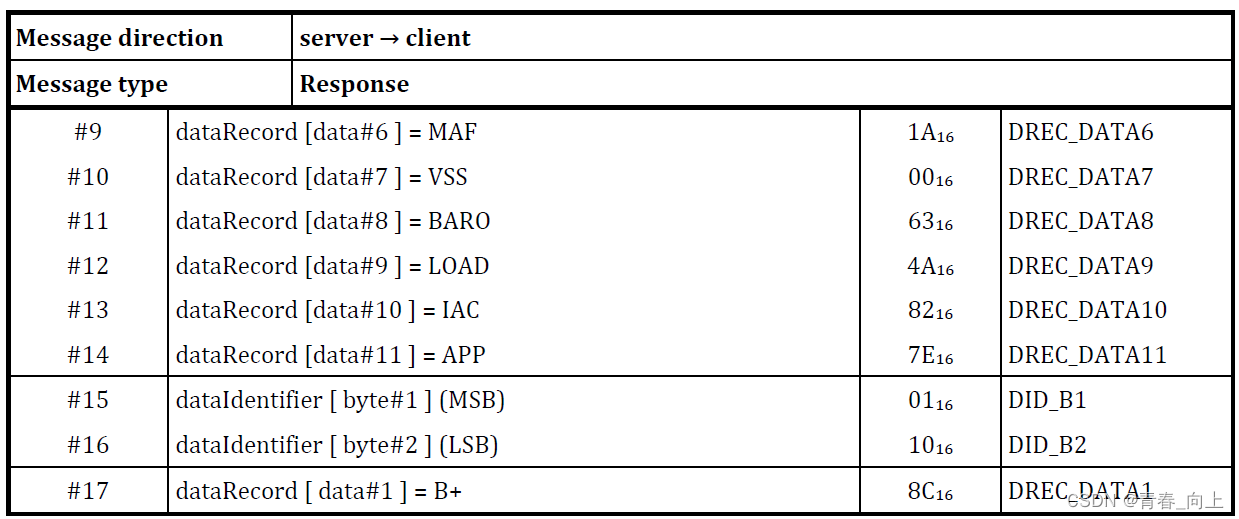
北京时间12月29日,大名鼎鼎的《新英格兰医学期刊》(NEJM)发布了一项来自中国的重磅随机对照临床III期研究结果。该研究显示,对于有进展高危因素的轻-中度新冠感染成人患者,中国自主研发的新冠治疗创新药物VV116,在助力患者达到持续临床康复的时间方面,非劣于Paxlovid(4天 vs. 5天;风险比: 1.17;95% CI: 1.02-1.36)[1]。

论文首页截图
在研究次要终点,即患者达到症状持续消失的时间、核酸检测转阴时间等指标方面,VV116治疗与Paxlovid也无显著差异,且两组患者均未发生进展到重症或死亡。此外,VV116的治疗安全性良好,不良事件发生率更低(67.4% vs. 77.3%)。
这项研究是NEJM发表的首个中国新冠创新药临床研究,也是小分子口服抗病毒药物之间的“头对头”研究,而且开展于奥密克戎变异株流行期间,无疑有着重要的意义。全球顶级医学期刊的认可,意味着VV116将成为战疫的全新利器!
介绍这项研究的详情之前,当然还是要说说VV116的来头,它由中国科学院上海药物研究所、武汉病毒研究所,以及旺山旺水等多家机构联合开发,是基于瑞德西韦(remdesivir)的母体核苷(GS-441524)结构改造而来。
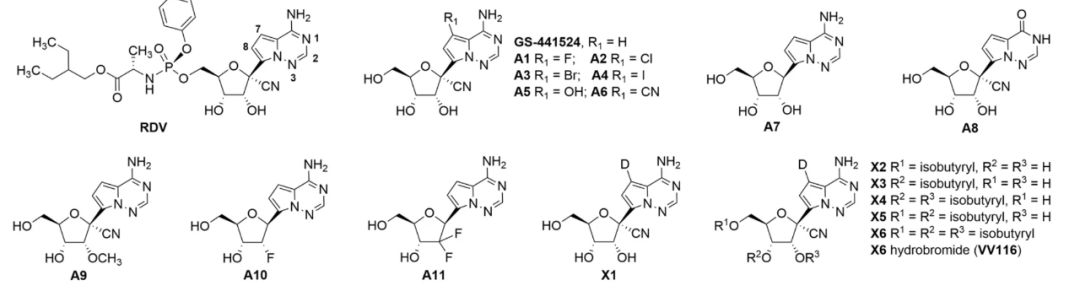
VV116的结构改造
由沈敬山研究员带领的研发团队发现,虽然瑞德西韦和GS-441524都能在体外实验中强效抑制新冠病毒复制,但它们最初的开发目标是针对丙肝病毒,因此它们具有肝脏靶向性,可能不适合用于新冠感染的抗病毒治疗,毕竟肺部才是关键。
因此,研发团队开始对GS-441524进行结构修饰,并最终筛选出“最合格”的候选口服抗病毒药物,也就是VV116。临床前研究显示,VV116也能够通过靶向RNA依赖的RNA聚合酶(RdRp),有效抑制新冠病毒RNA的合成,且有着良好的口服生物利用度和安全性,有望成为安全高效的口服抗新冠病毒药物[2]。

VV116在临床前研究中表现出在肺部的抗病毒能力
后续开展的临床早期研究也证实,VV116治疗的安全性和耐受性好[3],且在奥密克戎突变株感染早期应用VV116治疗,可显著缩短感染者的“排毒时间”[3],支持后续III期临床研究,也就是本次登顶NEJM的研究开展,而且该研究是在2022年4-5月上海疫情高峰期间进行的,面临着重重困难,成功更是尤为不易。
研究由上海交通大学附属瑞金医院宁光院士、赵任教授和上海交通大学附属仁济医院皋源教授牵头,于2022年4月4日-5月2日在上海7所新冠定点医院开展,是一项多中心、单盲(研究者保持盲态)、随机对照III期临床试验(NCT05341609),纳入822例伴有进展高风险因素的轻-中度新冠成人患者。
入组患者按照1:1比例随机化分组,最终771例患者接受了VV116(n=384)或Paxlovid(n=387)治疗(即全分析集/FAS人群),患者中位年龄为53岁,大多数为轻症(92.1%),75.7%完成新冠疫苗全程接种或接种过加强针,77.3%在症状出现5天内接受VV116或Paxlovid治疗,进展高风险因素的情况则如下表所示。
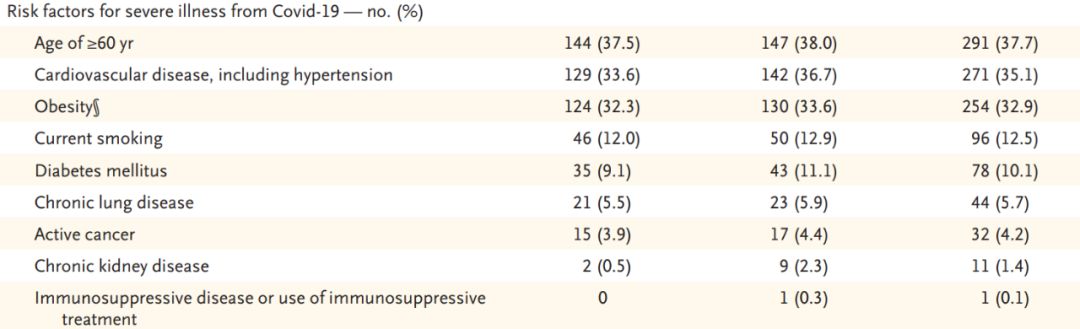
患者存在的进展高危因素
研究主要终点定为从随机化至持续临床恢复的时间,其中持续临床恢复是指患者所有11项新冠相关目标症状(如发热、咳嗽等,详见表2)严重程度总分降至0-1分(即所有症状均需消失,或仅一项症状仍为轻度);基于奥密克戎突变株感染病程及上海的疫苗接种率情况,患者达到持续临床恢复的参考用时为5.5天。

11项新冠相关“目标症状”
次要疗效终点则包括截至第28天进展为重症/危重症或全因死亡的患者比例,新冠相关症状评分和WHO临床进展量表评分变化、至持续症状消失的时间、核酸转阴时间等,还在安全性方面评估不良事件(AE)和严重不良事件(SAE)情况。
根据本次论文公布的最终分析(截至2022年8月18日)结果,在FAS人群中,VV116与Paxlovid治疗,在至持续临床恢复的时间方面达到非劣效性(HR=1.17, 95% CI:1.02-1.36),大多数预设亚组患者的情况也与FAS人群相似,且VV116组患者比Paxlovid组的中位恢复用时更短(4天 vs. 5天)。
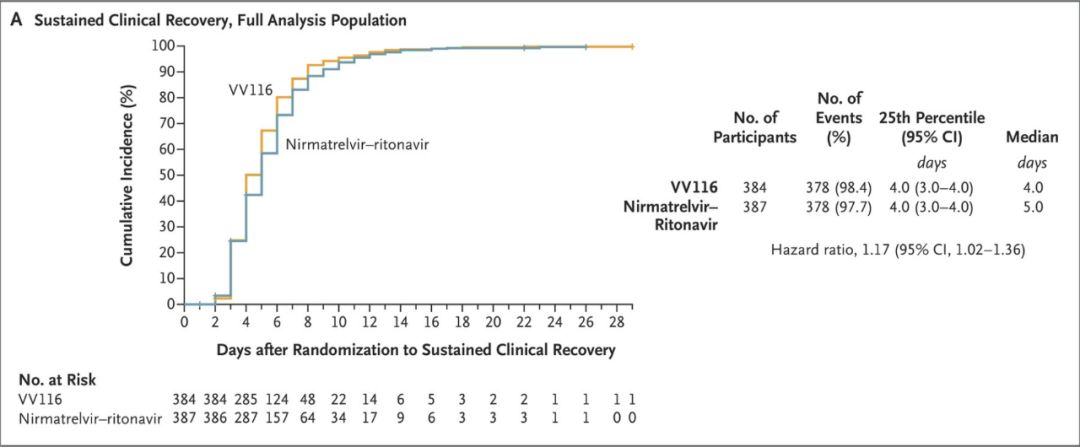
VV116与Paxlovid治疗至持续临床恢复的时间情况
此外,两组患者中均未发生进展为重症/危重症或死亡,患者至持续症状消失、至首次核酸转阴的中位时间也都为7天(HR分别为1.06/0.99);在研究预设的各个时间点(第5、7、10、14、28天),VV116组症状缓解(定义为全部11项目标症状消失,连续2天)的患者比例,大多也高于Paxlovid组(除第28天时外)。

VV116与Paxlovid治疗在不同时间点的患者症状缓解比例
而安全性方面,VV116组所有级别AEs发生率为67.4%,低于Paxlovid组的77.3%,3-4级AEs发生率也较低(2.6% vs. 5.7%)。此外从药物特性来看,不同于Paxlovid作为复方制剂,药物相互作用(DDI)较多,VV116不抑制或诱导主要药物代谢酶或药物转运蛋白,因此与患者合并用药发生DDI的可能性较小。
要说这项研究有什么遗憾,那就是受到种种原因的制约,研究最终没能以最理想“双盲双模拟法”进行,也未能充分评估VV116对预防进展至重症和死亡的效果(两组均无事件发生),这些都有待后续临床研究来进一步评估。
但毫无疑问,关键临床研究结果登顶NEJM,意味着VV116的临床价值得到了学界的高度认可,这也是我国新冠创新药研发的里程碑式事件,期待VV116能够尽快取得使用批准,驰援战疫一线,挽救更多生命!
参考文献:
[1]Cao Z, Gao W, Bao H, et al. VV116 versus Nirmatrelvir–Ritonavir for Oral Treatment of Covid-19[J]. New England Journal of Medicine, 2022.
[2]Xie Y, Yin W, Zhang Y, et al. Design and development of an oral remdesivir derivative VV116 against SARS-CoV-2[J]. Cell Research, 2021, 31(11): 1212-1214.
[3]Qian H, Wang Y, Zhang M, et al. Safety, tolerability, and pharmacokinetics of VV116, an oral nucleoside analog against SARS-CoV-2, in Chinese healthy subjects[J]. Acta Pharmacologica Sinica, 2022, 43: 3130-3138.
[4]Shen Y, Ai J, Lin N, et al. An open, prospective cohort study of VV116 in Chinese participants infected with SARS-CoV-2 omicron variants[J]. Emerging Microbes & Infections, 2022, 11(1): 1518-1523.