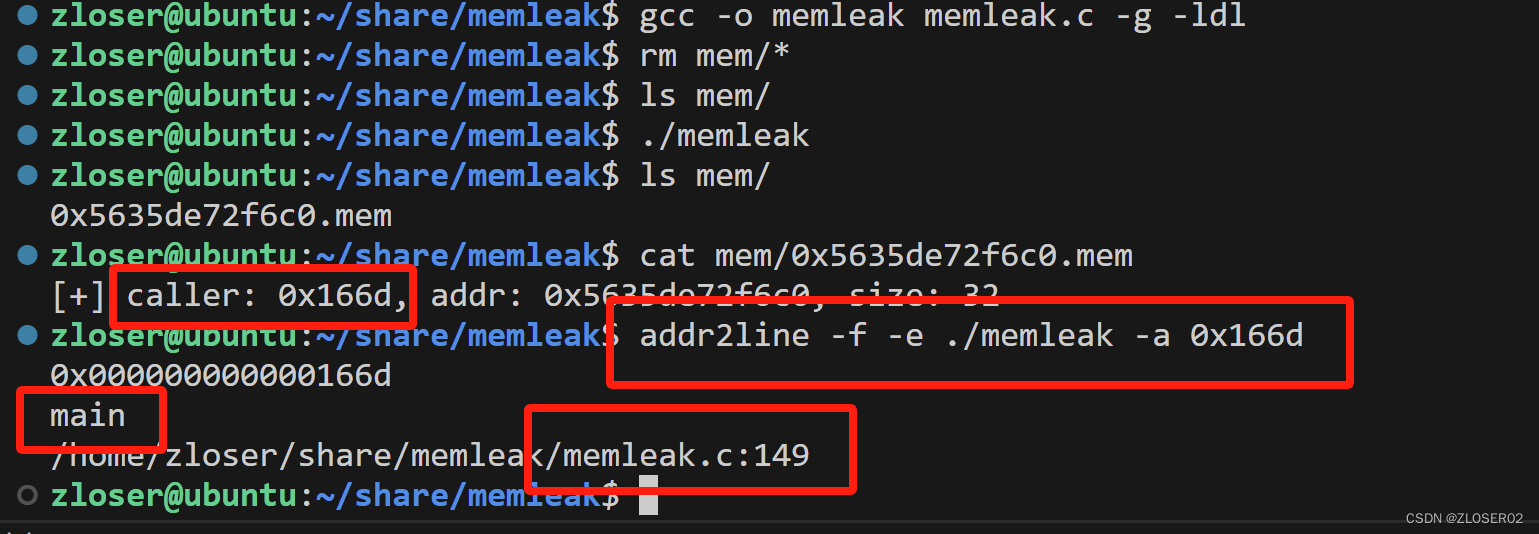
1. 在胃腺癌中鉴定与线粒体相关的差异表达基因(DEGs)并进行功能富集分析
作者当前研究的一般工作流程如图1所示。通过正常组和肿瘤组之间的火山图筛选和可视化了2381个差异表达基因(DEGs),其中包括2145个蛋白编码基因(图2A)。接下来,对来自GSEA的选择线粒体相关基因和作者研究中的2145个DEGs进行了综合分析,以过滤出183个STAD中的候选线粒体相关DEGs(图2B)。

图1 流程图

图2 鉴定与线粒体相关的差异表达基因(DEGs)并利用TCGA-STAD队列构建预后风险模型
随后进行了GO富集分析,以揭示线粒体相关差异表达基因在胃腺癌中的重要作用。这些差异表达基因可能参与小分子降解过程、线粒体组织调节等。在细胞组分方面,它们主要与线粒体基质、线粒体外膜等相关。在分子功能方面,这些差异表达基因涉及到微管结合、泛素样蛋白连接酶结合等。此外,还应用KEGG通路分析来展示这些差异表达基因所涉及的重要通路,如脂质和动脉粥样硬化、乙型肝炎感染、糖尿病心肌病和凋亡等。
2. 构建和验证一个与线粒体相关的风险标志
根据上述183个与线粒体相关的差异表达基因(DEGs),通过单变量Cox回归分析进一步筛选出19个潜在的胃腺癌患者预后风险因子(P < 0.05,图2C)。根据LASSO回归分析,基因数量进一步缩减至9个,再经过多变量Cox回归分析缩减至4个(图2D,E)。最终,利用包括NOX4、FKBP10、ALDH3A2和MAOA在内的4个与线粒体相关的差异表达基因建立了胃腺癌患者的预后模型。
如图2F所示,与正常组织相比,肿瘤样本中NOX4和FKBP10的表达较高,而ALDH3A2和MAOA的表达较低。此外,来自HPA数据库的免疫组化结果显示,与相应的非癌组织相比,胃癌组织中FKBP10的表达上调,而ALDH3A2和MAOA的表达下调。进一步的K-M分析表明,NOX4(P = 0.030)、FKBP10(P = 0.040)和MAOA(P = 0.018)的高表达与较短的总生存期相关。然而,尽管在统计学上略有差异(P = 0.052),ALDH3A2水平较高的患者的总生存期较好。
根据风险评分的中位数,将患者分为高风险和低风险亚组。K-M曲线显示高风险组患者的总生存率较差(P = 0.0009,图3A)。为评估预后风险模型在预测1年、3年和5年总生存率方面的准确性,绘制了ROC曲线,其AUC值分别为0.635、0.640和0.793(图3B)。风险评分与生存时间、生存状态和风险排名之间的关系,以及4个基因表达的热图显示在图3C中。综上所述,这些结果证明了作者的风险模型在预测STAD患者预后方面的稳健性。
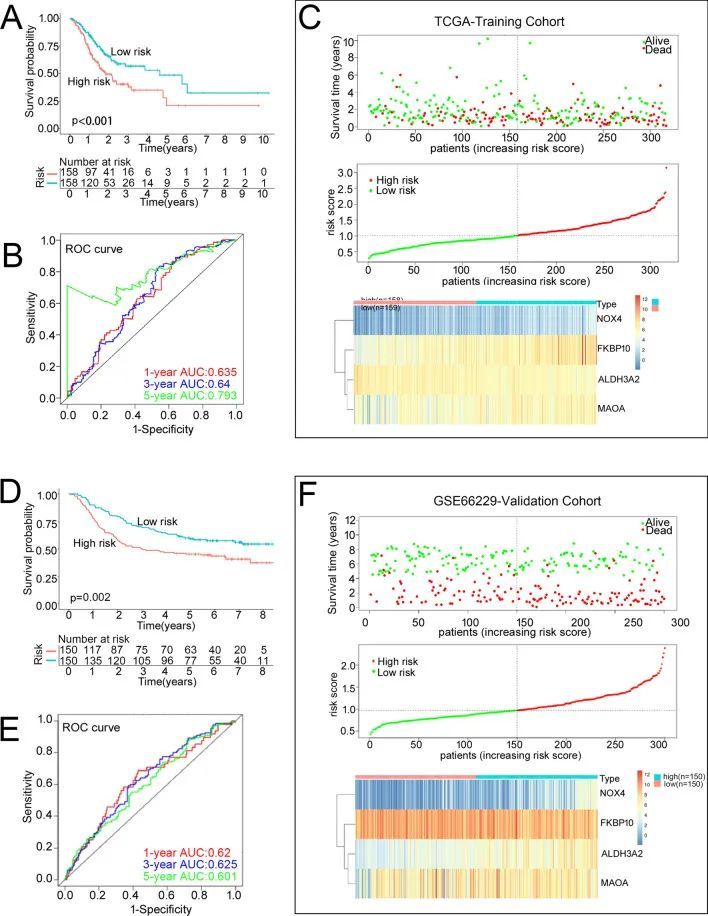
图3 评估预后风险模型在训练和验证队列中的表现
该预后风险模型的稳健性在GSE66229和GSE15459数据集中得到了进一步验证。与训练队列(TCGA-STAD)一致,高风险组患者在验证队列中也有更差的预后(图3D)。在GSE66229数据集中,1年、3年和5年生存的ROC曲线下面积(AUC)值分别为0.620、0.625和0.601(图3E)。在GSE15459数据集中,相应的AUC值为0.620、0.647和0.657。风险评分越高,生存率越差(图3F)。与TCGA-STAD训练队列一致,GSE66229验证队列中STAD的NOX4和FKBP10的表达显著上调,而MAOA和ALDH3A2的表达显著下调。接下来,作者系统分析了STAD中风险评分与临床特征之间的关系。患有H pylori感染以及囊性、粘液性和浆液性肿瘤的患者的风险评分明显较高。然而,在年龄、性别、T分期、N分期、M分期、肿瘤分期、胃癌家族史、分级和反流史等组别中,风险评分的平均值没有观察到差异。随后比较了低风险和高风险亚组的临床特征,发现性别(P = 0.006)、N分期(P = 0.043)、H pylori感染(P = 0.035)、疾病类型(P = 0.046)和生存状况(P = 0.)的差异。008) 在两个风险亚组中,达到了统计学意义.
3. 建立诺莫图的过程
该等高度集成了风险评分和所有重要的临床特征,可用于定量预测患者的预后,并为临床决策提供参考。在作者的研究中,通过使用单变量和多变量Cox回归分析构建了该等高度(表格中)最终确定了风险评分(P = 0.0005)和年龄(P = 0.020)作为预后指标。
因此,作者构建了一个预测性的风险评分(得分为100)和年龄(得分为67.5)的预后预测图。ROC曲线显示,该预测图在1年、3年和5年的总生存率(OS)的AUC值分别为0.651、0.664和0.749。校准曲线显示,实际的1年、3年和5年生存概率与预测图模型预测的生存概率基本一致。决策曲线显示,该预测图模型在预测STAD患者预后方面优于其他因素。
4. 高风险组和低风险组中差异表达基因的功能富集分析
作者进一步对高风险和低风险组的298个差异表达基因进行了功能富集分析。GO富集分析表明,差异基因在生物过程中的注释主要涉及细胞外基质(ECM)组织和细胞外结构组织。差异基因在细胞组分类别中的注释主要富集在含有胶原的ECM和胶原三聚体。差异基因在分子功能分类中的注释主要富集在ECM结构成分和胶原结合(图4A)。KEGG分析得到的前10个通路包括:蛋白消化和吸收、癌症中的蛋白聚糖、黏附斑、人乳头瘤病毒感染、PI3K-Akt信号通路、ECM受体相互作用、细胞黏附分子、轴突引导、cAMP信号通路和血管平滑肌收缩(图4B。GSEA结果显示,风险评分与高风险组的ECM糖蛋白、核心基质组和ECM组织显著相关(图4C)。
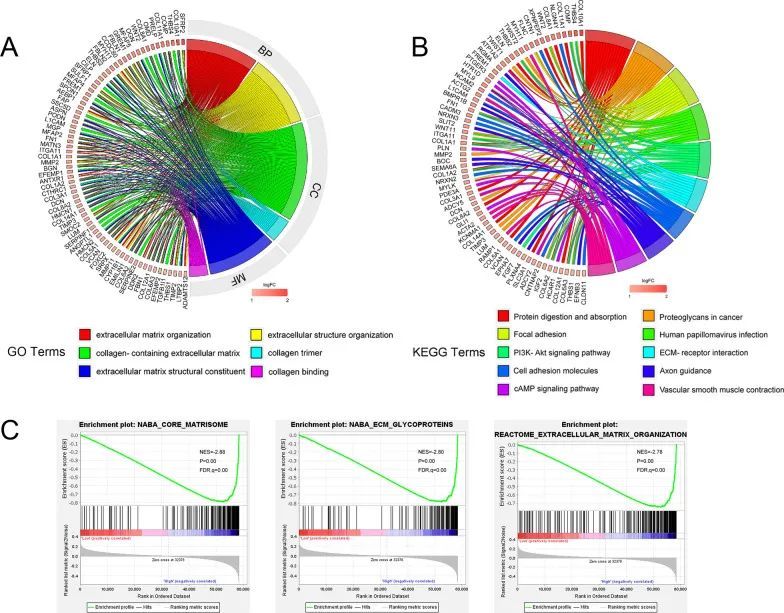
图4 高风险组和低风险组的富集分析
5. 线粒体相关风险评分与胃腺癌的肿瘤微环境特征有关
鉴于通过功能富集分析,TME相关的信号通路得到了丰富,作者探索了风险评分与TME标志物之间的关系。如图5A所示,在胃腺癌中,风险评分与基质评分呈高度正相关,高风险组的基质评分高于低风险组。作者进一步研究了风险评分与TME组分之间的关系。作者的结果表明,风险评分与大多数癌相关成纤维细胞(CAF)标志物的表达呈显著正相关(图5B),以及ECM胶原和基质标志物(图5C,D)。综上所述,这些结果表明线粒体相关的风险评分与胃腺癌中的TME标志物之间存在密切关系。
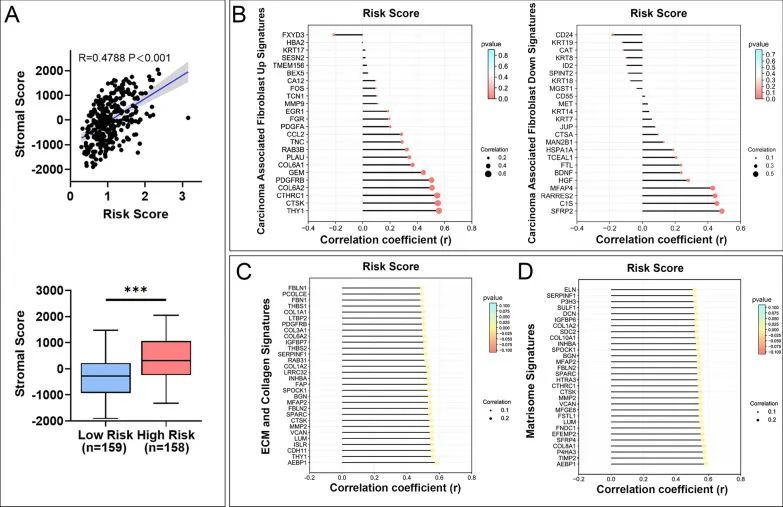
图5 食管腺癌中的风险评分与TME标志物相关
6. 线粒体相关风险评分与STAD的免疫特征和免疫治疗反应相关
肿瘤免疫微环境与恶性肿瘤患者的治疗效果和预后密切相关。检查风险评分与STAD中免疫细胞浸润之间的关系是合理的。高风险组中的原始B细胞、调节性T细胞(Tregs)、M0巨噬细胞和M2巨噬细胞的含量明显较高。相反,低风险组中CD8 T细胞和静止CD4 T细胞较高(图6A)。与上述结果一致,风险评分与M2巨噬细胞的大部分标志物表达呈正相关,与活化CD8 T细胞的大部分标志物表达呈负相关(图6B)。与先前的研究一致,ESTIMATE结果显示高风险组患者的免疫评分较高,肿瘤纯度显著较低(P = 0.370),与低风险组相比(图6C,D)。由于风险评分与基质组和CAF标记之间存在正相关,以及风险评分与激活的CD8 + T细胞标记之间存在负相关,作者推测激活的CD8 + T细胞标记与基质组和CAF标记呈负相关。有趣的是,作者的结果显示激活的CD8 + T细胞标记的表达与基质组和CAF标记均呈负相关。综上所述,这些结果强烈暗示肿瘤免疫抑制微环境可能导致高风险组STAD患者预后恶化,这需要在进一步的研究中进行验证。

图6 TCGA-STAD数据集中低风险组和高风险组之间的不同免疫特征
如今,免疫检查点抑制剂在癌症免疫治疗中得到了广泛研究和应用。在本研究中,作者的结果表明,高风险组中有43个免疫检查点发生了显著调节(图6E)。此外,风险评分与CD200、NRP1、TNFSF4、B7-H3、TNFSF18、LAIR1和OX40等7个免疫检查点的表达水平呈显著正相关(r > 0.2)。目前,PD-1和CTLA-4的抑制剂是晚期胃腺癌治疗中的研究热点。如图6C所示,高风险组中PD-1、PD-L1和CTLA-4的表达显著下调。一致地,风险评分与PD1、PD-L1和CTLA-4的表达呈显著负相关。
鉴于上述结果,作者进一步使用TIDE算法评估风险评分在预测胃腺癌免疫治疗反应能力方面的表现。作者的结果显示,风险评分与TIDE评分呈显著正相关,表明低风险组患者对免疫治疗的反应更好。高风险组的免疫治疗反应率(32.28%)明显低于低风险组(66.67%)(图7A)。

图7 风险评分是预测胃癌免疫治疗效果的潜在生物标志物
接下来,作者使用PRJEB25780队列(对45名晚期胃癌患者进行PD-L1抑制剂治疗)来验证线粒体相关风险标志是否能准确预测STAD患者对免疫治疗的反应。与TIDE的预测结果一致,PRJEB25780验证队列中高风险组的免疫治疗反应率(13.04%)明显低于低风险组(40.91%)(图7B)。
如图7C所示,低免疫亚组(34.59%)的免疫疗法反应率明显低于高免疫亚组(64.56%)。有趣的是,在低免疫评分亚组中,低风险组(45.56%)的免疫疗法反应率明显高于高风险组(20.29%)。此外,在高免疫评分亚组中,低风险组(94.20%)的免疫疗法反应率显著高于高风险组(41.57%),强烈表明联合风险评分和免疫评分是预测胃腺癌免疫疗法反应的可靠指标(图7D)。此外,高基质组(37.97%)的免疫疗法反应率明显低于低基质组(61.01%)(图7E)。在低基质亚组中,低风险亚组和高风险亚组的免疫疗法反应率分别为65.35%和53.45%,与低基质组(61.01%)相似,表明联合风险评分和基质评分并不能比单独使用基质评分更好地预测低基质评分胃腺癌患者对免疫疗法的反应。然而,低风险+高基质组的免疫疗法反应率(68.97%)明显高于高基质组(37.97%),而高风险+高基质组的免疫疗法反应率(20.00%)明显低于高基质组(37.97%),强烈表明联合风险评分和基质评分可以更准确地预测高基质评分的STAD患者对免疫疗法的反应(图7F)。
微卫星不稳定性高(MSI-H)的表型是一种高度容易受到免疫治疗影响的独特肿瘤亚类。与之前的研究一致,MSI-H亚组的免疫治疗反应率(72.73%)明显高于MSS亚组(46.30%)和MSI-L亚组(36.96%)(所有P值均为0.0005,图7G)。此外,作者的结果还显示,在MSS亚组中,低风险组的免疫治疗反应率(65.35%)明显高于高风险组(29.57%)。在MSI-L亚组中,低风险组的免疫治疗反应率(57.89%)也显著高于高风险组(22.22%)。以上结果强烈表明,风险评分和MSS/MSI-L的组合可以作为预测胃癌免疫治疗反应的可靠指标(图7H)。
7. 高风险组和低风险组的胃癌患者突变状态
细胞突变在人的一生中逐渐积累,可能导致癌症的发生。基因组测序已经彻底改变了作者对癌症体细胞突变的理解,提供了突变过程和驱动癌症的基因的详细视角。因此,作者对高风险组和低风险组的胃腺癌突变谱进行了绘制,并分析了风险评分与突变谱之间的关系。如图8A所示,高风险组和低风险组中前20个高频突变基因被呈现出来。TP53、TTN、MUC16、LRP1B、SYNE1、CSMD3、FAT4、OBSCN、ARID1A、FLG、CSMD1、DNAH5、SPTA1、PCLO和RYR2是两组中共同的高频突变基因。在前5个突变基因中,TTN和MUC16的突变率在高风险组中显著降低(图8B)。

图8 STAD中高风险组和低风险组的突变状态
此外,累积的证据支持TMB作为多种应用的潜在预测性生物标志物,包括恶性肿瘤免疫治疗的反应生物标志物。作者的数据显示,高风险组的TMB显著低于低风险组,而风险评分与STAD中的TMB呈显著负相关(图8C,D)。有趣的是,与较低的TMB相比,较高的TMB倾向于具有更好的总生存期,但没有统计学上的显著差异(P = 0.153,图8E)。此外,低风险组在高TMB亚组中倾向于具有更好的总生存期。在低TMB亚组中也得到了类似的结果,但没有统计学上的显著差异(P = 0.099,图8E)。综上所述,这些结果强烈表明风险评分和TMB的组合可能是预测STAD患者预后的有价值的生物标志物(图8E)。
8. 风险评分预测胃癌治疗效果
为了找到风险评分作为预测胃癌患者对药物(包括化疗、靶向治疗和免疫治疗)反应的指标的有效性,作者推断了TCGA-STAD患者中138种药物的IC50值。作者发现高风险组的患者可能对雷帕霉素、PD-0325901、达沙替尼等药物更敏感,而低风险组的患者可能对AZD7762、CEP-701、甲氨蝶呤等药物更敏感,这可以为临床治疗提供可靠的参考(图9)。

图9 食管腺癌中的风险评分预测药物的治疗效益
9. 胃癌关键基因表达的实验验证
为了验证STAD样本中关键基因的表达情况,作者对10对STAD肿瘤和相应的癌旁正常组织进行了qRT-PCR实验。如图10A所示,NOX4和FKBP10在STAD肿瘤组织中的表达显著高于相应的癌旁正常组织(所有P值<0.05)。ALDH3A2和MAOA在STAD肿瘤组织中的表达显著低于相应的癌旁正常组织(所有P值<0.05,图10A)。作者还通过qRT-PCR验证了这四个关键基因在人类正常胃上皮细胞系GES-1和人类胃癌细胞系中的表达情况。作者的结果显示,NOX4和FKBP10的表达显著高于正常胃上皮细胞系GSE-1(所有P值<0.05,图10B),而ALDH3A2和MAOA的表达显著低于正常胃上皮细胞系GSE-1(所有P值<0.05,图10B)。这些结果支持了作者的假设,并为选择这四个基因进行预后模型构建提供了可靠的证据(见图11)。

图10 对STAD中4个基因表达的实验验证
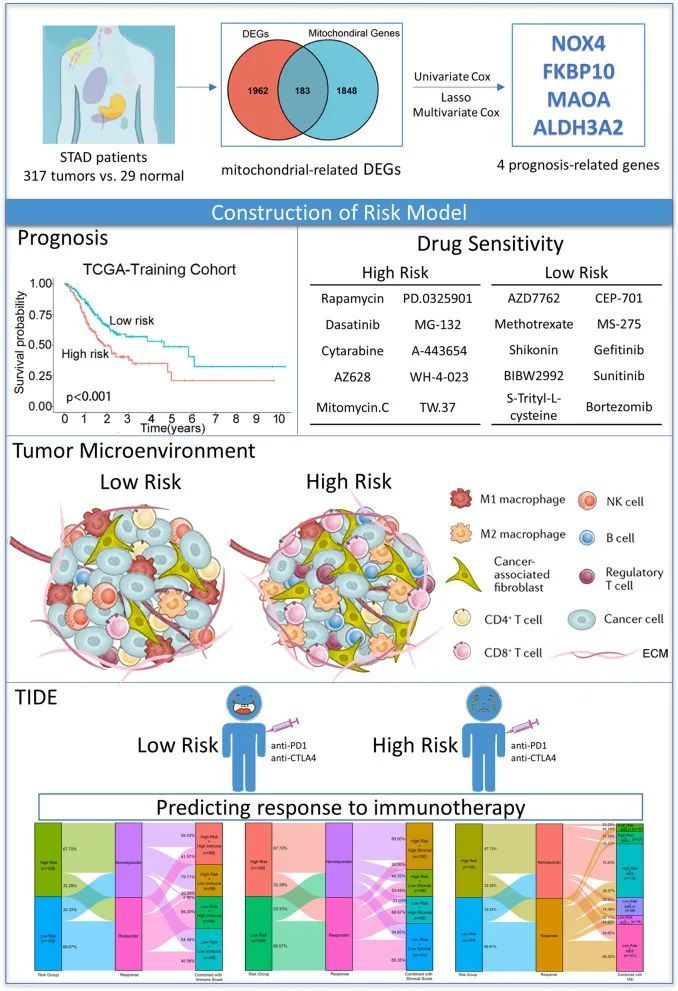
图11 本研究的工作总结图
总结
作者建立了一个包括NOX4、FKBP10、ALDH3A2和MAOA的STAD患者风险评分模型。从功能上讲,风险评分与STAD患者的TME和免疫细胞浸润密切相关。在STAD中,将风险评分与基质评分、免疫评分或MSS/MSI的综合分析,可以比单一指标更准确地预测免疫治疗的反应。关于药物敏感性,高风险组患者对雷帕霉素、PD-0325901和达沙替尼更敏感,而低风险组患者对AZD7762、CEP-701和甲氨蝶呤更敏感。综上所述,作者的线粒体相关风险模型可以作为STAD患者个体化治疗的可靠预后生物标志物。