植物转录因子研究
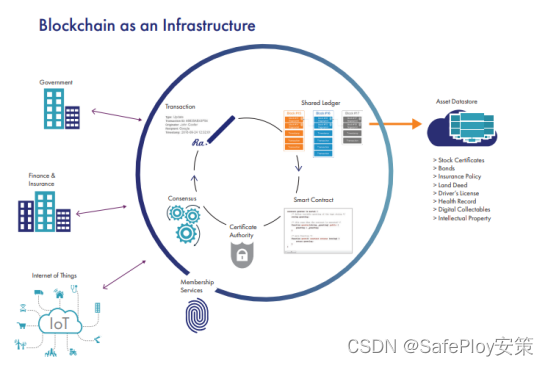
转录因子(TF)是一类具有特殊结构的蛋白质,也称为反式作用因子。通过与靶基因启动子区域的顺式作用元件特异性结合,行使调控基因表达的功能。典型的转录因子一般具有4个功能结构域:DNA结合区(DNA-binding domain,DBD)、转录调控区(transcription regulation domain,TRD)、寡聚化位点区(oligomerization site,OS)以及核定位信号区(nuclear localization signal,NLS)。这些结构域决定了转录因子的功能和特性(Liu et al., 1999)。转录因子结合位点(TFBS)是与转录因子结合的靶基因上游5'端特殊的一段DNA序列,也称为DNA结合基序(motif)。一个转录因子往往同时调控若干个基因,在不同基因上TFBS具有一定的保守性,但又不完全相同。
植物转录因子在植物的生长发育、形态建成、响应外界环境变化等方面起重要的调节作用,而且在植物性状改良和新品种培育方面具有广阔的应用前景(Yang et al., 2004)。因此,近些年来,转录因子在植物基因转录调控研究领域备受大家的关注,是研究的热点之一。
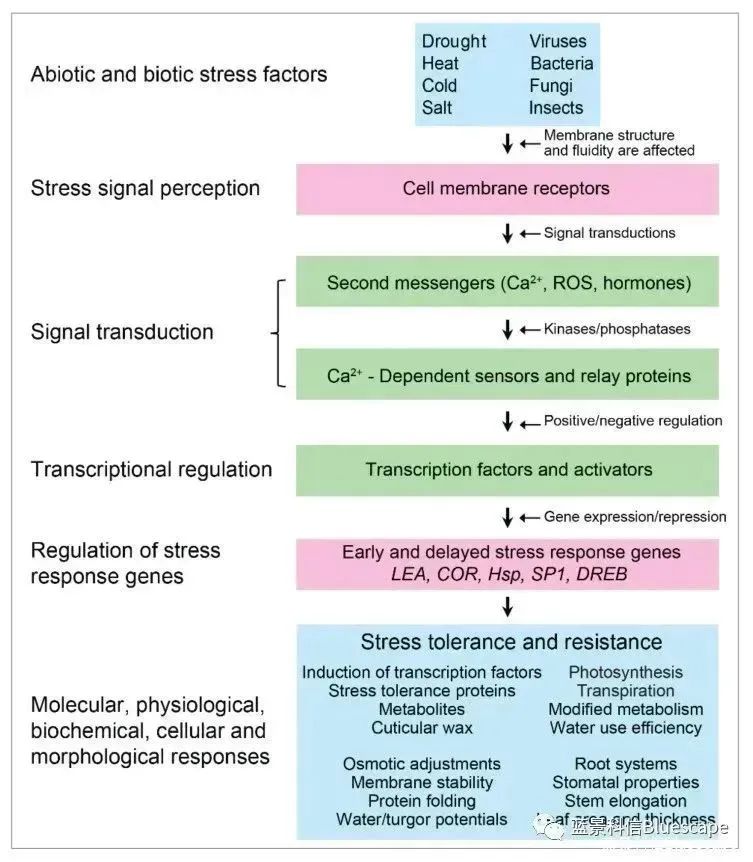
植物通过信号转导途径响应非生物和生物胁迫(Hrmova et al., 2021)
植物受到非生物胁迫(例如:干旱、热、盐、冷)和生物胁迫(例如:病毒、细菌、真菌、昆虫)后,通过细胞膜表面的受体感知胁迫信号,进而激活信号转导。信号级联反应(例如:第二信使激活、激酶活化、磷酸化/去磷酸化)的发生,调控多种转录因子及应激反应基因的转录与表达,从而介导胁迫的耐受和抵抗,并恢复细胞和组织稳态。
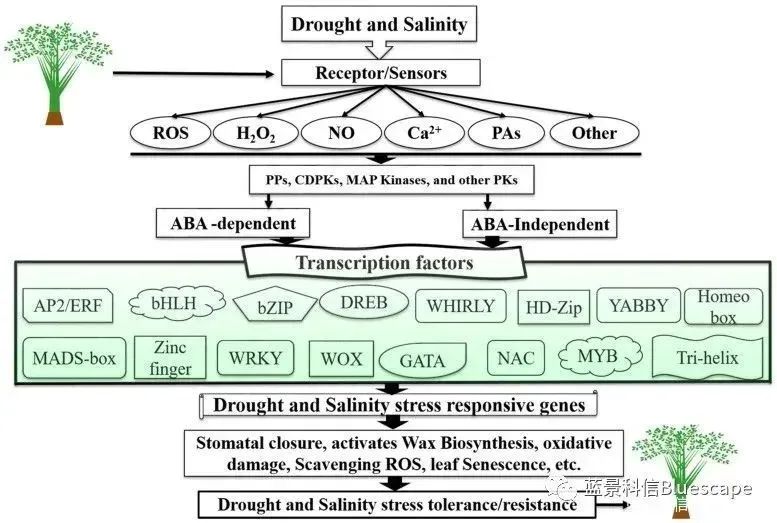
在植物非生物胁迫(干旱和盐)信号通路中,转录因子作为转录调控网络关键组成部分的示意图(Hussain et al., 2021)
植物转录因子可分为多个家族(例如:AP2/ERF、bHLH、bZIP、HD-Zip、MYB、NAC、WRKY、MADS等),且数量繁多,功能多样,增加了转录因子的研究难度。
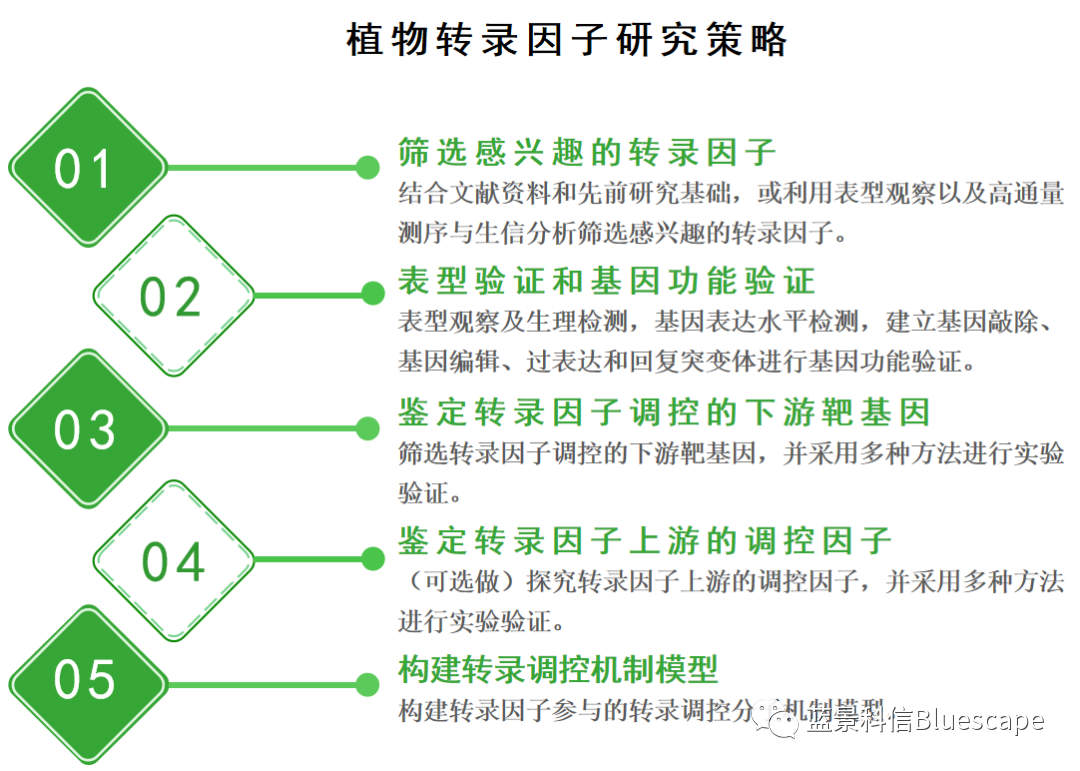
植物转录因子研究策略及常用的实验方法
在此,我们总结了植物转录因子的研究策略和方法。希望可以为模式植物及非模式植物中,转录因子对基因的转录调控机制研究增砖添瓦。

蓝景科信专注为国内高等院校和研究机构提供创新的技术解决方案和应用工具。尤其是对于分子间相互作用的研究,例如:DNA亲和纯化测序(DAP-seq),该技术可高通量地检测转录因子及DNA结合蛋白在基因组上的结合位点,鉴定下游靶基因。我们拥有100+物种,1000+转录因子的DAP-seq实验经验。在DAP-seq技术服务领域我们的客户有中国科学院植物所、遗传发育所、动物所、中国农科院畜牧所、棉花所、果树所、基因组所、中国林科院、中国农业大学、浙江大学等几十所高等院校或科研机构。而且,使用该技术已助力客户在许多期刊成功发表文章,例如:Molecular Plant,The Plant Cell,Plant Physiology,Plant Biotechnology Journal,Journal of Integrative Plant Biology,New Phytologist等。
下面,我们将结合具体的文章案例对植物转录因子研究套路进行剖析和解读。
文章案例(一)
文章题目:Phytochrome interacting factor regulates stomatal aperture by coordinating red light and abscisic acid
发表期刊:The Plant Cell

1. 筛选转录因子OsPIL15
根据前期研究基础,找到一个转录因子水稻PIF家族成员OsPIL15。该转录因子参与水稻气孔运动的调节机制尚不清楚。
2. 研究OsPIL15的基因功能
通过OsPIL15过表达和敲除突变体株系的表型观察、蒸腾作用相关生理指标检测分析、突变体回补实验、不同光照处理后的生理指标检测分析,得出结论OsPIL15通过促进气孔闭合进而负调节蒸腾作用,并且OsPIL15参与了红光/远红光诱导的水稻气孔孔径调节。进一步采用ABA处理后表型观察、生理指标检测分析、内源ABA含量测定,明确了OsPIL15参与ABA诱导的气孔关闭过程。
3. 鉴定转录因子OsPIL15的下游靶基因
主要实验:RNA-seq、RT-qPCR、DAP-seq、RNA-seq与DAP-seq联合分析、双荧光素酶报告(Dual-Luc)实验、电泳迁移率测定(EMSA)实验、OsABI5启动子序列分析、OsABI5的突变体株系实验
通过上述一系列实验,得出实验结论:OsABI5是OsPIL15调控气孔运动的直接靶基因。
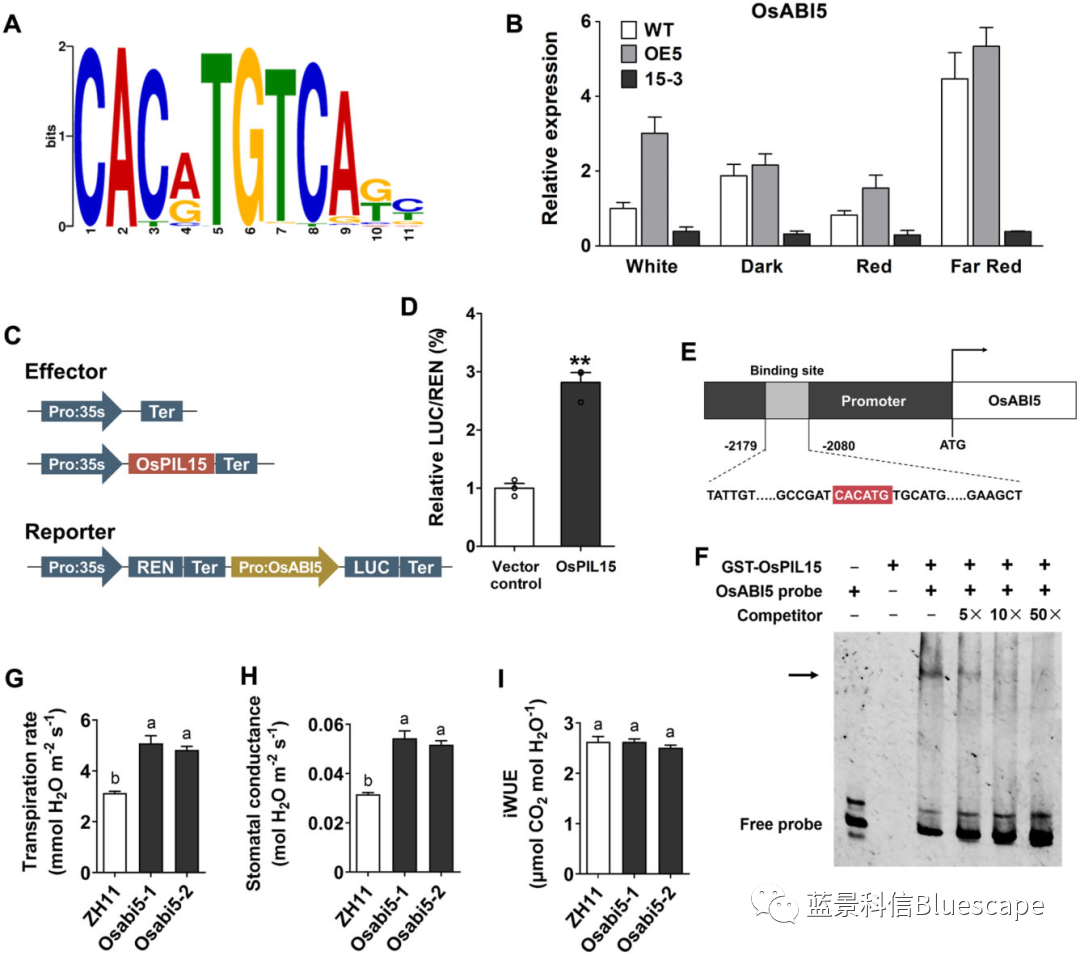
OsABI5是OsPIL15调控气孔孔径的直接靶点
A. DAP-seq鉴定了水稻OsPIL15结合的保守结合基序PBE-box:CACATG;B. 各株系置于不同光照处理下OsABI5的相对表达水平;C和D. Dual-Luc实验说明OsPIL15诱导了OsABI5的转录:C. Dual-Luc载体构建示意图、D. 相对荧光强度;E和F. EMSA实验说明OsPIL15与OsABI5启动子区的PBE-box结合:E. OsABI5启动子示意图(红色标注PBE-box)、F. EMSA结果(黑色箭头为结合条带);G-I. 利用水稻OsABI5突变体株系研究OsABI5基因对蒸腾作用的影响:G. 蒸腾速率、H. 气孔导度、I. 水分利用效率(iWUE)。
4. 鉴定OsPIL15上游调节因子
主要实验:酵母双杂交(Y2H)实验、双分子荧光互补(BiFC)实验、Pull down实验、互作蛋白OsHHO3的突变体株系实验、杂交双突变体Ospil15-2 Oshho3-2的株系实验、Dual-Luc实验、RT-qPCR实验
通过上述一系列实验,得出实验结论:OsHHO3与OsPIL15结合,协同调节气孔运动。
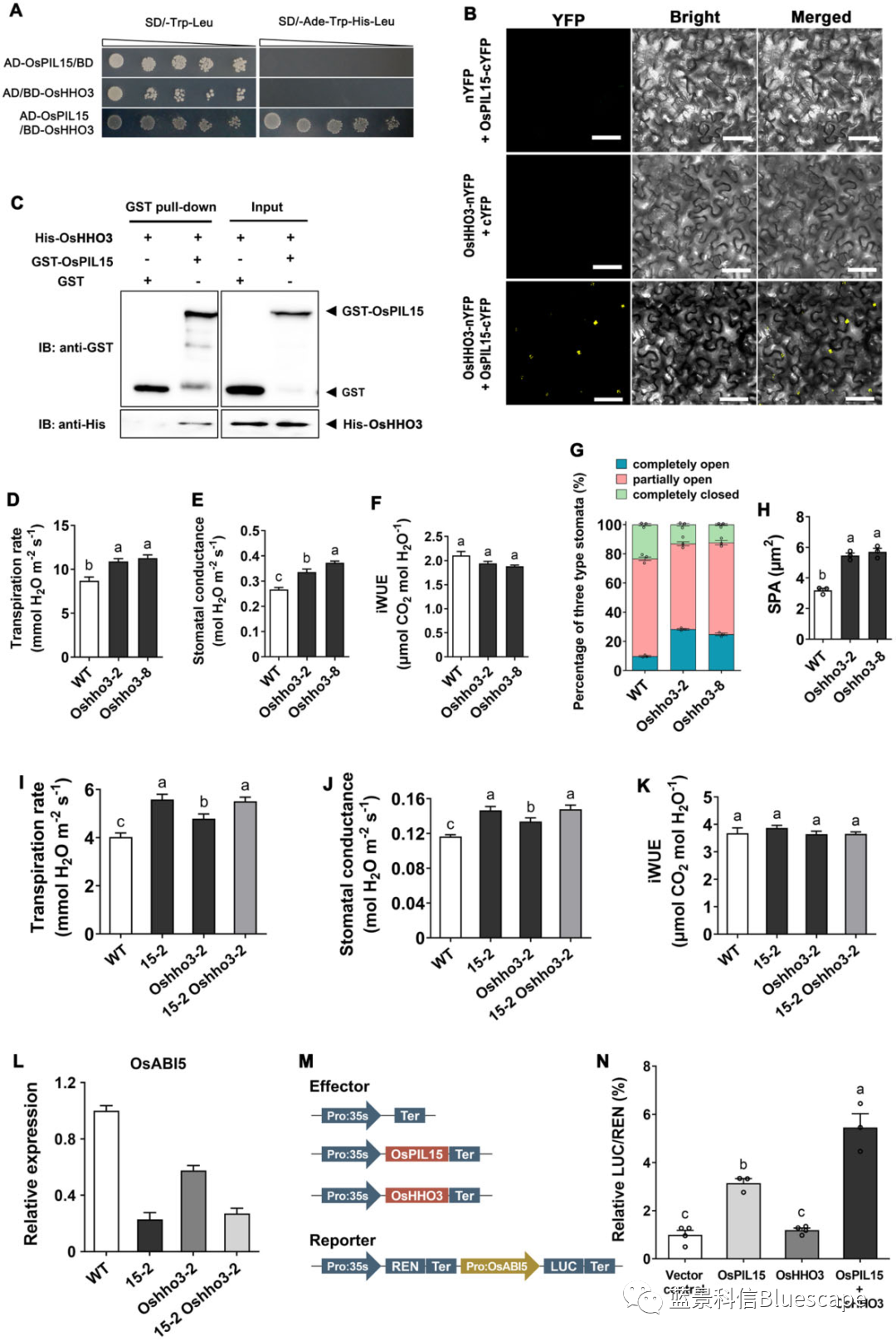
OsHHO3与OsPIL15相互结合协同调节气孔运动
A. Y2H实验;B. BiFC实验;C. Pull down实验;D-H. 利用水稻OsHHO3敲除突变体株系研究OsHHO3基因对蒸腾作用的影响:D. 蒸腾速率、E. 气孔导度、F. iWUE、G. 三种不同开度气孔的百分比、H. 气孔空隙面积(SPA);I-K. 比较单突变体Ospil15-2、Oshho3-2和杂交双突变体Ospil15-2 Oshho3-2之间蒸腾作用的差异:I. 蒸腾速率、J. 气孔导度、K. iWUE;L. 比较OsABI5基因在各突变体株系中的相对表达水平;M和N. Dual-Luc实验:M. Dual-Luc载体构建示意图、N. 相对荧光强度。
5. 研究玉米中同源基因的功能(拓展转录因子研究广度)
通过EMS诱变获得玉米突变体株系,随后开展一系列表型观察和生理指标检测分析,最终得出结论:ZmPIF1和ZmPIF3具有调节玉米气孔开度的功能,因此PIFs介导的气孔开度调控机制在植物中可能是保守的。
6. 构建OsPIL15调控的分子机制模型
该研究发现了水稻转录因子OsPIL15与OsHHO3相互作用,促进水稻OsABI5的转录。OsPIL15通过与OsABI5启动子的PBE-box基序结合调控气孔开度。此外,与OsPIL15同源的玉米PIF家族基因ZmPIF1和ZmPIF3也负调控玉米的气孔开度,表明PIF调控的气孔运动在植物中可能是保守的。

OsPIL15通过协调红光和ABA信号调节气孔运动的机制模式图
在晚上phy转化为不活跃的Pr形式,并定位于细胞质,导致OsPIL15在细胞核中积累。OsPIL15通过与OsABI5启动子结合,增强OsABI5的转录,促进水稻气孔关闭,降低蒸腾作用。此外,OsHHO3与OsPIL15相互作用,促进OsPIL15与OsABI5启动子的结合。在白天红光促进phys转化为活跃的Pfr形式,并迁移到细胞核中,于是OsPIL15蛋白被细胞核中的Pfr降解,不再诱导OsABI5的表达,从而促进水稻气孔开放,提高蒸腾作用。
文章小结:该研究揭示了PIFs在红光介导的气孔运动中发挥作用的分子机制,并证明了PIFs可以通过协调红光和ABA信号传导来调节气孔开度。
文章案例(二)
文章题目:Allelic variation in transcription factor PtoWRKY68 contributes to drought tolerance in Populus
发表期刊:Plant Physiology

1. 筛选转录因子PtoWRKY68
对不同自然种群的300份中国白杨材料进行干旱相关性状的全基因组关联分析(GWAS),筛选到显著相关的SNP位点及其关联基因PtoWRKY68(WRKY家族转录因子)。基因表达水平分析和转基因拟南芥株系实验表明PtoWRKY68是一个植物耐旱性的正调控因子。
2. 研究PtoWRKY68等位基因的功能
基于PtoWRKY68基因的序列变异分析,将毛白杨分为两个单倍型类群:PtoWRKY68hap1和PtoWRKY68hap2。通过等位基因频率调查分析、基因表达水平检测、干旱相关性状分析、转基因拟南芥株系实验,发现PtoWRKY68hap1(耐旱等位基因)的耐旱性强于PtoWRKY68hap2(干旱敏感等位基因),而且二者对干旱胁迫响应的差异并不是由于PtoWRKY68等位基因表达水平的差异所致,可能与等位基因变异对干旱胁迫的不同响应机制有关。
3. 鉴定转录因子PtoWRKY68的下游靶基因
主要实验:RNA-seq、共表达网络分析、DAP-seq、RNA-seq与DAP-seq联合分析、Dual-Luc实验、EMSA实验、杨树种群及转基因拟南芥株系中的靶基因表达水平分析、ABA敏感实验、干旱胁迫相关生理指标检测
基于上述一系列实验分析,鉴定了PtoWRKY68hap1和PtoWRKY68hap2的结合基序(分别是W1-box、W2-box)及其靶基因(PtoDTX49.1、PtoABF2.1和PtoRD26.1)。PtoWRKY68介导了靶基因在干旱胁迫下的转录调控,且相比于PtoWRKY68hap2,PtoWRKY68hap1对靶基因启动子具有更高的亲和力。干旱胁迫下PtoWRKY68hap1通过增强干旱胁迫信号通路和ABA信号通路以及减少ABA外排,从而增加细胞中ABA积累,最终增强植物的耐旱性。
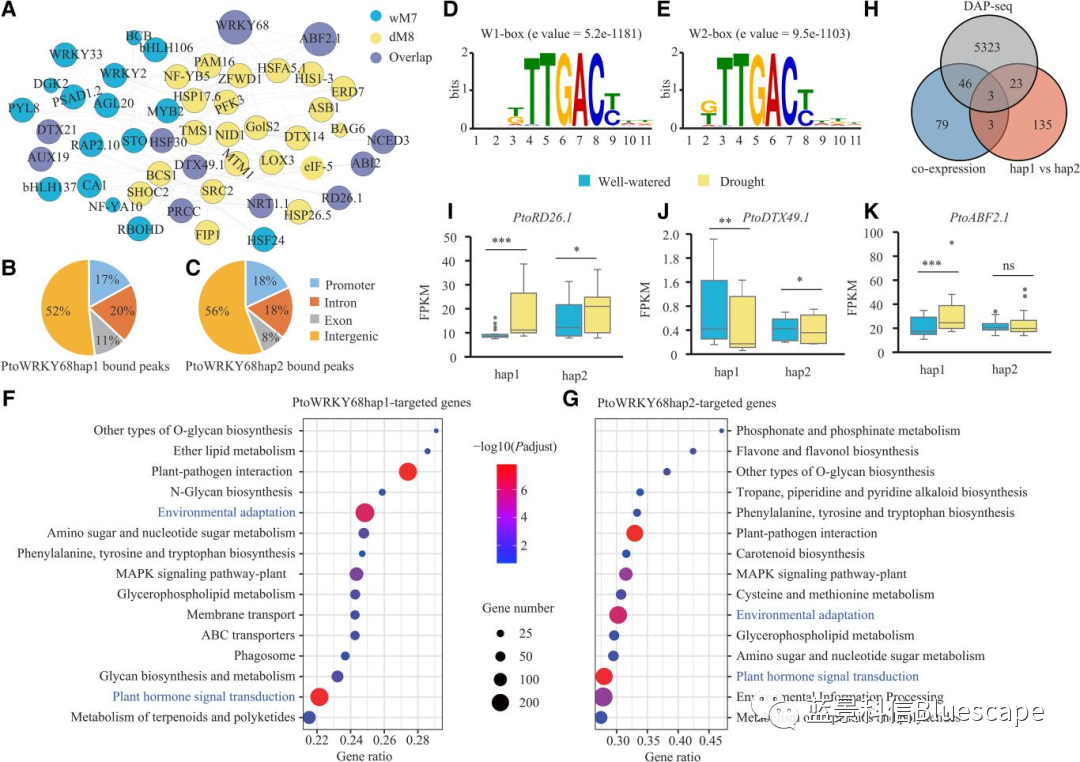
DAP-seq鉴定PtoWRKY68等位基因的靶基因
A. 水分充足及干旱胁迫下的基因共表达网络模块,在重叠基因中包含了PtoWRKY68;B和C. DAP-seq分析PtoWRKY68hap1(B)和PtoWRKY68hap2(C)的peaks在基因组上的分布;D和E. PtoWRKY68hap1(D)和PtoWRKY68hap2(E)的结合基序分别是W1-box和W2-box;F和G. PtoWRKY68hap1(F)和PtoWRKY68hap2(G)的靶基因富集的KEGG通路;H. Venn图显示有3个重叠基因;I-K. 箱型图展示3个靶基因PtoRD26.1、PtoDTX49.1、PtoABF2.1的相对表达水平(FPKM值)。
4. 鉴定PtoWRKY68上游调节因子
主要实验:数量性状位点(eQTL)分析、EMSA实验、Dual-Luc实验
eQTL分析发现PtoSVP.3受干旱胁迫诱导表达,其表达水平与PtoWRKY68呈正相关。EMSA和Dual-Luc实验验证了PtoSVP.3通过与PtoWRKY68启动子区域的CArG基序结合,促进PtoWRKY68的表达。
5. 构建PtoWRKY68调控的分子机制模型
提出了PtoWRKY68调控杨树耐旱性的分子机制模型PtoSVP.3-PtoWRKY68-PtoDTX49.1/PtoABF2.1/PtoRD26.1。为应对干旱胁迫,PtoSVP.3正向调控PtoWRKY68,PtoWRKY68等位基因通过诱导PtoRD26.1和PtoABF2.1的表达以及抑制PtoDTX49.1的表达,进而调控ABA信号传导和积累来增强杨树的耐旱性。

PtoWRKY68调控杨树耐旱性的分子机制模型
在干旱胁迫下,PtoWRKY68等位基因受PtoSVP.3的正向调控,PtoWRKY68hap1(上图)等位基因变异增强了对PtoRD26.1和PtoABF2.1的结合和激活,抑制PtoDTX49.1,从而调节ABA外排和信号转导来获得耐旱性。相比于PtoWRKY68hap1,PtoWRKY68hap2(下图)对下游靶点具有较低的结合亲和力和激活能力。因此,具有PtoWRKY68hap1等位基因的杨树材料其抗旱性优于具有PtoWRKY68hap2等位基因的杨树材料。
文章小结:该研究提出了PtoWRKY68调控杨树耐旱性的分子机制。该调控模块的鉴定为深入了解杨树耐旱性的遗传基础提供了新见解,并为利用分子育种技术开发耐旱树木新品种提供了潜在的靶点。
文章案例(三)
文章题目:Overexpression of the transcription factor MdWRKY115 improves drought and osmotic stress tolerance by directly binding to the MdRD22 promoter in apple
发表期刊:Horticultural Plant Journal

1. 筛选转录因子MdWRKY115
基于苹果基因组数据,分析了WRKY基因家族成员,并克隆了苹果基因MdWRKY115。序列比对和系统进化分析表明MdWRKY115是第Ⅲ组WRKY家族转录因子。
2. 验证转录因子MdWRKY115
qRT-PCR结果表明干旱和渗透胁迫下MdWRKY115表达上调。GUS活性分析表明在渗透胁迫下MdWRKY115的启动子活性明显增强。亚细胞定位分析发现MdWRKY115定位于细胞核。转录激活分析结果证明了MdWRKY115是一个转录激活因子。
3. 研究MdWRKY115的基因功能
转基因株系的表型分析表明,在拟南芥幼苗和苹果愈伤组织中过表达MdWRKY115,显著提高了它们对干旱和渗透胁迫的耐受性。
4. 鉴定转录因子MdWRKY115的下游靶基因
主要实验:DAP-seq、EMSA实验、转基因苹果愈伤组织中靶基因表达水平检测
DAP-seq鉴定了MdWRKY115的结合元件是W-box基序(核心序列TTGAC)以及与胁迫相关的靶基因MdRD22。EMSA验证了MdWRKY115与MdRD22启动子的特异性结合。对转基因苹果愈伤组织检测发现,过表达MdWRKY115能够促进MdRD22的表达。因此,MdWRKY115通过直接与MdRD22的启动子结合,调控其表达。
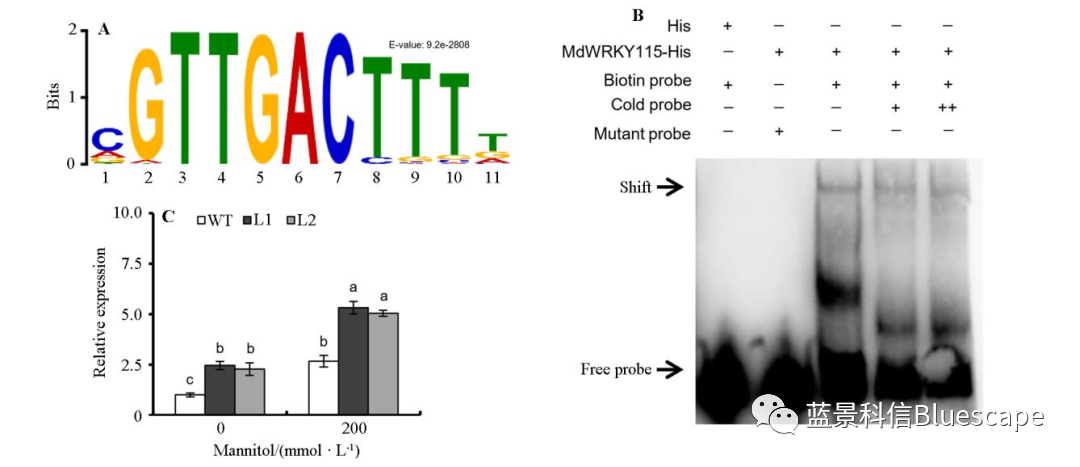
MdWRKY115直接结合MdRD22启动子,调控其表达
A. DAP-seq鉴定了MdWRKY115的DNA结合基序W-box;B.EMSA验证了MdWRKY115与靶基因MdRD22启动子的结合;C.转基因苹果愈伤组织中MdRD22的表达差异说明MdWRKY115的过表达促进了MdRD22的表达上调。
5. 构建MdWRKY115调控的分子机制模型
该研究鉴定了苹果中与干旱和渗透胁迫耐受性相关的转录因子MdWRKY115。MdWRKY115通过与MdRD22启动子结合,调控MdRD22的表达,提高了转基因拟南芥和苹果愈伤组织对干旱和渗透胁迫的耐受性。
文章小结:该研究提出了MdWRKY115通过调控MdRD22的表达增强苹果对干旱和渗透胁迫耐受性的分子机制,这对利用分子遗传策略培育耐旱植物新品种具有重要意义。
参考文献:
Liu L, White MJ, MacRae TH. Transcription factors and their genes in higher plants functional domains, evolution and regulation. Eur J Biochem. 1999 Jun;262(2):247-57. doi: 10.1046/j.1432-1327.1999.00349.x.
Yang ZR, Wang XC, Li XM, Yang CD. [Transcription factors in higher plant]. Yi Chuan. 2004 May;26(3):403-8. Chinese.
Hrmova M, Hussain SS. Plant Transcription Factors Involved in Drought and Associated Stresses. Int J Mol Sci. 2021 May 26;22(11):5662. doi: 10.3390/ijms22115662.
Hussain Q, Asim M, Zhang R, Khan R, Farooq S, Wu J. Transcription Factors Interact with ABA through Gene Expression and Signaling Pathways to Mitigate Drought and Salinity Stress. Biomolecules. 2021 Aug 5;11(8):1159. doi: 10.3390/biom11081159.
以下参考文献中的DAP-seq技术支持由蓝景科信提供。
Li Q, Zhou L, Chen Y, Xiao N, Zhang D, Zhang M, Wang W, Zhang C, Zhang A, Li H, Chen J, Gao Y. Phytochrome interacting factor regulates stomatal aperture by coordinating red light and abscisic acid. Plant Cell. 2022. 34: 4293-4312. doi: 10.1093/plcell/koac244.
Fang Y, Wang D, Xiao L, Quan M, Qi W, Song F, Zhou J, Liu X, Qin S, Du Q, Liu Q, El-Kassaby YA, Zhang D. Allelic variation in transcription factor PtoWRKY68 contributes to drought tolerance in Populus. Plant Physiol. 2023 May 29:kiad315. doi: 10.1093/plphys/kiad315.
Dong Q, Tian Y, Zhang X, Duan D, Zhang H, Yang K, Jia P, Luan H, Guo S, Qi G, Mao K, Ma F, Overexpression of the transcription factor MdWRKY115 improves drought and osmotic stress tolerance by directly binding to the MdRD22 promoter in apple, Horticultural Plant Journal. doi: 10.1016/j.hpj.2023.05.005.