肝细胞癌(HCC)是全球第三大癌症相关死亡原因。这种令人沮丧的结果被归因于HCC患者在晚期被诊断和转移的高频率。即使在可切除的HCC患者中(大多数属于早期),高达70%的患者在切除后也会经历肝内或肝外复发性转移。作为一种高度异质性的肿瘤,尽管已经确定了一些导致HCC进展的调节因子,但HCC细胞快速增殖和转移的分子机制在很大程度上是未知的。迫切需要更全面地了解HCC细胞增殖失调的分子机制,这有助于改进治疗策略。
1. 大量转录组分析揭示HCC代谢失调
为了研究HCC代谢重编程背后的机制,作者从京都基因和基因组百科全书(KEGG)数据库中选择了2886个与86种代谢途径相关的人类基因。为了揭示肝癌的代谢异质性,作者基于基因集变异分析(GSVA)估计了癌症基因组图谱(TCGA)队列中每个样本中74条代谢途径的富集分数,其中12条因样本量相对较低而被筛选出。基于层次亚型结果,发现TCGA数据集的三亚型解决方案是最优的,并拟合在亚型模型中。根据74种代谢途径的富集评分,将所有374种HCC肿瘤分为三种异质性亚型(图1A-E)。亚型1(占所有肿瘤的34.5%,n=129)的特征是聚糖代谢途径相对上调,包括n-甘氨酸生物合成、O-甘氨酸生物合成和硫酸软骨素生物合成,这些途径都与细胞外基质(ECM)的产生有关,但三种主要营养素(碳水化合物、脂质和氨基酸)代谢途径下调。亚型3(占所有肿瘤的34.2%,n=128)的特征是脂质、氨基酸和碳水化合物代谢途径显著上调,包括脂肪酸降解、精氨酸生物合成、组氨酸代谢和丙酮酸代谢。亚型2(占所有肿瘤的31.3%,n=117)的特征是每个主要类别的联合失调。使用GSE14520和ICGC数据库的数据,在外部独立队列中观察到类似的模式。肿瘤纯度被认为是异质性研究中的一个常见因素,因为肿瘤纯度的变化可能导致对异质性的偏差估计。使用“Estimate”R软件包进行肿瘤纯度分析。三个亚型的肿瘤纯度没有统计学上的显著差异。主成分分析(PCA)显示存在三个不同的转录组亚型(图1D)。此外,这三种亚型表现出不同的临床特征。
值得注意的是,亚型3的大多数患者是男性(p<0.001),老年患者的比例更高(p<0.05)。亚型1的患者肿瘤分级百分比更高(p<0.001)和临床分期更晚期(p<0.05),亚型1的总生存率(OS)(p<0.01)和无病生存率(DFS)(p<0.01(图1F、1F、G)。此外,作者接下来进行了GSVA,以找出每个亚型的Hallmark基因集的生物学过程和途径的动力学。GSVA/特征信号通路分析显示亚型1中wntβ-catenin信号、TGF-β信号和PI3K/Akt-mTOR信号显著上调,表明多种癌症相关通路被激活。
总之,作者的研究结果表明,HCC的代谢异质性分为三种代谢表型。通过不同的分析方法,发现ECM受体相关途径在亚型1中显著富集,脂肪酸代谢途径下调。总的来说,脂肪酸代谢的下调与肿瘤的侵袭性相关。
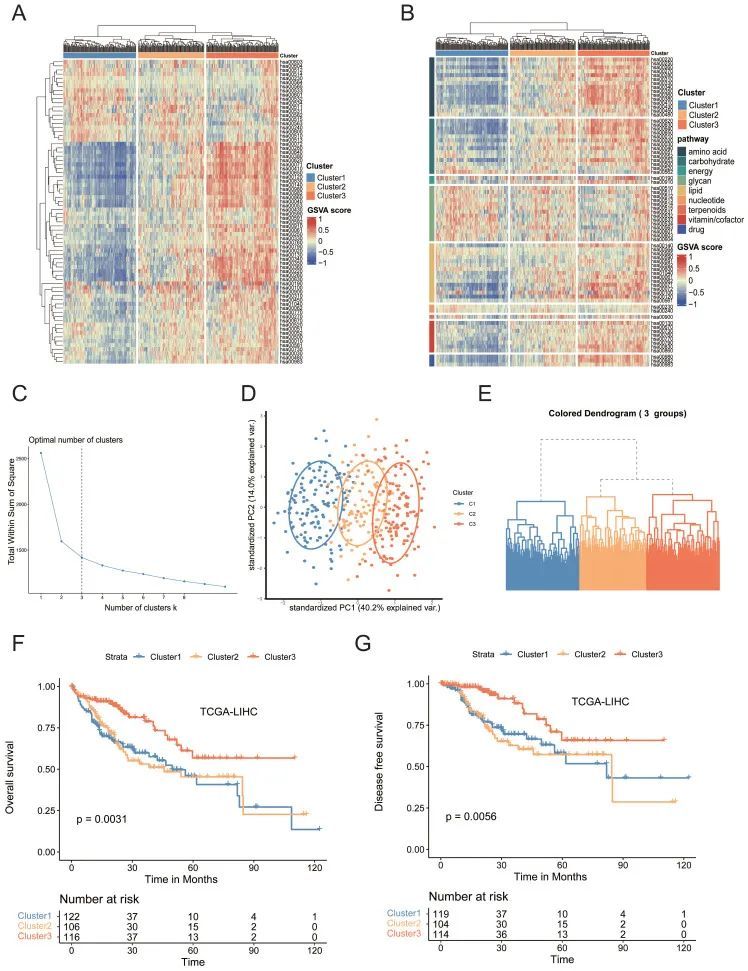
图1
2. 基于代谢途径的亚型表现出不同的基因组和转录组特征
为了确定亚型1肿瘤是否具有可能抑制其代谢表型的独特转录组程序,作者构建了火山图来比较亚型1和亚型3样本中的基因表达(图2A)。为了探索亚型1和亚型3之间是否与特定功能特征相关的差异表达基因,作者对每个差异表达基因组进行了KEGG和REACTOME分析。有丝分裂细胞周期检查点、细胞周期期和细胞外基质组织的途径在亚型1中相对富集,而如预期的那样,与物质代谢过程相关的基因集,如氨基酸和衍生物的代谢、脂肪酸代谢和细胞色素P450,在亚型3中富集(图2B)。在circos图中使用KEGG分析获得了类似的结果。与肿瘤发生和发展相关的类别,如“细胞周期”和“ECM受体相互作用”在亚型1中富集(图2C)。类脂相关代谢途径,包括视黄醇代谢、类固醇激素生物合成、胆汁分泌和脂肪酸降解,在亚型3中富集(图2D)。基因集富集分析(GSEA)进一步证明,与亚型1相比,亚型3中的脂肪酸和胆汁酸相关代谢途径显著上调,而途径包括“局灶性粘附”、“细胞粘附分子”,与亚型3相比,亚型1的“ECM受体相互作用”和“Hippo信号通路”显著上调(图2E、F)。此外,为了研究两种亚型之间体细胞变异的差异,作者使用Maftools访问HCC驱动基因,并进一步分析了突变频率最高的前20个基因(图2G、H)。结果显示,亚型1和亚型3
的CTNNB1、TP53突变频率存在显著差异(卡方检验,均<0.001)。基于上述结果,作者发现ECM相关途径的上调通常伴随着脂质代谢途径的下调。总之,脂质代谢的生物学过程可能与ECM的组成有关。
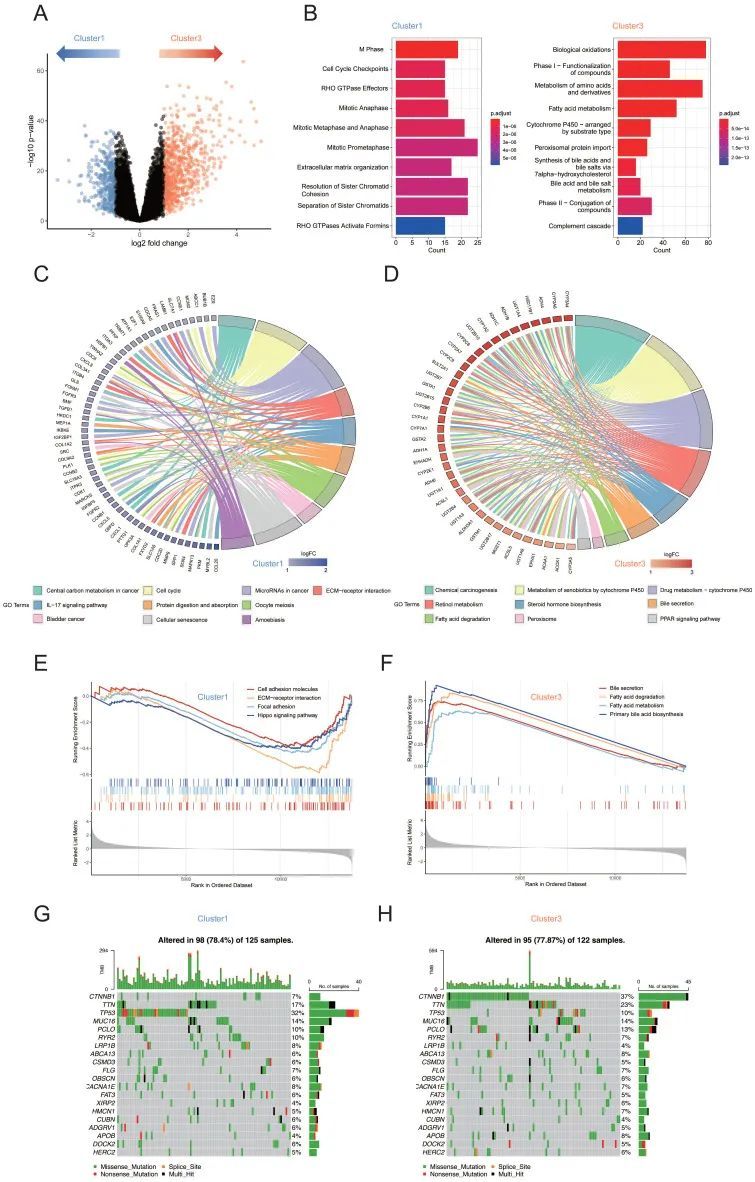
图2
3. 癌症相关成纤维细胞(CAF)相关通路与脂肪酸降解的相关性
途径分析表明,这些代谢途径富含氨基酸和脂质代谢,特别是脂肪酸降解,也称为“脂肪酸氧化(FAO)”(hsa00071)(图3A)。作者基于代谢的分类反映了脂肪酸降解途径中所有基因的表达水平,这些基因在亚型3中富集,并且与其他亚组相比,亚型3中的大多数基因显示出显著更高的mRNA水平(图3B)。生存分析显示,与富集度较低的患者相比,FAO途径富集度评分较高的患者具有更好的DFS和OS(p<0.01;图3C、D)。表明FAO通路的激活可能抑制HCC的发生和发展。FAO通路的下调可能导致脂质积聚,这通常会导致免疫抑制作用,并促进肿瘤生长和转移8。然后,作者使用微环境细胞群计数器(MCP计数器)研究了微环境中不同细胞亚群的转录模式(图3E、F),发现亚型1和亚型3之间存在显著差异。与亚型3患者相比,亚型1患者的T细胞系、细胞毒性淋巴细胞、NK细胞、B细胞、单核细胞、巨噬细胞、髓细胞和癌症相关成纤维细胞(CAF)的丰度显著高于第3组,尤其是CAF。事实上,来自亚型1的患者表达了高水平的CAF标记,如COL1A1、POSTN、LUM、ACTA2、MCAM、PDGFRA和胶原合成酶基因(图3G)。此外,CAF渗透程度评分与FAO富集度评分呈负相关(Pearson’s R=-0.32,p<0.001,图3H)。同时,FAO与成纤维细胞迁移、胶原激活信号通路、胶原形成、胶原受体活性和胶原生物合成过程呈显著负相关(图3H)。
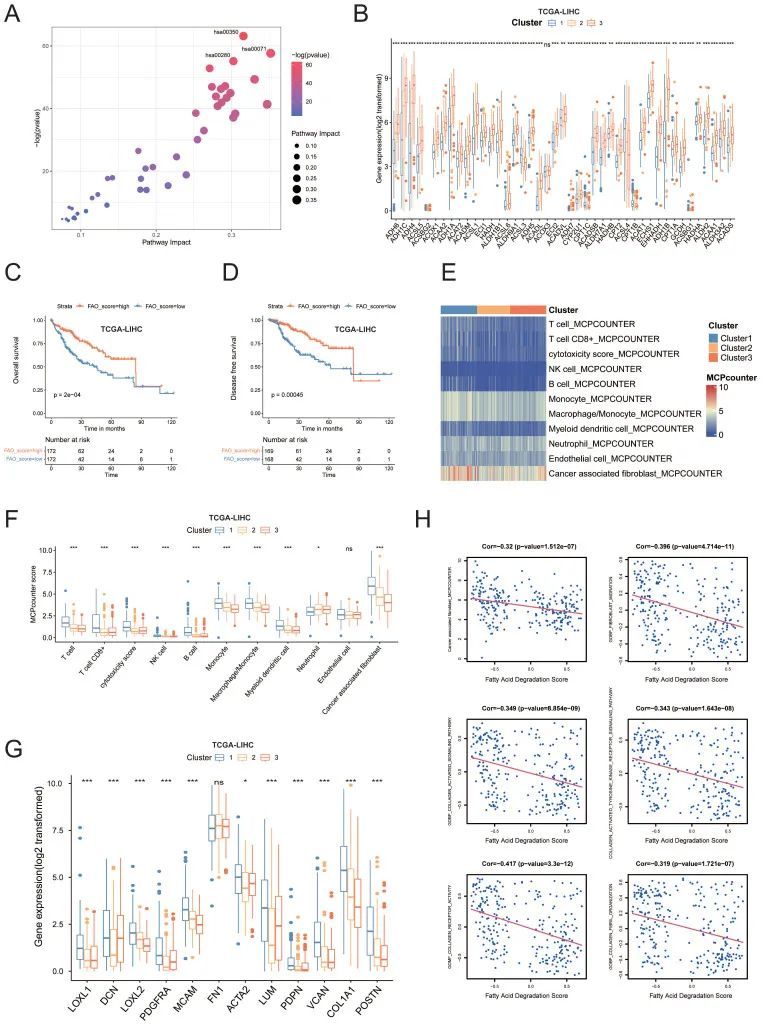
图3
总之,脂肪酸降解的生物学过程可能与CAFs的功能有关。
4. 基于scRNA-seq数据的肿瘤微环境中恶性细胞和其他细胞的代谢途径亚型
单细胞分辨率可以帮助作者更好地了解肿瘤亚克隆多样性的确切性质和肿瘤微环境。因此,作者试图确定是否可以在单细胞水平上区分三个集群之间的代谢差异。作者首先分析了GEO:GSE151530数据库,其中包括46个原发性肝肿瘤样本,并研究了肿瘤微环境中细胞的代谢异质性。
根据数据集的标签,细胞被分为七种主要细胞类型,包括T细胞(n=9286)、恶性细胞(n=4784)、未分类细胞(n=3007)、肿瘤相关巨噬细胞(TAMs)(n=2184)、B细胞(n=1718)、肿瘤相关内皮细胞(TECs)(n=1580)和CAFs(n=919)(图4A)。基于受体-配体相互作用的CellPhoneDB分析揭示了HCC中的细胞通讯。作者的分析显示,恶性细胞与TAMs以及CAFs之间的受体-配体对的相互作用明显增加,这表明这两个亚型之间的细胞-细胞通讯密切。作者使用scMetabolism R包以统一流形近似和投影(UMAP)表示可视化单细胞的代谢多样性。结果表明,脂肪酸降解途径主要富集在恶性细胞中,而ECM蛋白多糖途径富集在CAFs中(图4B、C)。此外,作者进行了GSVA,以评估每位患者在体RNA-seq水平上的通路富集评分。有趣的是,基于相同的亚型方法,所有患者都被稳定地分为三种代谢亚型(图4D、E)。与TCGA大块RNA测序的结果类似,亚型3的脂肪酸降解评分显著上调,而亚型1的O-聚糖代谢上调(p<0.001)。值得注意的是,亚组具有高度的患者特异性,每种细胞类型的比例因组而异(图4D)。为了比较不同亚型的恶性细胞之间的脂肪酸降解评分,提取恶性细胞进行进一步分析。一致的结果表明,与亚型1相比,亚型3中的脂肪酸降解评分显著上调。所有细胞类型和亚型的ReactomeGSA分析显示,脂肪酸代谢和ECM相关途径的结果相似。胶原相关途径如“胶原形成”和“胶原链三聚”在CAFs和亚型1中显著富集。脂质代谢途径在恶性细胞和亚型3中显著富集(图4F、G)。根据Pearson相关性,将上述途径的表达模式亚型到热图中。可以观察到,上述途径的水平显示出强烈的负相关(Pearson’s R=-0.57,图4H)CAFs和恶性细胞之间的关系,这与大量RNA-seq的结果一致,即脂肪酸降解可能与CAFs的功能有关。
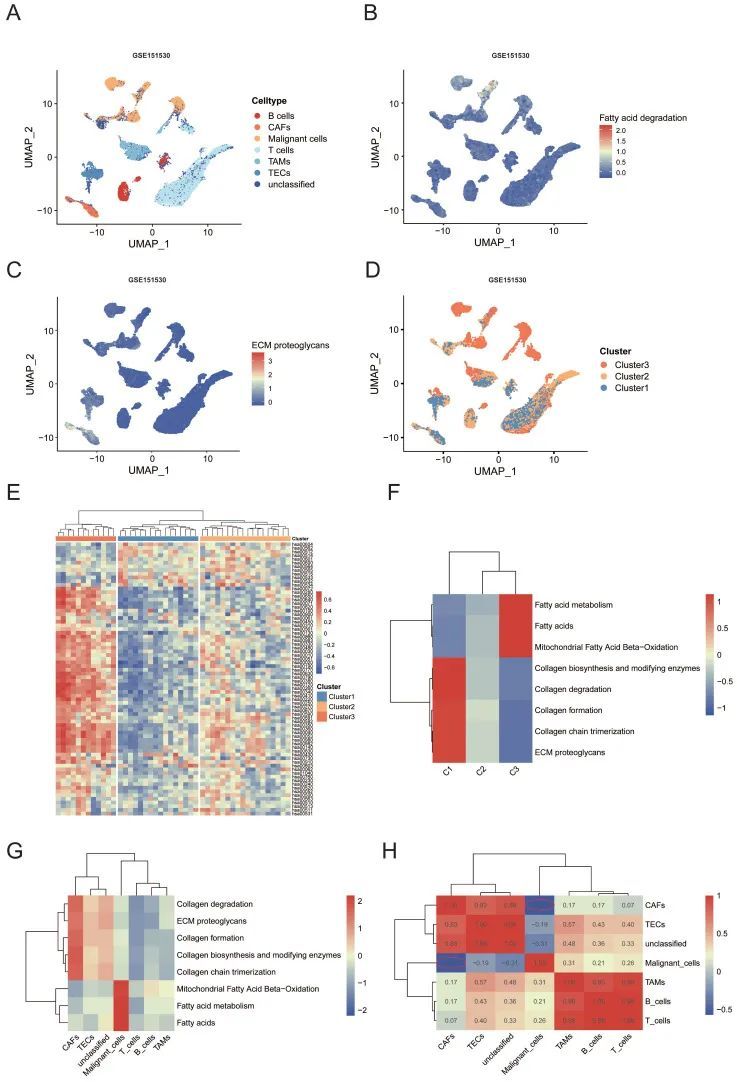
图4
单细胞和大细胞水平的转录组分析共同确定了脂质代谢和ECM重塑之间的负相关性。
5. ACADL作为脂肪代谢的关键酶在HCC中下调
为了探索可能在脂肪酸代谢中发挥作用的重要分子,作者总结了在簇3中高度表达的前十种途径的关键酶。TCGA HCC数据集的单变量Cox回归分析显示,只有FAO相关基因(ACADL)保持显著(p<0.05)(图5A)。ACADL是线粒体中分解代谢FAO第一步的关键酶,与正常肝脏(n=160)相比,ACADL不仅在HCC组织(n=369)中减少(图5B)。有趣的是,相关热图显示ACADL与多种CAF和胶原相关基因呈负相关(图5C)。此外,ACADL在各种肿瘤中显著降低(图5D)。值得注意的是,ACADL低表达的HCC患者的总生存率和无病生存率低于ACADL高表达的患者(图5E、F)。利用UALCAN进行肿瘤分期图分析(http://ualcan.path.uab.edu/)TCGA数据库进一步显示,ACADL的表达在HCC临床分期较高时逐渐降低。根据肝硬化的存在,HCC患者被分为2组,肝背景较硬的患者ACADL表达较低(p<0.01;图5G)。重要的是,在外部验证队列中观察到了类似的结果(图5H-J)。在此,作者假设僵硬可能通过调节ACADL的表达来影响脂质代谢的重新编程。
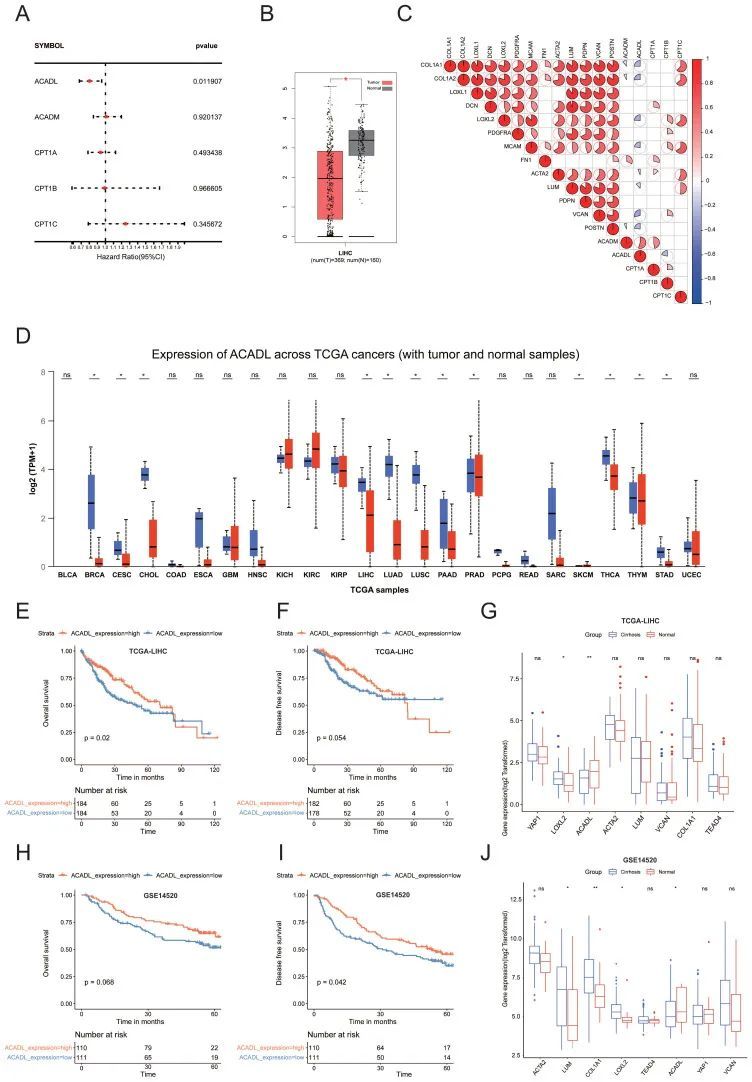
图5
6. 基质硬度通过YAP-TEAD4-ACADL调节脂质代谢
细胞粘附的基质的硬度会对细胞形态和基因表达产生深远影响。为了验证作者关于硬度可能影响脂质代谢的假设,将HepG2、Huh7和SK-Hep1 HCC细胞分别以2kPa和16kPa的微硬度接种在表面上。HCC细胞在16kPa的刚性支架上表现出侵袭性表型,表现出多边形细胞的突出外观,具有典型的HCC细胞形态,而在2kPa的刚性支架下,细胞呈球形并呈小点状(图6A)。
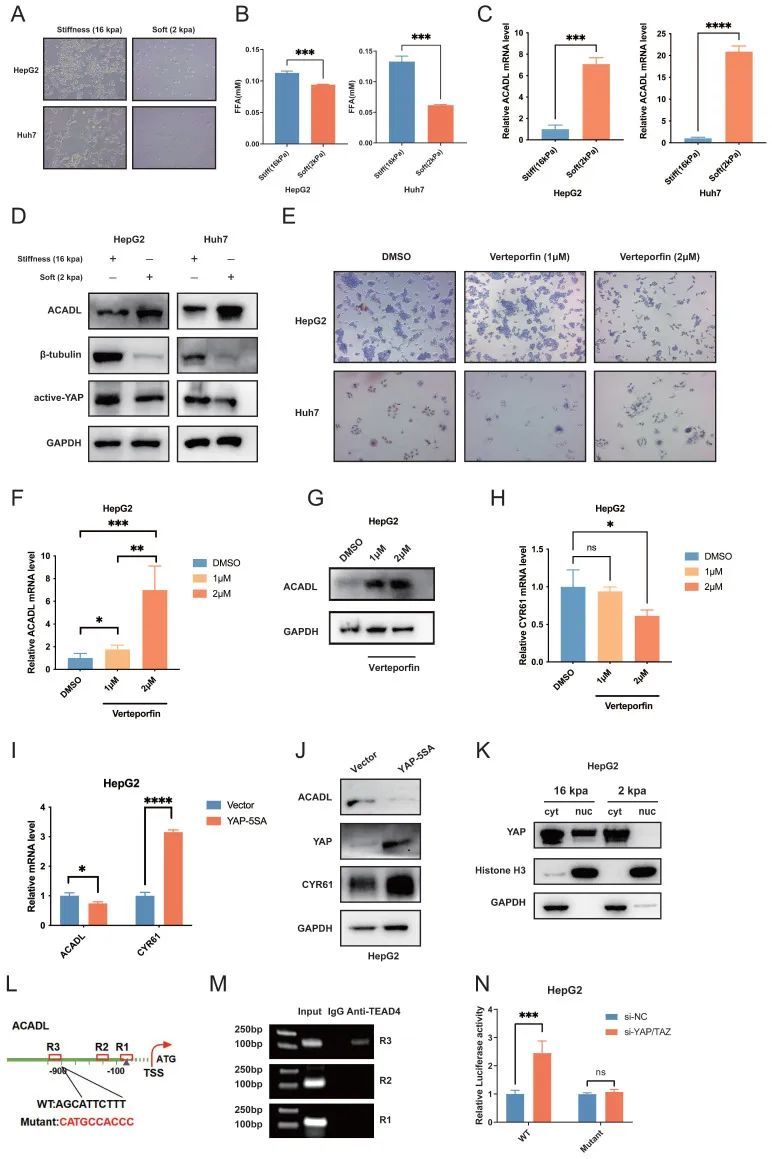
图6
如图6B所示,在16kPa的高基质硬度下,癌症细胞中的游离脂肪酸水平增加(p<0.01,图6B),与对照组相比ACADL的mRNA和蛋白水平显著下调(p<0.01;图6C、D)。先前的研究表明,不同ECM成分的信号传导可以在不同的组织类型中触发YAP/TAZ活性。例如,在新生小鼠心脏中,ECM蛋白多糖农业蛋白与肌营养不良蛋白糖蛋白复合物(DGC)结合,诱导YAP核积聚,促进心肌细胞增殖。此外,YAP转录因子的激活是CAFs的标志性特征。CAF需要YAP功能来促进基质硬化、癌症细胞侵袭和血管生成。在这项研究中,在高硬度基质中观察到活性YAP/TAZ的蛋白质水平上调(图6D)。
为了弄清ACADL在HCC中下调的潜在机制,作者通过使用hTFtarget和JASPAR2022研究了ACADL的上游调节因子,并获得了4个候选TF,包括FOXA2、HNF4A、TEAD4、YY1。值得注意的是,YAP和TAZ是Hippo通路中已建立的TEAD4共转录激活剂。已知它们与TEAD家族蛋白结合,包括TEAD4,以促进细胞增殖、生长和存活。由于YAP中缺乏DNA结合基序,转录因子TEAD14作为YAP调节靶基因表达的主要伴侣。作者假设YAP/TAZ可以通过增加ECM硬度而被激活,定位于细胞核,YAPTEAD4复合物直接靶向ACADL,导致ACADL表达降低。为了证实这一假设,在TCGA数据库中重新分析了ACADL、YAP1和TEAD4的表达,发现ACADL的表达较高,而YAP1和TEAD4在聚类3中的表达较低。ACADL的表达与TEAD4呈负相关(Pearson’s R=-0.477,p<0.001)。维替泊芬是一种YAP抑制剂,可破坏YAP-TEAD相互作用。作者的研究结果表明,当用浓度增加的维替泊芬处理时,HCC细胞表现出明显较低的脂质积聚水平,这表明破坏YAP-TEAD相互作用可能有助于在HCC中利用脂质(图6E,p<0.01)。作者的结果还表明,随着维他泊芬浓度的增加,HCC细胞中ACADL mRNA和蛋白水平增加(图6F,G,p<0.01)。此外,YAP下游基因CYR61是公认的YAP下游靶基因之一,其转录水平在维替泊芬处理浓度增加的情况下逐渐降低(图6H,p<0.01)。此外,然后在YAP过表达的细胞中测定ACADL的表达水平。有趣的是,在YAP5SA过表达的HepG2和Huh7细胞中,ACADL的mRNA和蛋白水平均下调(图6I、J,均p<0.01)。作者的细胞质/细胞核蛋白质提取分析显示,YAP在软支架上的细胞中的细胞核积累较少(图6K)。这些结果表明ACADL的表达在转录水平上受到YAP的负调控。
为了进一步说明详细机制,作者在人 ACADL 基因的启动子区域中识别了三个保守的 TEAD4 结合位点 (AGCATTCTTT)(图6L)。染色质免疫沉淀 (ChIP)PCR 结果表明 TEAD4 可能与 ACADL 启动子的远端保守位点 (R3) 结合 (图 6M)。为了进一步验证 ACADL 是否是 YAPTEAD 转录复合物的靶基因,作者生成了两个由野生型 (WT) 和 TEAD4 结合缺陷的 ACADL 启动子驱动的荧光素酶报告基因(图6K)。重要的是,siRNA介导的YAP/TAZ敲低显着增强了HepG2和Huh7细胞中WT ACADL启动子报告基因的转录活性,但对突变ACADL启动子报告基因没有影响(图6N)。
总的来说,这些结果表明 YAP 在肿瘤细胞中被刚性基质激活,从而通过 YAPTEAD4 复合物与 ACADL 基因启动子结合诱导 ACADL 转录的抑制。
7. 软基质增加体内 ACADL的mRNA 和蛋白质水平
作者研究的动物实验工作流程如图所示(图7A)。β-氨基丙腈 (BAPN),一种公认的 LOX 活性抑制剂。之前的研究已经证明 BAPN 可以降低胰岛素瘤小鼠的组织硬度20。结果表明,BAPN组的肿瘤体积明显小于对照组(图7B,C,p < 0.05)。此外,对照组的肿瘤重量明显大于对照组在 BAPN 组中(图7D,p < 0.01)。羟脯氨酸分析显示,与 PBS 对照组相比,BAPN 组的胶原蛋白含量显着降低(图7E,p < 0.001)。ACADL 显示 BAPN 组肿瘤组织中的 mRNA 和蛋白质水平高于 PBS 对照组(p < 0.01)。BAPN组肿瘤中天狼星红染色显示肿瘤间质组织同一区域胶原沉积减少,ACADL表达显着升高,而YAP和α-SMA表达显着升高被认为是 CAF 的标记基因,在 BAPN 组中显着增加(图 7F)。
8. 胶原含量增加和ACADL下调协同预测HCC患者的不良预后
作者探讨了肿瘤组织中胶原含量和ACADL表达对预后的协同预测价值。在一个由78名HCC患者组成的独立队列中,通过组织微阵列中的免疫荧光测量ACADL的表达和肿瘤内胶原含量。作为组织硬度的替代标记,使用Image J软件自动量化I型胶原的平均荧光强度以测量胶原含量。I型胶原染色在肿瘤的基质室中特异性发现,而ACADL优先分布在细胞质中(图S3F)。HCC中胶原含量与ACADL表达水平呈显著负相关(图8A、B,p=0.013)。与顺应性肿瘤患者相比,肿瘤较硬的患者OS较差(p<0.01;图8C)。同时,ACADL低表达的患者比ACADL高表达的患者有更不利的结果(p<0.05;图8D)更重要的是,HCC患者的预后根据ACADL表达水平和胶原含量进行分层。与胶原低/ACADL高肿瘤患者相比,胶原高/ACADL低肿瘤患者的生存结果明显较差(p<0.001,图8E)。同样,在TCGA-LIHC队列中,胶原高/ACADL低的肿瘤与低生存率相关(p=0.0396,图8F)。这表明增加基质硬度和ACADL下调对HCC进展的协同作用。与HBV感染的重要性相似,胶原高/ACADL低肿瘤与不良预后之间的相关性是显著的,并且与其他临床病理参数无关。
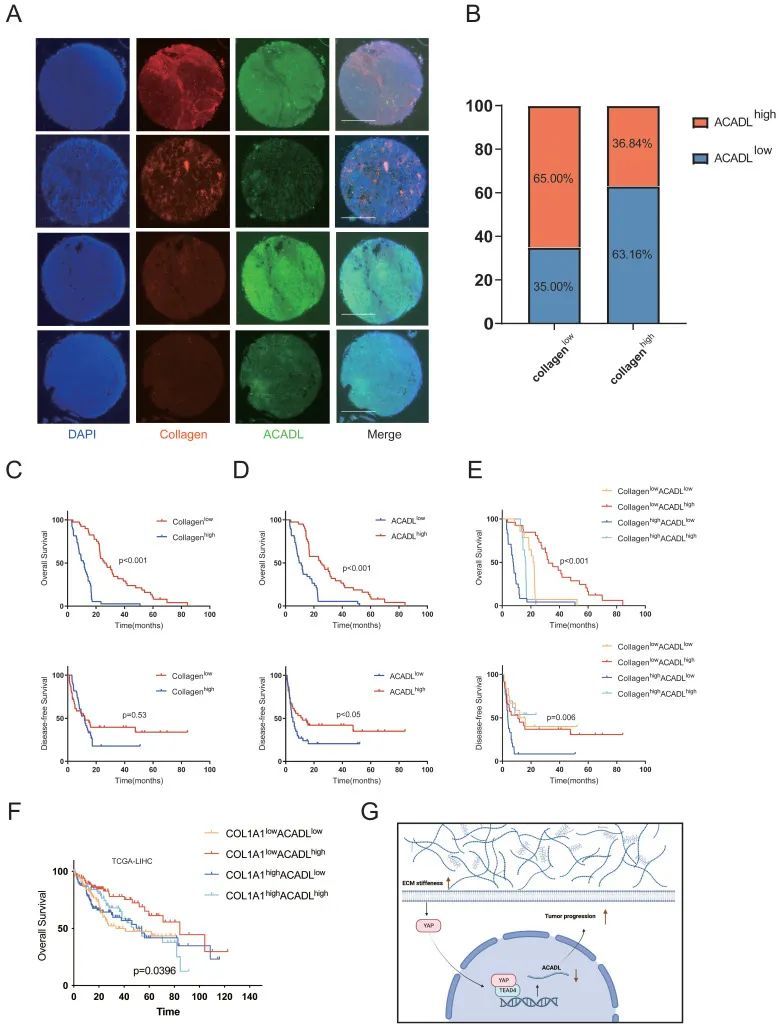
图8
总之,这项研究提供了一个新的机制见解,将基质硬度YAP-ACADL轴与脂质代谢重编程和HCC进展联系起来,表明ACADL依赖性机械反应途径是HCC治疗的潜在治疗靶点(图8G)。
总结
在这项研究中,作者证明HCC亚群根据其代谢特征具有不同的转录组特征,这表明针对代谢脆弱性的不同治疗策略可能对HCC患者亚群具有临床益处。此外,本研究还提供了一种将基质硬度ACADL轴与脂质代谢重编程和HCC进展联系起来的新机制,表明ACADL依赖性机械反应途径是HCC治疗的潜在治疗靶点。