热休克蛋白家族A成员5(HSPA5)在内质网(ER)应激反应和未折叠蛋白应答(UPR)中起着关键作用,这两者对于细胞内蛋白质折叠、组装和质量控制至关重要。在ER应激的响应下,HSPA5会过度表达以维持细胞内稳态。先前的研究揭示了HSPA5表达与多种癌症之间的强关联。然而,HSPA5的预后功能及其在肿瘤形成中的作用仍然大部分未知。
1. 基因改变信息分析
cBioPortal工具显示,HSPA5基因变异具有显著的多样性和频率,UCEC、COAD、急性髓系白血病(AML)和睾丸生殖细胞肿瘤(TGCT)的突变率分别为4.73%、1%、0.67%和0.39%(图1A)。这些肿瘤显示出各种类型的突变。相比之下,肾脏嫌色细胞瘤(KICH)、食管腺癌(EAC)、低级胶质瘤(LGG)和肾脏肾乳头状细胞癌(KIRP)仅显示一种扩增类型,频率分别为1.54%、1.1%、0.97%和0.35%。其他肿瘤则显示两种或更多的变化类型。在各种肿瘤中,共鉴定出102个HSPA5的不确定意义变异(VUS)(图1B)。TCGA队列中HSPA5的转录表达,以及各种拷贝数和突变情况。
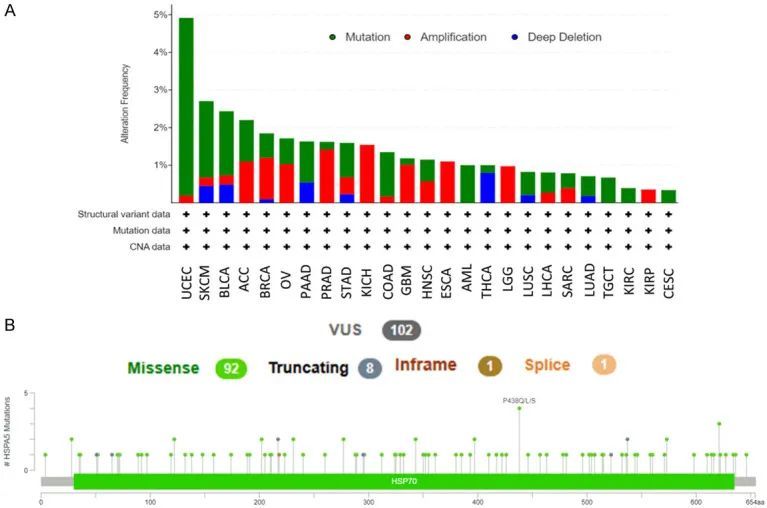
图1 特定TCGA肿瘤中的HSPA5基因突变
2. 基因表达分析
使用GTEx、Human Protein Atlas(HPA)和Functional Annotation of Mammalian Genome 5(FANTOM5)队列的数据,对各种健康器官、单个细胞类型和肿瘤中的HSPA5表达进行了比较。在正常组织中,骨髓表现出最高的HSPA5表达;然而,RNA组织特异性较低。在单细胞RNA和RNA癌症分类分析中,HSPA5表达显示出有限的细胞类型特异性和较弱的癌症特异性。
使用TCGA和GTEx数据库,对不同肿瘤类型中HSPA5的转录表达进行了检查。在33种常见肿瘤类型中,与相应的正常组织相比,HSPA5主要在26种肿瘤中表达(图2A)。然而,在急性髓系白血病(LAML)组织中,HSPA5的表达比健康组织更为普遍(P=0.001)。同样,在KICH、KIRP、肉瘤(SARC)和甲状腺乳头状癌(THCA)中,HSPA5的表达在正常和恶性组织之间相当。卵巢浆液性囊腺癌(OV)、结直肠腺癌(COAD)、子宫内膜癌(UCEC)、头颈部鳞状细胞癌(HNSC)、肺腺癌(LUAD)和肾透明细胞癌(KIRC)是HSPA5蛋白在肿瘤组织中明显升高的癌症类型(图2B)。图3展示了来自HPA数据库的BRCA、LIHC和COAD中HSPA5表达的免疫组化染色。
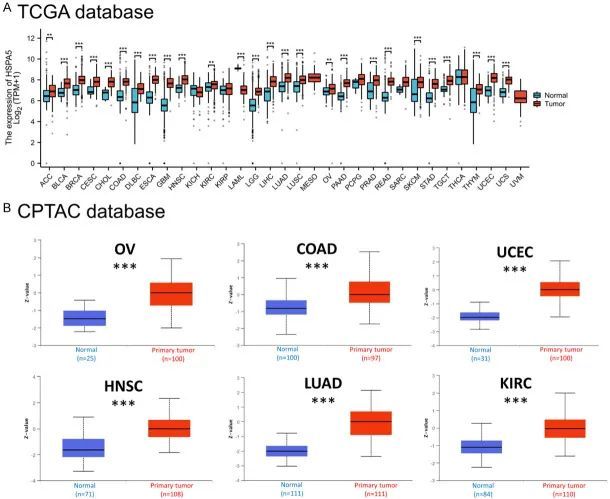
图2 各种肿瘤中HSPA5的表达
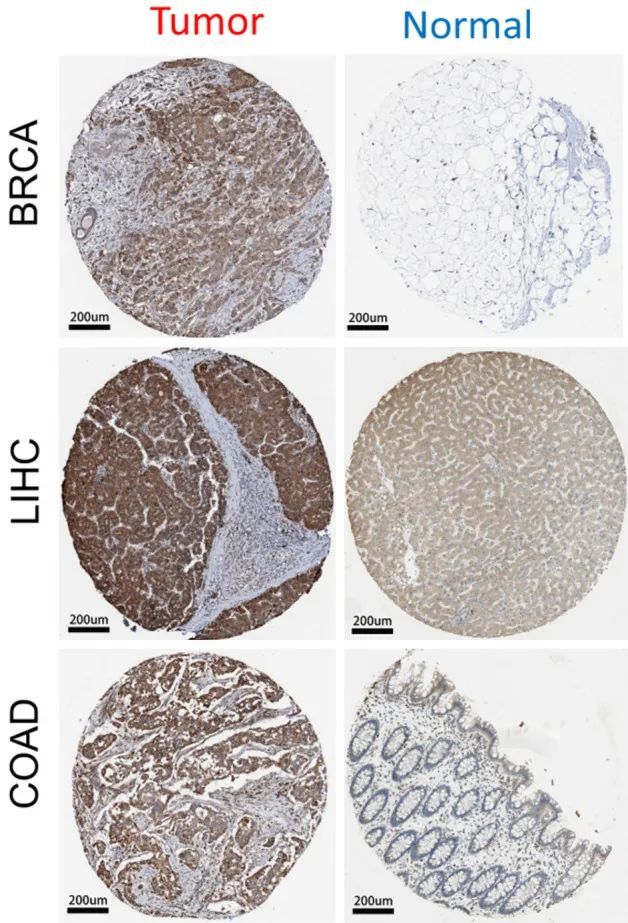
图3 三种肿瘤类型(COAD,LIHC和BRCA)在翻译水平上与其相应的正常组织(结肠,肝脏和乳房)相比,表现出不同水平的HSPA5表达
3. 生存分析
利用TCGA的数据,根据较高和较低的HSPA5表达水平分成了两组。已经在各种癌症类型中研究了HSPA5表达与患者预后的关系。在BRCA、宫颈鳞状细胞癌、子宫内膜腺癌(CESC)、胶质母细胞瘤(GBM)、HNSC、KIRP、LGG、LIHC、LUAD、SARC和葡萄膜黑色素瘤(UVM)等癌症中,过度表达HSPA5的患者显示出相对较低的生存率(图4,P < 0.05)。ACC、BLCA、CESC、食管癌(ESCA)、GBM、HNSC、KICH、KIRP、LGG、LIHC、肺鳞状细胞癌(LUSC)、胰腺腺癌(PAAD)、前列腺腺癌(PRAD)、SARC和UVM等高HSPA5表达的患者显示出较低的无病生存率(图4,所有P < 0.05)。在ACC、BLCA、CESC、淋巴组织肿瘤弥漫性大B细胞淋巴瘤(DLBC)、HNSC、KICH、肾透明细胞癌(KIRC)、KIRP、LGG、LUSC、PAAD、SARC和UVM中,高HSPA5表达与PFI相关(图4,P < 0.05)。选择了HNSC、KIRP、LGG和SARC四种代表性肿瘤的OS、DSS和PFI的Kaplan-Meier曲线。这些研究结果表明,HSPA5可能有助于各种肿瘤向恶性发展,并可能成为一种潜在的预测性生物标志物。
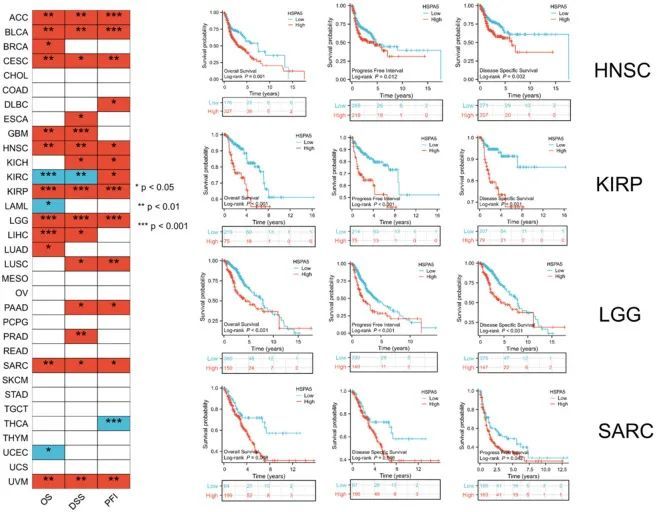
图4 HSPA5基因在肿瘤中的表达与TCGA中的生存预后之间的相关性
4. 基因富集分析
使用STRING程序,确定了与HSPA5相互作用的前50个蛋白质,并生成了一个蛋白质相互作用网络(图5A)。与HSPA5表达相关的前100个基因列在附表1中。将HSPA5相互作用和相关基因合并,并进行了KEGG通路和GO富集分析。根据KEGG通路分析,这些基因参与与前列腺癌和其他癌症相关的过程。HSPA5表达与动脉粥样硬化、肌萎缩性侧索硬化和其他神经退行性疾病密切相关。HSPA5对蛋白质的输出和基于内质网的蛋白质加工也至关重要(图5B)。
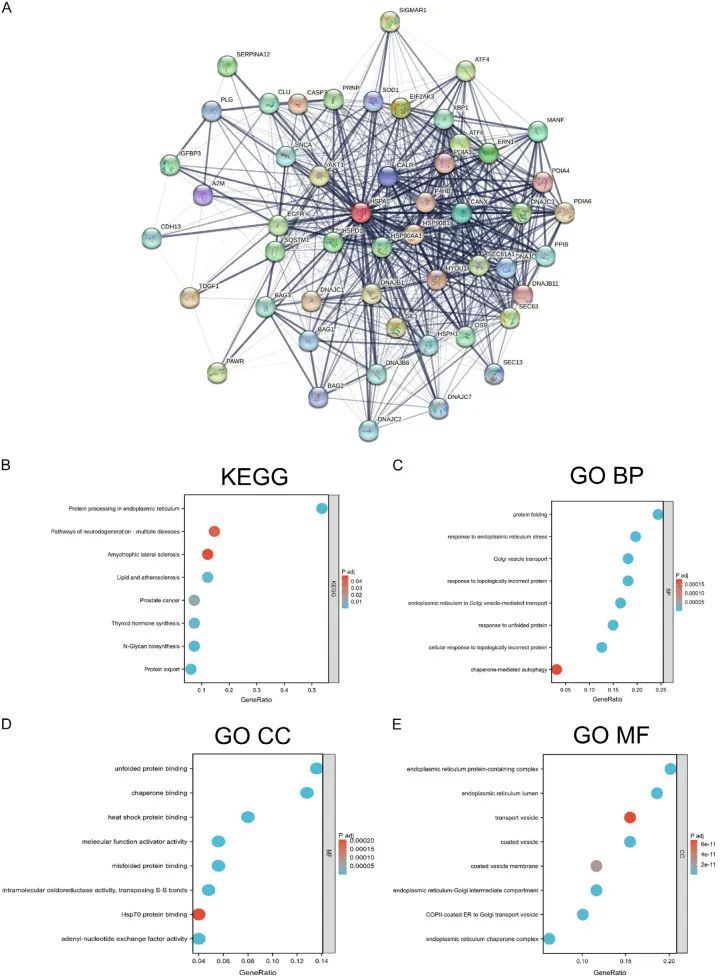
图5 HSPA5相关基因富集分析
GO富集分析显示,与HSPA5相互作用和相关的基因与生物过程(BP)类别的功能相关,如伴随体介导的自噬、应对内质网应激、高尔基小泡运输、应对拓扑错误蛋白、内质网到高尔基小泡介导的运输、应对未折叠蛋白以及应对错误折叠蛋白(图5C)。进一步分析表明,内膜系统与细胞组分(CC)类别中的含有内质网蛋白复合物之间存在强烈联系,并与HSPA5相关(图5D)。分子功能(MF)类别分析显示了HSPA5与多种分子结合能力之间的关系(图5E)。此外,GSEA分析显示了TCGA队列中HSPA5表达高的患者的基因表达谱与EGFR和BMI1等与癌症相关的基因之间的关系(图6)。
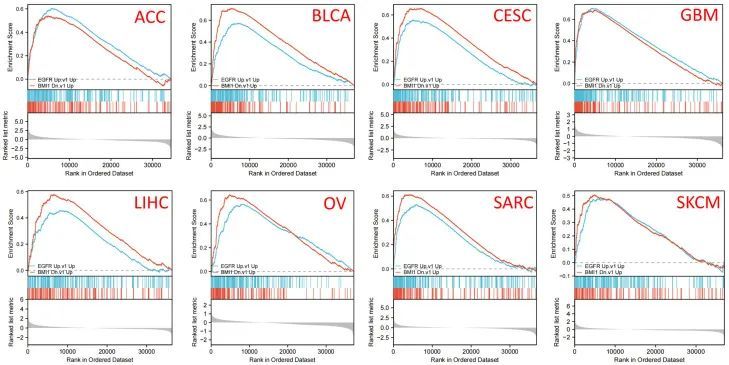
图6 HSPA5的致癌基因集富集分析
5. 免疫相关分析
使用四种算法(TIDE、XCELL、EPIC和MCPCOUNTER)检查了HSPA5表达与CAFs之间的关联。大多数算法显示出相似的模式,从而增加了研究结果的可信度。HSPA5表达与大多数肿瘤类型中的CAF浸润呈正相关,包括前列腺癌(PRAD)、胃腺癌(STAD)和甲状腺癌(THCA),但与头颈部鳞状细胞癌(HNSC)、肺鳞状细胞癌(LUSC)、低级别胶质瘤(LGG)、肺腺癌(LUAD)、结肠直肠癌(COAD)和胸腺瘤(THYM)中的CAF浸润呈负相关(图7A)。图7B显示了算法生成的代表性散点图。作者还研究了HSPA5表达与其他免疫细胞之间的关系。免疫细胞图包括25种不同类型的免疫细胞,包括经典活化巨噬细胞(M1)、替代性活化巨噬细胞(M2)和活跃的CD8+ T细胞。根据免疫图,HSPA5表达与膀胱癌(BLCA)、葡萄膜黑色素瘤(UVM)和乳腺癌(BRCA)的免疫细胞呈正相关,但与大多数胶质母细胞瘤(GBM)和甲状腺癌(THCA)的免疫细胞呈负相关。
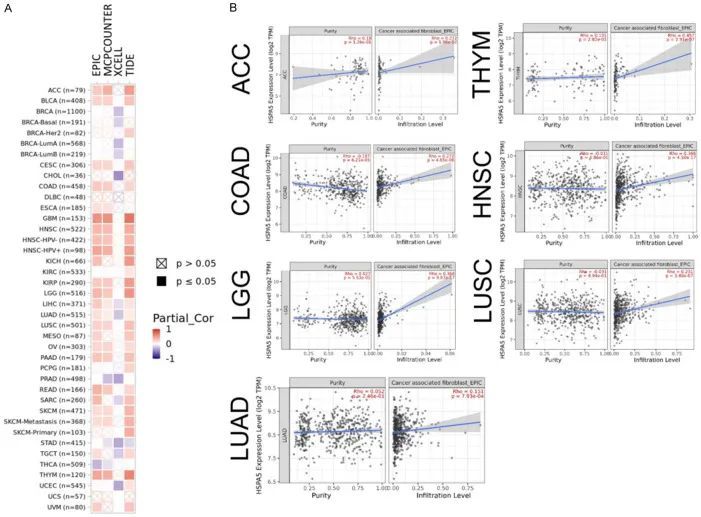
图7 癌相关成纤维细胞(CAFs)与免疫细胞浸润以及HSPA5表达之间的关系分析
在线平台SangerBox被用来研究HSPA5表达与免疫浸润评分之间的关系。大多数包括的肿瘤在免疫评分、基质评分和ESTIMATE评分上显示出显著变化(图8A)。在LGG + GBM组中,泛肾癌队列(KICH + KIRC + KIRP)、膀胱癌(BLCA)和HSPA5与ESTIMATE评分、基质评分和免疫评分呈正相关。相反,它与急性髓性白血病(LAML)、肺腺癌(LUAD)、前列腺癌(PRAD)、胃癌(STAD)、胃食管癌(STES)、甲状腺癌(THCA)和子宫内膜癌(UCEC)呈负相关(p值<0.05;图8B-D)。
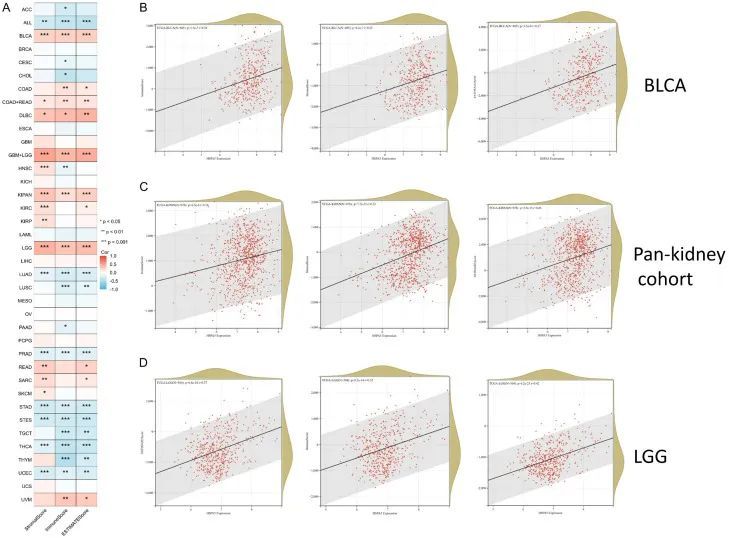
图8 HSPA5表达与免疫评分、基质评分和ESTIMATE评分之间的相关性分析
HSPA5在各种肿瘤中与大多数免疫检查点蛋白(ICPs)呈正相关,这一点可以通过ICP分析得到证实,包括UVM、OV、DLBC、BLCA、泛肾癌队列(KICH + KIRC + KIRP)、KIPAN、直肠腺癌(READ)、GBM + LGG、COAD、UCEC、THYM、LIHC、KIRC和KIRP。HSPA5与程序性细胞死亡蛋白-1(PDCD1,也称为PD-1)、CD152(细胞毒性T淋巴细胞相关蛋白4,通常称为CTLA4)和CD274在多种癌症中呈良好相关性,例如嗜铬细胞瘤和副神经节瘤(PCPG)、GBM、COAD和LIHC(也称为PD-L1)(图9)。单细胞数据显示,尽管HSPA5在不同细胞类型中的表达程度有所不同,但主要存在于免疫和恶性细胞中。HSPA5在胰腺导管腺癌(PDAC)、非小细胞肺癌(NSCLC)和GBM的恶性细胞中表达最高。
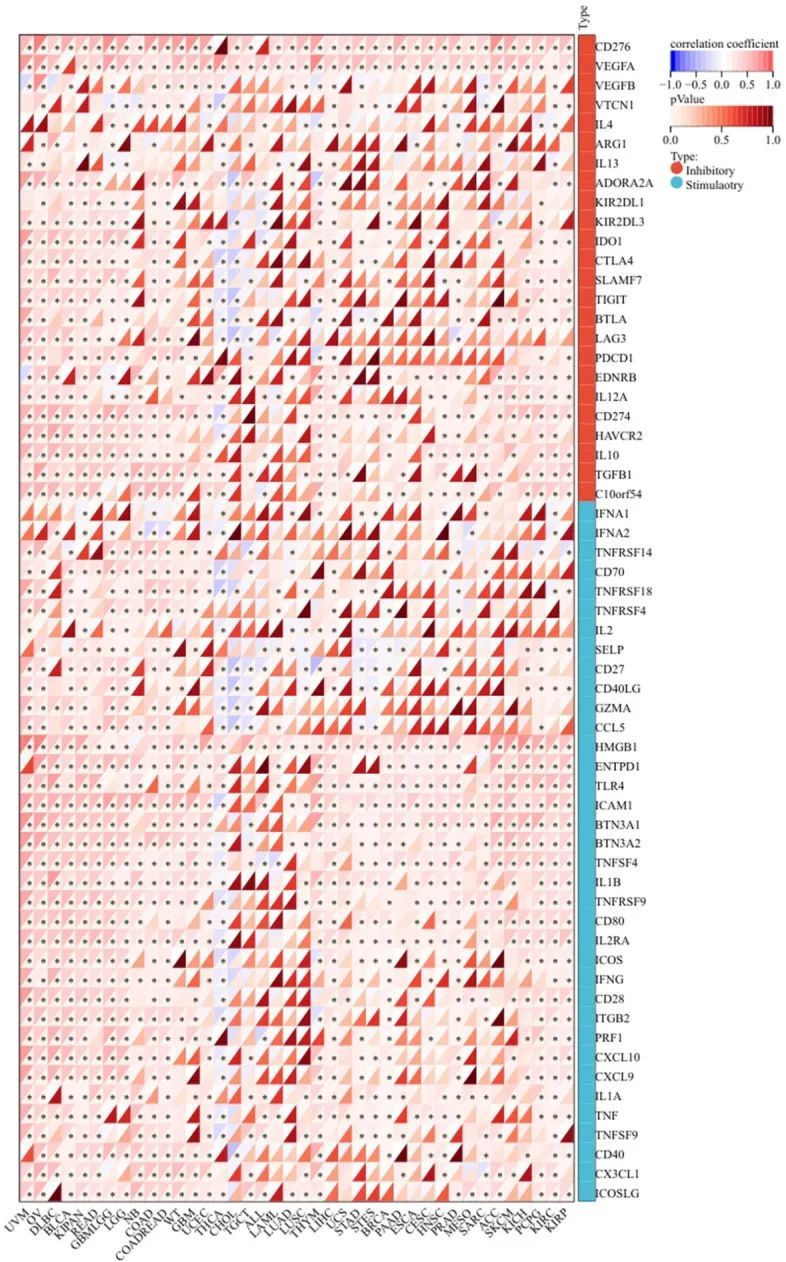
图9 免疫检查点(ICP)基因表达与HSPA5表达在某些癌症中相关
6. 实验验证
为了验证HSPA5在人类肿瘤组织中的表达以及其与免疫检查点蛋白的关系,作者验证了生物信息学预测。与非肿瘤乳腺和肝脏组织相比,作者观察到乳腺癌和肝癌患者的肿瘤组织中HSPA5和PD-L1的高表达(图10A)。作者使用免疫组化评分对结果进行了量化,发现在BRCA中,HSPA5的免疫组化评分为5.33,而PD-L1的评分为3.67。在对照组中,HSPA5的评分为1,PD-L1的评分为1.67。在LIHC组中,HSPA5的评分为6.33,PD-L1的评分为3.67;在对照组中,HSPA5的评分为2,PD-L1的评分为1.67(图10B)。作者的体外实验表明,敲除HSPA5会影响Hep3B细胞的增殖、侵袭和迁移能力。总之,实验结果与生物信息学预测基本一致。
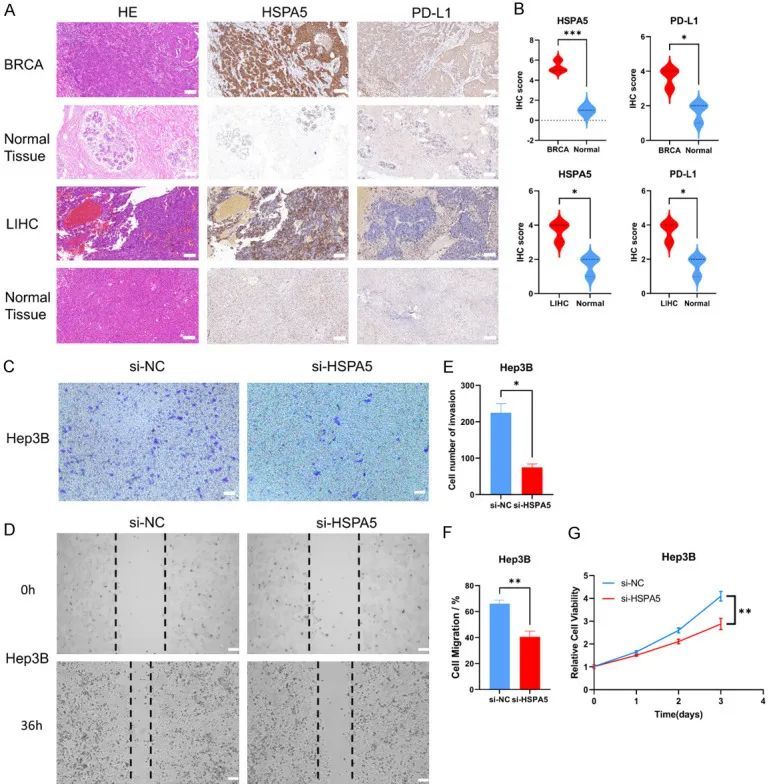
图10 高表达的HSPA5和PD-L1在BRCA和LIHC中
总结
作者的研究呈现了对HSPA5表达的泛癌分析结果。这项调查是首次将HSPA5表达、预后、KEGG通路和GO富集分析、免疫评分、基质评分、估计评分、CAF和免疫检查点结合起来进行研究。这些发现已经通过患者标本进行了验证。总之,作者的结果表明,在大多数研究的癌症中,HSPA5作为一个癌基因发挥作用。HSPA5的过度表达可能导致各种类型的癌症预后不良,并为HSPA5的预后作用及其可能参与肿瘤发展提供了新的见解。