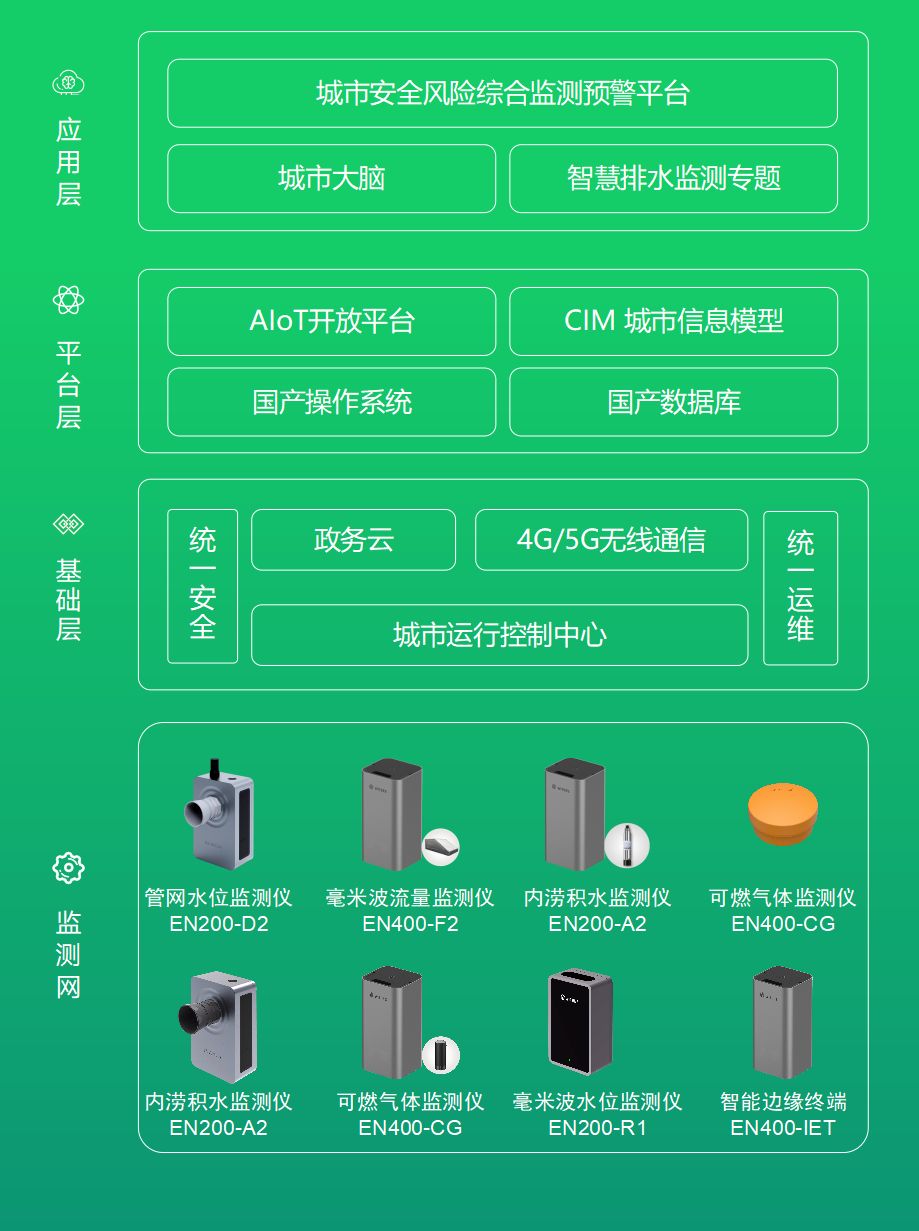
臻知识·专家访谈 | 第45期
抗血管生成药物贝伐珠单抗(A)和一代靶向药厄洛替尼(T)的联合,能够显著提高EGFR敏感突变(非T790M)NSCLC患者的PFS和5年生存率,延缓靶向药物的耐药。但不是所有患者都适合A+T治疗模式,优势人群的筛选对于治疗获益最大化至关重要,相关生物标志物值得探索。本期臻知识将结合近期发表于ESMO Open杂志上的文章进行解读。
EGFR突变是NSCLC的重要驱动基因,发生在约40%的亚洲NSCLC患者和10%-20%的欧美NSCLC患者中,而19号外显子缺失和21号外显子L858R突变是EGFR敏感突变的主要形式。NCCN指南对EGFR敏感突变阳性的NSCLC患者推荐EGFR-TKI单药或厄洛替尼联合雷莫芦单抗/贝伐单抗治疗,然而EGFR突变NSCLC是一种异质性肿瘤,不同EGFR突变对EGFR-TKI敏感性不同,且基因共突变的发生率很高,初始对EGFR-TKI响应的患者大多数在1-2年内出现耐药。为了明确耐药机制,指南建议患者再次活检并根据检测结果指导后续治疗决策制定。但重复活检患者依从性差,且肿瘤组织存在异质性,单一部位取样无法获得全面突变信息。基于外周血循环肿瘤DNA(ctDNA)的基因检测有望解决这些问题。
本文基于RELAY研究,入组的EGFR敏感突变mNSCLC患者随机分配到治疗组(厄洛替尼+雷莫芦单抗)和对照组(厄洛替尼+安慰剂),创新性使用二代测序(NGS)检测入组患者基线、治疗第4周期(C4)和疾病进展后的血液ctDNA样本,鉴别临床疗效相关基因变异,探寻ctDNA状态对治疗结局的影响。
研究发现基线ctDNA检出EGFR敏感突变(aEGFR+)的患者接受治疗后的PFS较短(aEGFR+: 12.7个月 vs aEGFR-: 22.0个月,HR= 1.87)。无论基线aEGFR是否有检出,治疗组比对照组的PFS显著延长。基线EGFR最常见的伴发突变基因是TP53 (43%)、 EGFR (其他突变,25%)和PIK3CA(10%)。C4-ctDNA检测EGFR突变清零的患者PFS更长 (14.1 vs 7.0个月,HR= 0.481)。无论aEGFR突变清除与否,治疗组的PFS均优于对照组。治疗后最常见的耐药突变包括EGFR(T790M占29%,其他突变占19%)、TP53(16%)等。
总而言之,本研究基于RELAY研究的ctDNA动态监测发现基线ctDNA中检出EGFR突变的患者PFS较差,疾病进展更快,可能从密切随访或强化治疗方案中获益。治疗初期ctDNA中 EGFR清零的患者PFS更长,同时发现基线携带伴发突变和继发耐药突变患者接受联合治疗的PFS长于单药治疗。这提示我们对于EGFR突变的NSCLC患者,基于ctDNA的NGS多基因检测能够帮助患者从分子层面探索和剖析更多影响治疗疗效或生存获益的分子标志物,辅助临床为患者制定精准用药策略,ctDNA动态监测还可助力肿瘤患者的全程管理。
摘要
RELAY研究证实雷莫芦单抗联合厄洛替尼(RAM+ERL)一线治疗EGFR敏感突变阳性转移性非小细胞肺癌(mNSCLC)患者的PFS显著优于接受安慰剂联合厄洛替尼(PBO+ERL)治疗的患者。本研究利用二代测序(NGS)技术评估RELAY研究中患者血浆ctDNA中的治疗相关基因突变与治疗后生存获益的相关性。结果发现基线ctDNA检出EGFR敏感突变(aEGFR)的患者mPFS明显缩短(12.7 vs 22.0个月,HR=1.87,95% CI 1.42-2.51),无论基线是否携带aEGFR突变和其它基因的共突变,RAM+ERL对比PBO+ERL方案治疗均可显著延长患者PFS。用药后第4周期采血检测ctDNA,发现aEGFR突变清除与患者mPFS延长相关(14.1 vs 7.0个月,HR=0.481,95% CI 0.33-0.71)。无论ctDNA中aEGFR突变是否得到清除,治疗组的PFS均优于对照组。监测aEGFR共突变和aEGFR突变清除情况有利于挖掘EGFR-TKI治疗的耐药机制,并筛选出可从强化治疗方案中获益的患者人群。
研究背景
EGFR敏感突变(aEGFR+)的mNSCLC患者可从EGFR-TKI治疗中获益,但最终不可避免出现耐药。引起患者疾病进展或复发的耐药机制可能是肿瘤出现治疗相关(TE)的基因突变。临床中二次活检肿瘤组织标本的可及性通常较差,而外周血ctDNA样本检测可克服这一难点。RELAY研究评估了雷莫芦单抗联合厄洛替尼(治疗组)对比安慰剂联合厄洛替尼(对照组)一线治疗EGFR突变mNSCLC患者中的疗效,发现治疗组临床结局显著优于对照组。本研究应用NGS检测RELAY研究中患者血浆ctDNA的基因突变和水平变化,旨在明确疗效预测因素及潜在耐药机制。
研究方法
入组患者均来自RELAY研究。患者以1:1比例随机分配至治疗组(雷莫芦单抗 10mg/kg 2周一次;厄洛替尼 150mg 每天口服)或对照组(安慰剂2周一次+厄洛替尼 150mg 每天口服),前瞻性收集患者基线、治疗第4周期和进展后液体活检样本进行NGS检测与分析。
研究结果
人群特征
RELAY研究中共入组449例患者。其中86%的患者基线ctDNA样本检出至少一种基因突变。治疗组进展或死亡风险显著低于对照组,且mPFS明显延长。
基线aEGFR ctDNA阳性与PFS缩短相关
所有入组患者均携带aEGFR。与基线ctDNA阴性患者相比,基线ctDNA检测aEGFR突变阳性的mPFS显著缩短(22.0月 vs 12.7月,HR=1.91, 95%CI 1.44-2.55)(图1A)。治疗组基线ctDNA阳性患者的mPFS较对照组患者延长(15.2月vs 11.1月,HR=0.63,95%CI 0.46-0.85)。而两组基线ctDNA阴性患者的mPFS趋势类似(22.1月vs 19.4月,HR=0.80,95%CI 0.49-1.30)(图1B)。
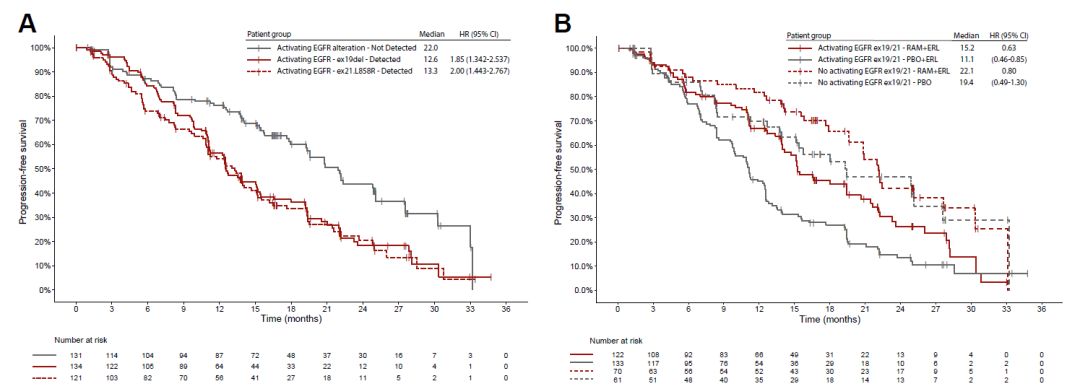
图1. 基线aEGFR突变ctDNA阳性/阴性患者的PFS曲线
基线aEGFR突变的共变异
基线ctDNA检出aEGFR突变的患者,88.2%同时检出共变异。共变异基因包括TP53、EGFR其他位点突变、PIK3CA突变(图2A、图2B)。基线ctDNA共突变患者的PFS劣于基线无共突变患者(12.5月vs 19.4月,HR=1.94,95%CI 1.19-3.14)(图2C)。在共突变频率最高的突变中亦如此(图2E、G、J)。无论基线是否存在共突变,治疗组患者相较对照组PFS均获益。(图2C、F、H、J)。
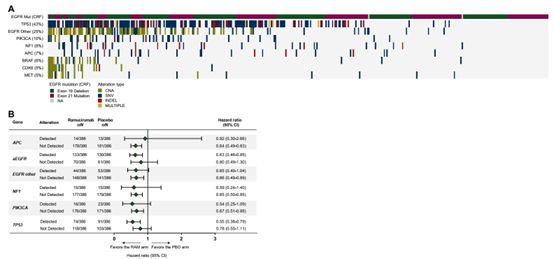
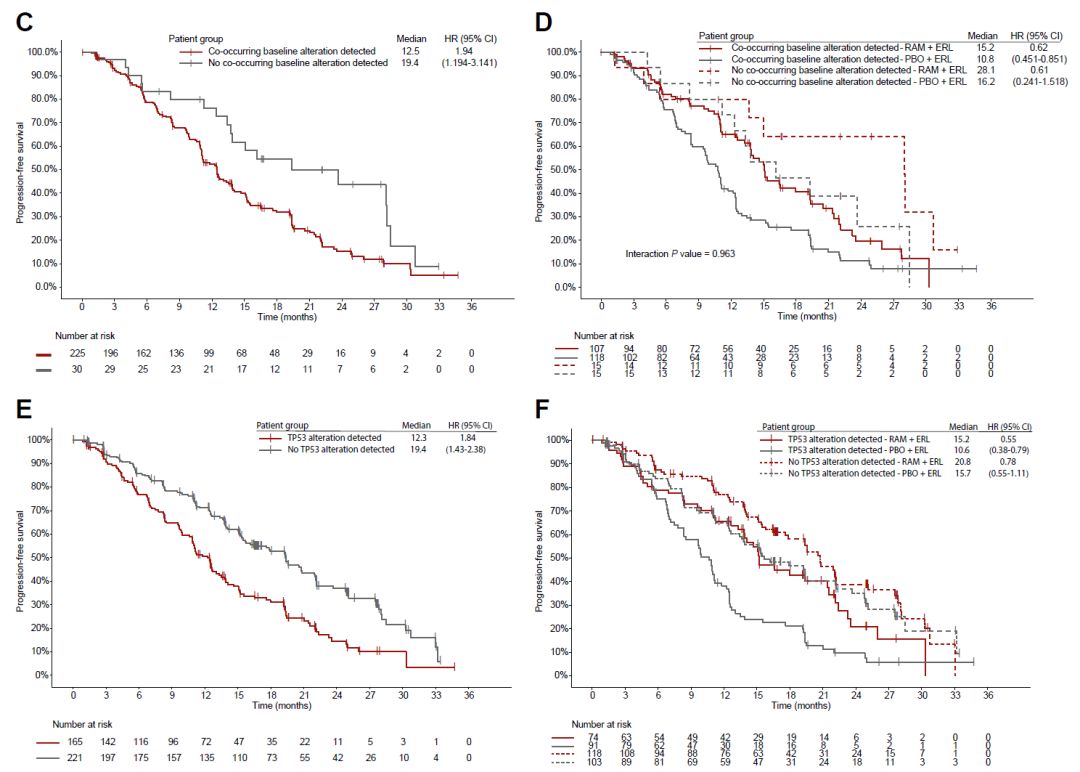
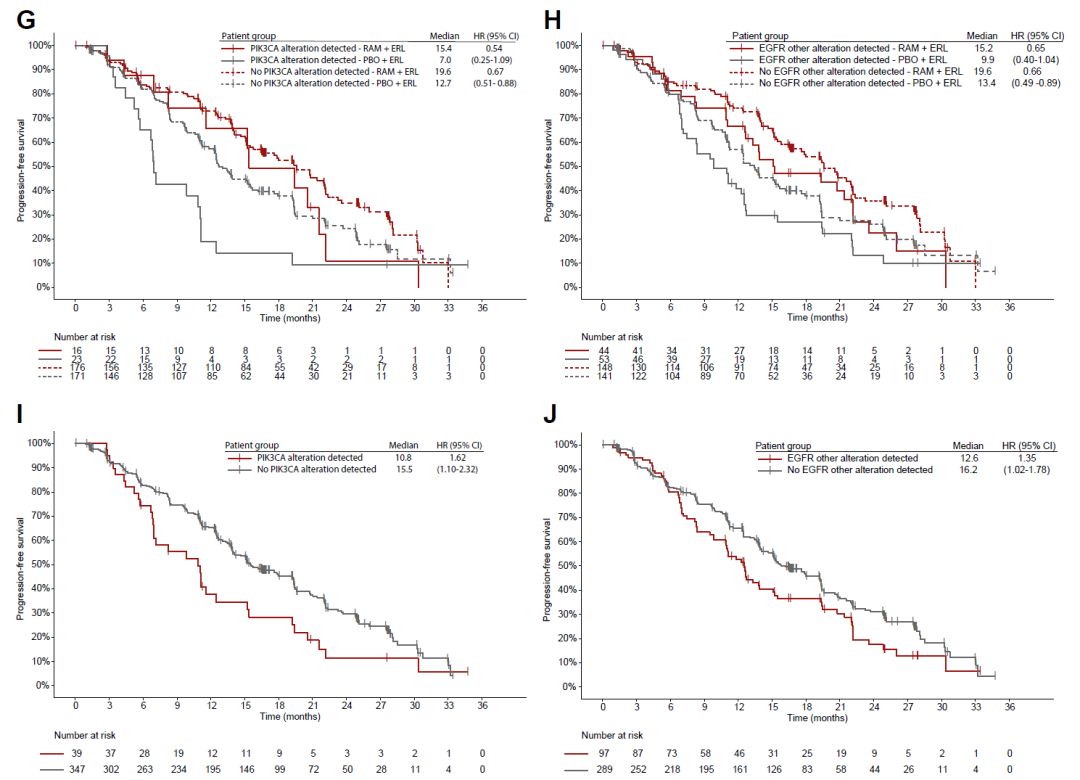
图2. 基线aEGFR共突变及其相关临床结局
EGFR ctDNA清除
207例患者基线ctDNA aEGFR阳性且C4时ctDNA至少检出一种基因突变。其中,79.2%患者C4时出现ctDNA aEGFR清除(图3A),mPFS较ctDNA aEGFR未清除者延长(14.1月vs 7.0月,HR=0.48,95%CI 0.33-0.71)(图3B)。无论ctDNA清除状态如何,治疗组患者相比对照组PFS均获益(图3C)。
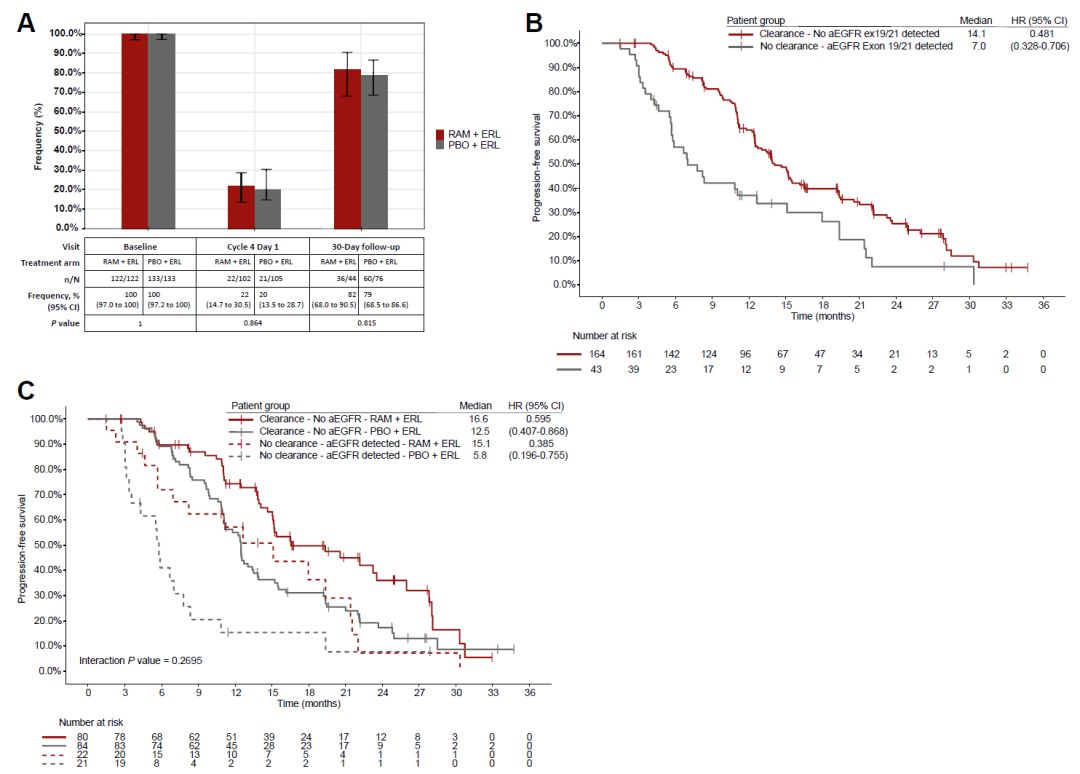
图3. aEGFR突变清除及其临床预后
TE基因突变及临床预后
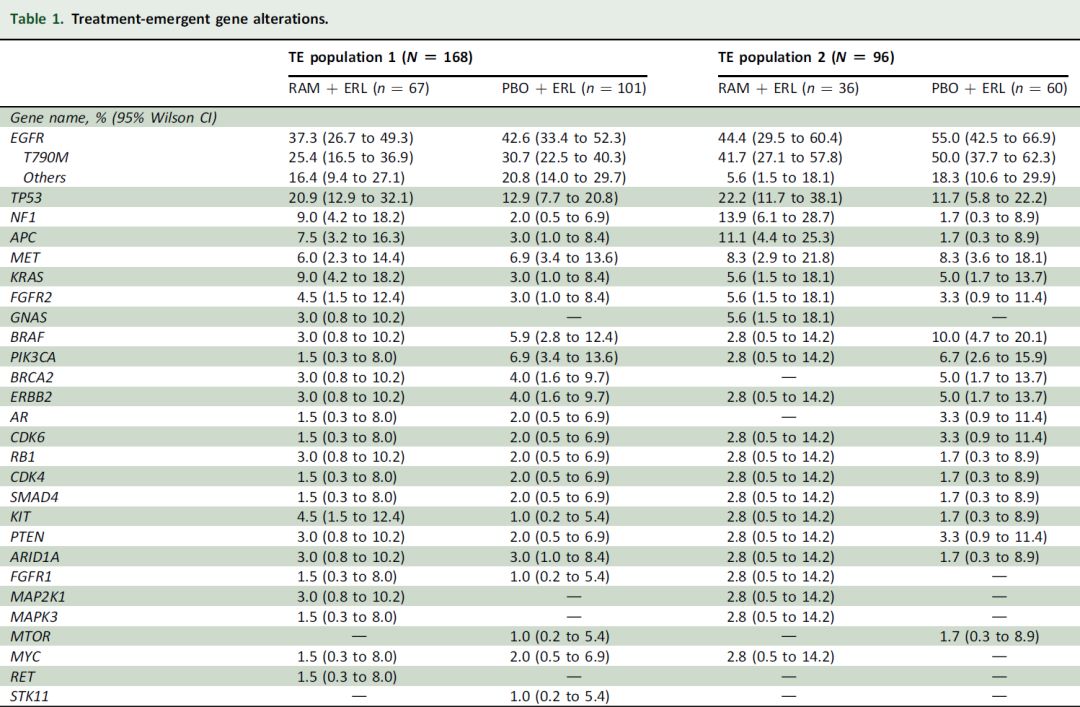
整体而言,治疗组及对照组中TE基因突变分布大致相似(表1)。最常见TE基因突变为EGFR T790M、EGFR其他突变、TP53、NF1及APC。T790M突变频率在两组间无显著差异(表1)。
表1.TE基因突变
讨论
III期RELAY研究中,与安慰剂联合厄洛替尼相比,雷莫芦单抗联合厄洛替尼一线治疗aEGFR突变晚期NSCLC患者(无脑转移)显示出较好的PFS。为进一步探寻治疗组临床获益及耐药的分子机制,本研究利用NGS动态检测REALY研究入组患者血浆ctDNA中aEGFR突变及基因组共突变情况,并探讨其对于治疗结局的影响。
在RELAY研究中,基线ctDNA aEGFR突变阴性与较好的mPFS相关,与其他文献报道相一致,表明基线aEGFR突变阳性可能为EGFR靶向治疗负性预后因子。可能由于此类患者肿瘤负荷较高,更倾向于快速出现疾病进展,并可从严密随访及高强度治疗方案中获益。
既往研究显示,基线存在共突变可能与较差的预后相关。RELAY研究中,基线检测中最常见的突变为TP53、其他EGFR突变以及PIK3CA突变。然而,无论基线是否存在共突变,患者均能从治疗组中得到获益。
对于基线ctDNA aEGFR突变阳性患者,若C4时出现ctDNA中 aEGFR突变得到清除,则mPFS更长。这与NEJ026研究结论相仿,突变清除与治疗组(贝伐珠单抗联合厄洛替尼)及对照组(厄洛替尼)的PFS延长均相关。基线EGFR突变阳性、治疗后6周EGFR清除患者从贝伐珠单抗联合厄洛替尼治疗中获益最大。
尽管样本量有限,但治疗组与对照组之间的基线共突变及TE突变的类型和频率相似。并且在厄洛替尼治疗基础上联合雷莫芦单抗并未对TE基因突变或治疗耐药谱产生影响。值得注意的是,既往有文献报道提示血浆ctDNA检测EGFR T790M的敏感性低于组织检测,因此疾病进展时T790M突变发生率可能较本文报道数值更高,因此需要对阴性血浆结果进行组织学样本再次确认。最常见的治疗相关基因突变为EGFR(尤其是T790M)和TP53突变。
参考文献:
Ramucirumab plus erlotinib versus placebo plus erlotinib in previously untreated EGFR-mutated metastatic non-small-cell lung cancer (RELAY): exploratory analysis of next-generation sequencing results.