自SARS-CoV-2病毒引发的COVID-19大流行暴发以来,研究人员一直致力于探索为何该病毒相较于其他冠状病毒,会引发如此严重和长期的影响。近期,费城儿童医院(CHOP)团队和COVID-19国际研究小组(COV-IRT)合作发现,新冠病毒对线粒体(人体细胞的能量工厂)基因产生不良影响,进而导致肺部之外的多器官发生功能障碍。该研究成果于2023年8月9日发表于《Science Translational Medicine》(IF2022=17.1)杂志,开创了治疗COVID-19的新思路。

线粒体是人体各类细胞的重要组成部分。负责生成线粒体的基因分布在细胞核的DNA以及线粒体内部的线粒体DNA(mtDNA)中。早期研究表明,SARS-CoV-2蛋白可与宿主细胞的线粒体蛋白相结合,进而导致线粒体功能失调。
CHOP线粒体和表观遗传医学中心(CMEM)的研究人员以及其COV-IRT同事试图通过分析病毒引起的线粒体基因表达差异,来深入探索SARS-CoV-2如何影响线粒体的功能。他们分析了一系列来自新冠感染患者以及动物模型的鼻咽和尸检组织的样本数据。
CHOP CMEM的博士后研究员Joseph Guarnieri博士,该研究的第一作者说:"人类患者的组织样本使我们能够观察到疾病进展初期和晚期时线粒体基因表达的变化,而动物模型则帮助我们了解这一变化过程中的细节。"
研究发现,在尸检组织中, 尽管肺部线粒体基因表达已恢复,但在心脏以及肾脏和肝脏组织中,线粒体功能仍受抑制。在研究动物模型并测量病毒载量在肺部达到峰值时,发现即使在大脑中未检测到SARS-CoV-2,但在小脑中,线粒体基因表达被抑制。其他的动物模型显示,在SARS-CoV-2感染的中期,肺部的线粒体功能开始恢复。
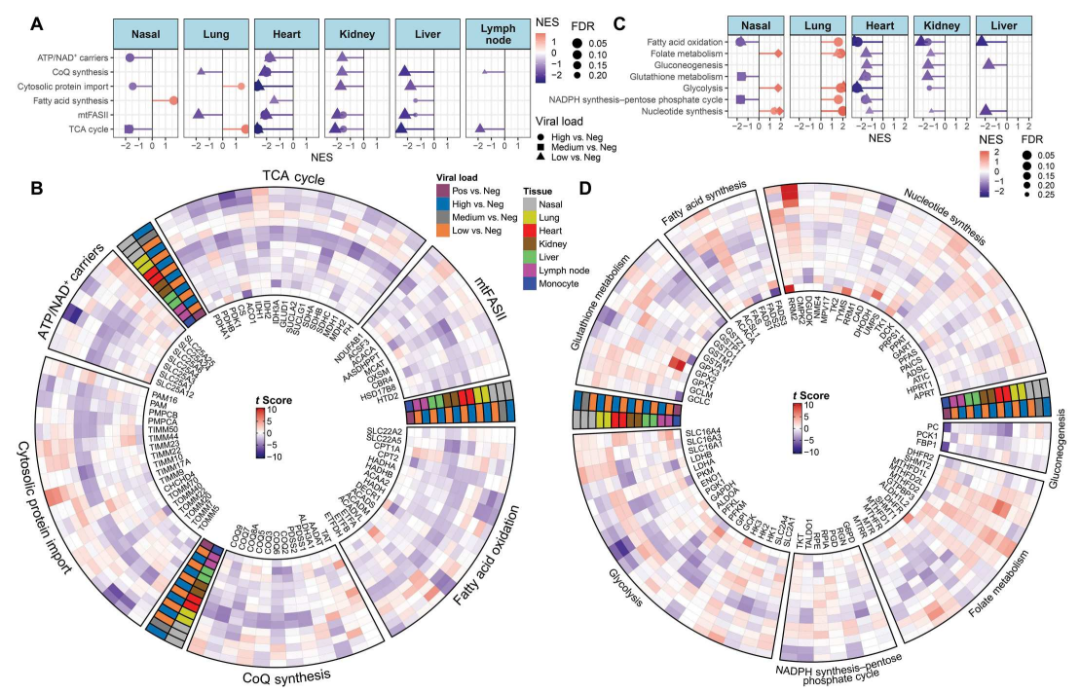
COVID-19患者鼻咽和尸检样本中的线粒体和细胞质生物能供给途径基因表达
以上结果揭示了一个重要的事实,即使宿主细胞对初始感染的响应发生在肺部,但随时间推移,肺部的线粒体功能得以恢复,而在其他器官,尤其是心脏,线粒体功能仍然受损。
"这项研究为我们提供了强有力的证据,我们不应再将COVID-19仅视为上呼吸道疾病,而应开始将其视为影响多个器官的系统性疾病。" CHOP CMEM主任Douglas C. Wallace博士说,“我们的发现揭示了线粒体功能在COVID-19的病理过程中的重要性,为开发新的治疗策略提供了方向。”
这项研究拓宽了我们对COVID-19影响的理解,尤其是其对人体多器官的影响。然而,研究者也指出,虽然这项研究提供了关于SARS-CoV-2如何影响线粒体功能的新见解,但仍需要进一步的研究来确定这些发现对于治疗和预防COVID-19的具体含义。
这项研究的发现,也许会对如何治疗和预防COVID-19产生深远影响。例如,如果医生可以找到一种方法来恢复或保护线粒体功能,那么可能就可以减少COVID-19对多器官的影响,从而改善患者的预后。
此外,研究人员还发现microRNA 2392 (miR-2392) 是一个潜在的治疗靶点,研究表明miR2392可调节线粒体功能。
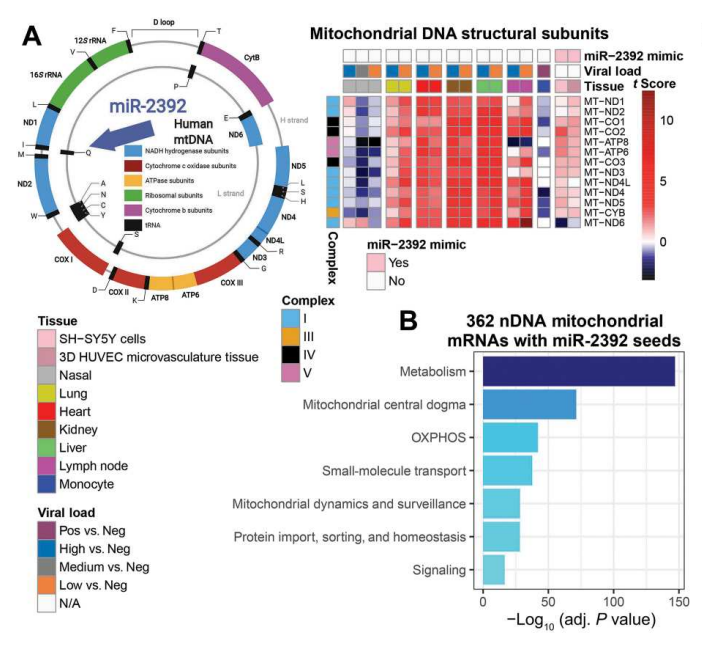
(A)左图:显示人类mtDNA的基因图,显示H链和L链启动子以及MT-TQ tRNAGln基因中的潜在miR-2392结合位点。(A)右图:比较COVID-19阳性或COVID-19阴性患者的鼻咽和尸检样本中的mtDNA转录本(即t分数),以及在3D HUVEC-MT细胞和SH-SY5Y细胞中miR-2392模拟处理与未处理细胞之间的效应。(B)统计学显著性或nDNA编码的线粒体通路基因中miR-2392种子序列的存在, 通过−log10(adj. P值)来指示。
“该microRNA在SARS-CoV-2感染患者的血液中上调,通常这并非是我们期望看到的,”生物统计学家、博德研究所的访问研究员,COV-IRT的创始人兼总裁Afshin Beheshti博士说。“中和这种microRNA可能会阻止病毒的复制,可为存在与该疾病相关的更严重并发症风险的患者提供额外的治疗选择。
今年早些时候,盖茨基金会向Wallace博士和CMEM提供了资金,用于研究世界人群中的mtDNA变异如何影响线粒体功能,从而影响个体对SARS-CoV-2的敏感性。根据Wallace博士的说法,SARS-CoV-2显著影响线粒体功能的论证支持了线粒体功能的个体差异可能是COVID-19个体严重程度的一个因素的假设。

SARS-CoV-2需利用宿主细胞产生病毒复制和传播所需的分子。Guarnieri等人的研究结果显示,该病毒能够阻断核编码和线粒体编码的线粒体基因的表达,导致宿主线粒体功能受损。他们分析了来自COVID-19患者的人类鼻咽样本和尸检组织,以及感染SARS-CoV-2的仓鼠和小鼠的组织的样本数据。结果发现,宿主细胞试图通过激活先天免疫防御和线粒体基因表达来进行补偿,但长期的线粒体功能受损最终可能导致严重的COVID-19后遗症,如器官衰竭。

新型冠状病毒2(SARS-CoV-2)的病毒蛋白质与宿主线粒体蛋白质结合,可能会抑制氧化磷酸化(OXPHOS)并促进糖酵解。我们分析了2019冠状病毒病(COVID-19)患者的鼻咽和尸检组织中的线粒体基因表达。在鼻咽样本中,随着病毒滴度下降,病毒会抑制一部分编码线粒体OXPHOS基因的核DNA(nDNA)的转录,诱导microRNA 2392表达,激活HIF-1α诱导糖酵解,并激活宿主免疫防御包括综合应激反应。在COVID-19患者的尸检组织中,SARS-CoV-2不复存在,肺部的线粒体基因转录已经恢复。然而,在心脏的尸检组织中以及在较小程度上在肾脏和肝脏中,nDNA线粒体基因的表达仍然受到抑制,而线粒体DNA的转录被诱导,并且激活了宿主免疫防御途径。在仓鼠早期SARS-CoV-2感染时,肺部的病毒载量达到峰值,肺部的线粒体基因表达基本不受干扰,即使在大脑中未检测到SARS-CoV-2,但小脑的线粒体基因表达受到抑制,而纹状体的表达则上调。在小鼠中期SARS-CoV-2感染期间,小鼠肺部的线粒体基因表达开始恢复。这些数据表明,在病毒滴度首次达到峰值时,会出现全身性的宿主反应,随后病毒会抑制线粒体基因转录并诱导糖酵解,从而引发抗病毒免疫防御。即使病毒被清除,肺部线粒体功能已经恢复,但心脏、肾脏、肝脏和淋巴结中的线粒体功能仍然受损,可能导致严重的COVID-19病理变化。
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习