哈佛大学和麻省理工学院近期发表了“High-throughput RNA isoform sequencing using programmable cDNA concatenation.”研究论文中,将 cDNA 串联成可用于长读长测序最佳的单分子的技术应用于肿瘤浸润 T 细胞的单细胞 RNA 测序,提高了寻找可变剪接基因的准确度,验证了 T 细胞中典型的 PTPRC 剪接模式和相关 hnRNPLL 剪接因子的协同表达。

发表时间:2021
样本类型:肿瘤浸润性T细胞
客户单位:哈佛大学和麻省理工学院
一、研究背景
可变剪接是真核生物转录本成熟过程中通过差异外显子和(或)UTR剪接调节蛋白质结构、表达和定位的核心调控过程,使用三代全长RNA测序能够捕获完整的转录本同源异构体。基于单细胞分辨率下RNA同源异构体的精确量化仍然是一个严峻的挑战,MAS-ISO-seq技术通过程序性串联cDNA成单分子,可能在精确量化方面优于Pacbio测序技术。
二、实验设计
使用合成RNA同源异构体库验证了MAS ISO序列的可以明确同源异构体分配,并将此方法应用于肿瘤浸润性T细胞的单细胞RNA序列测定。

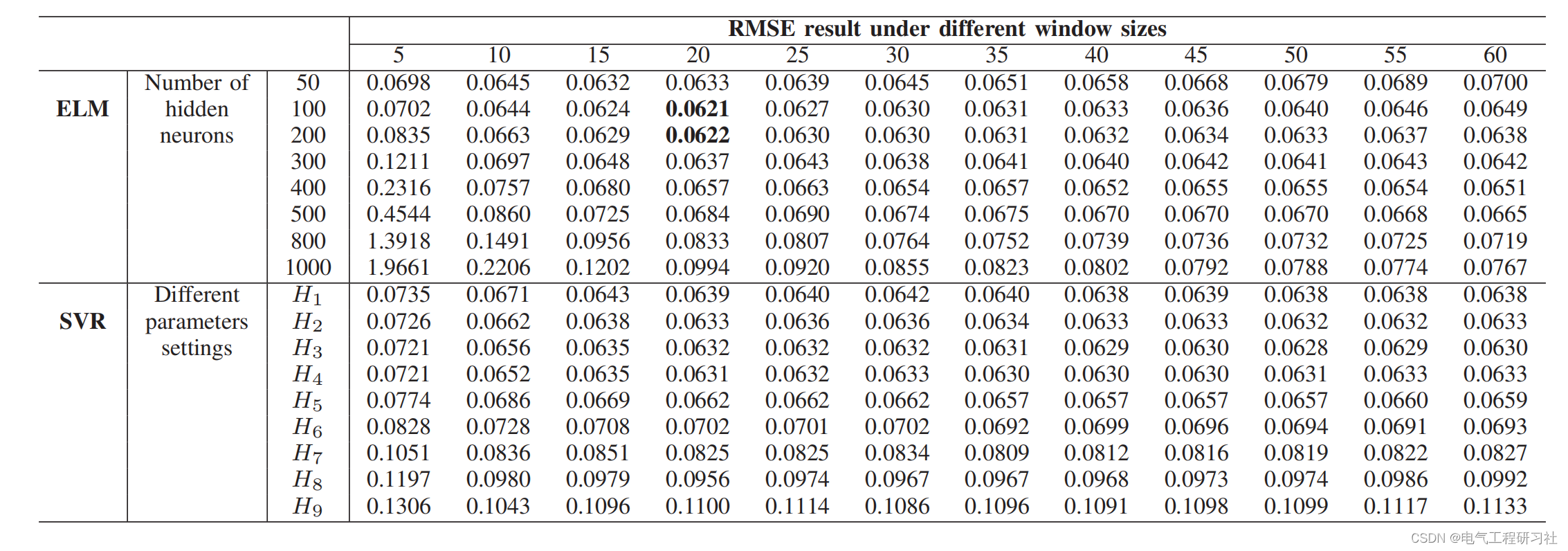
图 测序方法的读长和通量示意图
三、主要结果
二代测序平台(例如Illumina)实现了高通量(>1x109reads),但读长(50-600 bp)阻碍了它的发展,因为这些读长不足以跨越大多数人类转录本(1.6±1.1 kb)。二代测序的短读通常无法跨越连续的剪接位点,从而影响了正确识别转录同源异构体。三代平台Oxford Nanopore(ONT)和PacBio能够实现全长RNA同源异构体测序,但其通量相对较低,成本较高且Sequel IIe仪器的CCS序列达到~10循环的最佳文库大小为15-20 kb,由于转录本长度(单个转录本的平均长度为100bp-5kb)短于文库大小,会造成一些循环的浪费。
MAS-ISO-seq开创性的将 cDNA 均分成 15 份,每份的两端分别连接带有 U 的不同小片段,后续通过粘性末端互补配对将不同文库的相同末端片段首尾连接,实现了 15 个不同 cDNA 分子随机有方向的串联,大大增加了上机测序的最终 cDNA 长度和最终有效全长转录本的产出。由于极大的提高了测序产出和完整性,此方案可以在三代测序上直接实现基于定量和结构上的同时分析,从而实现精确测序和PacBio平台更优化的利用率。结合通过链亲和素/生物素选择上游消除TSO引物,MAS-ISO-seq将测序量提高到每个 Cell 约4000万全长转录本,比CCS校正的reads增加了15倍以上(图1b)。
Lexogen SIRV-Set 4是一种合成的加标 RNA 异构体 (SIRVs) 混合物,对Lexogen SIRV Set 4进行了全长RNA测序,以比较二代测序得到的同源异构体和高通量长读测序方法异同,特别指出ERCC 结果两种方案之间总体上大致相似。MAS-ISO-seq和ISO seq与Smart-seq3方法相比,MAS-ISO-seq序列直接识别转录同源异构体,获得的同源异构体分配几乎无错误(图1f)。
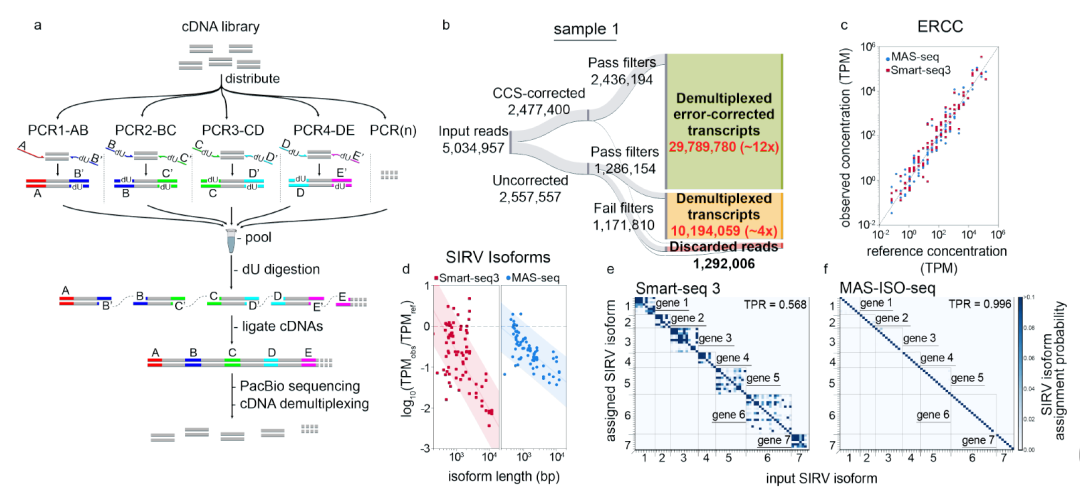
图1 MAS-ISO-seq工作流和使用合成RNA同源异构体的实验验证
为了验证MAS-ISO-seq,使用cDNA文库进行测试,即对肿瘤浸润的CD8 + T细胞进行了10x Genomics 5’端单细胞测序,其中获得了6260个CD8 + T细胞,尽管二代和三代方法和定量方法在测序深度上存在较大差异,但细胞聚类和基因表达高度一致(图2)。利用T细胞分化过程中CD45(PTPRC)的不同剪接模式,使用 CITE-seq 在蛋白质水平上对CD45同源异构体表达进行了正交验证,并将其与MAS-ISO-seq测量的mRNA水平进行了比较。这两种模式之间的CD45亚形表达高度一致(图2c)。拟时序分析揭示了 T 细胞状态的连续统一性,从干细胞样到活化再到终末分化。清晰的追踪到了典型的 CD45 亚型表达及其相关的剪接因子 hnRNPLL11 沿着这一分化的轨迹(图2d-f)。为了量化MAS-ISO-seq的测序深度对细胞分型和差异剪接基因鉴定的影响,通过ARI电子下采样分析确定了每个数据集T细胞同源异构体中差异剪接基因的数量,识别到差异剪接基因增加了34倍(图2g)。

图2 用MAS-ISO-seq对人CD8+T细胞进行单细胞同源异构体测序
四、研究结论
MAS-ISO-seq 是一种程序化串联cDNA并进行长读段测序的单分子技术,与Sequel IIe 测序仪相比可以将通量提高15倍以上。使用已知的同源异构体文库用 MAS-ISO-seq 验证了其准确性,并将这种方法应用于肿瘤浸润 T 细胞的单细胞 RNA 测序。结果表明,可以准确发现差异剪接基因和典型的 PTPRC 剪接模式相关 hnRNPLL 剪接因子。MAS-ISO-seq 等方法将推动同源异构体的发现和从基因表达到转录亚型表达分析的转变。
参考文献
High-throughput RNA isoform sequencing using programmable cDNA concatenation. 2021.



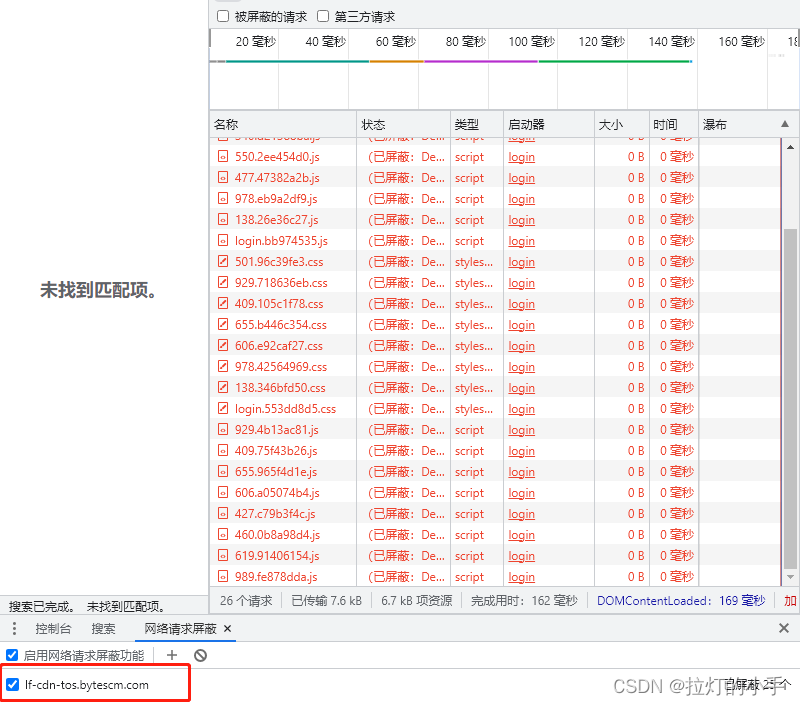

![[附源码]计算机毕业设计付费自习室管理小程序Springboot程序](https://img-blog.csdnimg.cn/1cee4fd785f546eb92e20b403a2a4b4d.png)