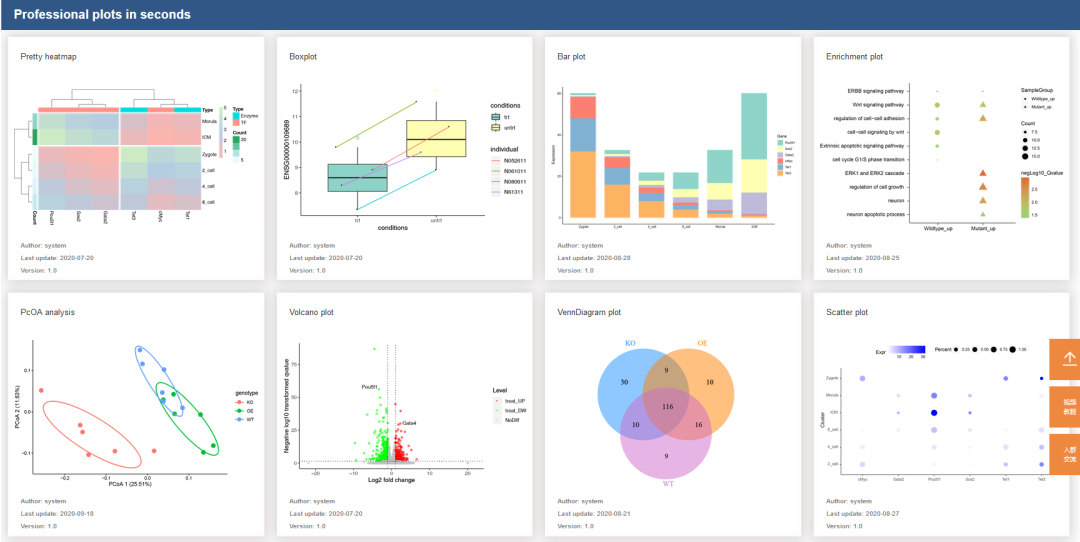
在疫苗学中,基于mRNA向体内递送抗原编码基因同基于纳米颗粒向体内递送抗原在应对具有挑战性的病原体方面都显示出巨大的前景。本期的《Cell》中,Hoffmann等人将两种方法相结合,通过调节被许多病毒劫持的相同细胞代谢通路来增强SARS-CoV-2疫苗接种的免疫反应。
SARS-CoV-2的出现和随之而来的COVID-19大流行使基于mRNA的疫苗平台以惊人的速度进入常规临床使用。批准的mRNA疫苗针对SARS-CoV-2的Spike(S)蛋白,并刺激高水平的中和抗体(这与预防感染有关)。mRNA疫苗兴起源于其针对棘手的病原体的产生更有效的疫苗。由于mRNA疫苗可促进病毒状糖蛋白在细胞表面的表达,因此不需要改变病毒抗原的膜结合区域以使病毒蛋白可溶,从而避免了蛋白质稳定性问题或引入稳定结构域的需求。因此,mRNA疫苗在很大程度上避免了定制生产工作流程的长期优化(这可能会阻碍传统蛋白质疫苗的开发),加速了针对新兴病原体的疫苗开发。mRNA疫苗也可以以传统基于蛋白质的疫苗无法做到的方式参与细胞毒性T细胞反应,因为病毒抗原的翻译会产生免疫原肽,这些肽可以通过内源性抗原呈现途径来呈现。最后,mRNA疫苗编码的基因可以更新,以匹配循环菌株,这是针对流感病毒和SARS-CoV-2等快速进化的RNA病毒提供持续保护的目标的一个重要特征。
除了基于mRNA的疫苗平台外,另一项有前景的疫苗创新已用于开发越来越多的方法,试图模仿完整病毒的自然结构,在有序的多聚体阵列中显示病毒抗原。例如,病毒样颗粒(VLPs)被病毒抗原覆盖,但没有传染性,已成功用于人类乳头瘤病毒的疫苗。一种相关的方法,蛋白质纳米颗粒(NPs),利用具有抗原结合位点的自组装蛋白(self-assembling proteins),从而在NP表面上有序展示抗原。通过模仿病毒表面多次重复的蛋白质结构,VLPs和NPs通过最大程度地激活B细胞来诱导高滴度的保护性抗体进而改善免疫反应。例如,一种基于NP的SARS-CoV-2 S疫苗可以诱导高水平的中和抗体。此外,利用NP展示系统可以在同一颗粒上展示多个抗原不同的病毒糖蛋白。这些“马赛克” NP已被证明擅长诱导广泛的交叉反应抗体应答,这是疫苗设计的主要目标。
霍夫曼等人着手将mRNA和基于纳米颗粒的疫苗的优势结合起来。理论上,将mRNA疫苗平台的模块化功能与基于NP的疫苗的强免疫原性相结合将是有益的。在实践中,这说起来容易做起来难。许多NP展示平台涉及多个可自组装至NP的蛋白质,且需要在体内共表达几种不同的蛋白质。利用mRNA-脂质纳米颗粒将所有编码基因传递到同一个细胞是一项艰巨的任务。然而,Hoffmann等人巧妙地重新利用了一些病毒从受感染细胞中发芽的细胞途径,并创建了一种新的疫苗平台,该平台融合了mRNA和基于NP的疫苗的理想特征。运输所需的内体分选复合物(ESCRT)是一组蛋白质,在细胞过程(cellular process)中驱动膜萌芽(如多囊泡体的形成)。为了利用ESCRT机制,作者在SARS-CoV-2 S的细胞质尾部中添加了一段短序列(多短?),有助于与TSG101和ALIX(这是两种参与将ESCRT复合物招募到出芽部位的蛋白质)的相互作用。该序列被称为ESCRT和ALIX结合区(EABR),EABR可在细胞膜上招募宿主ESCRT蛋白到S蛋白。这最终导致带有S糖蛋白的包膜VLP(eVLP)的自我组装和出芽(图1)。在找到最优EABR序列后,作者证明了S-EABR结构的表达足以在体外产生eVLP。利用优化的S-EABR载体进行体外表达,产生eVLP,接种纯化后的eVLP的小鼠体内产生了高水平的中和抗体,且eVLP的免疫原性与基于NP的蛋白质疫苗相当。
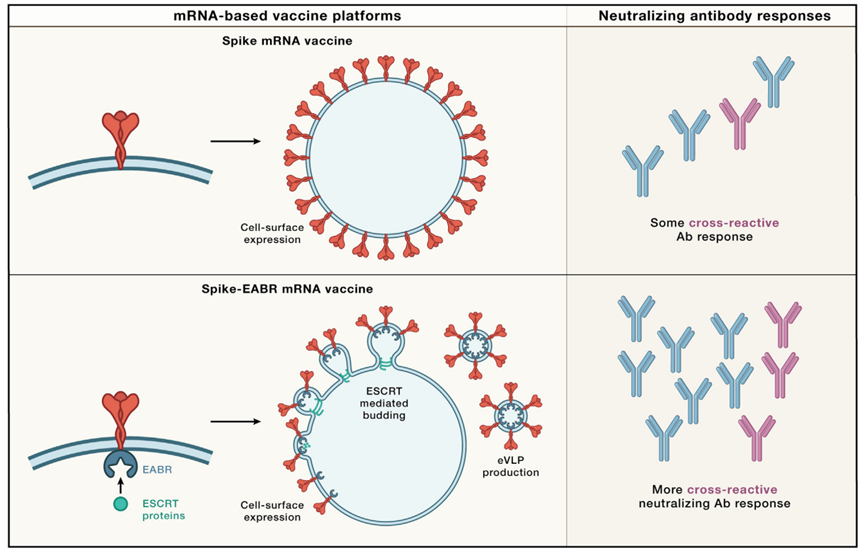
图1 ESCRT介导的eVLP产生可在SARS-CoV-2 mRNA免疫接种后引发增强的免疫反应 通过mRNA介导的膜结合型SARS-CoV-2 S蛋白传递可实现在细胞膜表面表达(图上半部分),而经EABR修饰的S蛋白的mRNA(图下半部分)可在细胞膜表面表达和释放,从而引发增强的免疫反应。
在展示了S-EABR载体在体外产生免疫原性eVLP的潜力后,作者评估了S-EABR mRNA疫苗的有效性。在一系列实验中证明,与接种S-EABR mRNA免疫方案(经批准的人类mRNA疫苗的类似物)的小鼠相比,接种S-EABR mRNA疫苗的小鼠体内会产生更强的中和抗体反应。除了诱导抗体数量多外,还观察到S-EABR疫苗的多克隆抗体反应范围更广,包括对SARS-CoV-2 Omi-cron变体BA.1和BA.2可产生更强的中和反应。重要的是,虽然接种S-EABR疫苗的小鼠对Omicron变体的中和效力大大降低,但与仅注射S的mRNA疫苗小鼠相比,接种S-EABR疫苗的小鼠保留了8到10倍的中和滴度。鉴于SARS-CoV-2的持续流传和抗原进化,中和抗体广度方面的这些改进可能会转化为评价疫苗有效性的有意义的改善。eVLP免疫和仅S型mRNA免疫接种相比,S-EABR mRNA方法引起的T细胞反应也有较小但显著的增加。
Hoffmann及其同事开发的新疫苗策略结合了mRNA的疫苗的灵活性和快速性以及VLP和NP平台的卓越免疫性,该策略将应用于其他病原体。尽管作者表明,将EABR纳入HIV的包膜蛋白也会产生稳健的eVLP,但有些病毒(如流感病毒)具有多种糖蛋白,这些糖蛋白在附着(血凝素)和从受感染细胞释放(神经氨酸酶)中发挥作用。仍需要了解这些蛋白质与基于EABR的eVLP平台的兼容性,以及这些具有EABR结构域的蛋白质表达是否会引起eVLP的产生。正如作者所指出的,重要的免疫学问题仍然没有答案,例如在S-EABR疫苗接种中观察到的交叉反应性是否是由于更有效地引导抗体靶向保守位点。虽然Hoffmann和同事仅用了单一抗原,但eVLP系统也可以应用于含有多种抗原的mRNA疫苗。最近的研究表明,基于20种不同流感病毒血凝蛋白mRNA的递送可以诱导对不同流感病毒株的广泛保护。将编码不同抗原的多价mRNA疫苗与eVLP方法相结合,可能会进一步增强保护性免疫反应。Hoffmann等人的工作为疫苗设计领域带来了新思路。

针对COVID-19疫苗的主剂-增强剂方案对Omicron变异株产生较差的抗体反应,并采用频繁的增强剂来维持抗体水平。我们提出了一种模拟自然感染的技术,通过编码自组装的包膜病毒样颗粒(eVLP),该技术结合了mRNA和蛋白纳米颗粒疫苗的特点。通过在SARS-CoV-2刺突蛋白(spike)细胞质尾部插入ESCRT和ALIX结合区域(EABR),实现了eVLP的组装,该区域能够招募ESCRT蛋白从而诱导eVLP从细胞中分离。纯化的刺突蛋白-EABR eVLP呈现密集排列的刺突,并在小鼠中引发了强效的抗体反应。两次使用编码刺突蛋白-EABR的mRNA-LNP免疫可引发强效的CD8+ T细胞反应,并与传统刺突蛋白编码的mRNA-LNP相比,纯化的刺突蛋白-EABR eVLP在对原始和变异SARS-CoV-2的中和抗体反应方面均表现出优势,提高了对Omicron变异株的中和滴度(>10倍),持续时间为接种后的3个月。因此,EABR技术通过在细胞表面和eVLP上呈现抗原,增强了疫苗诱导的免疫反应的效力和广度,从而实现对SARS-CoV-2和其他病毒的持久性抵御。
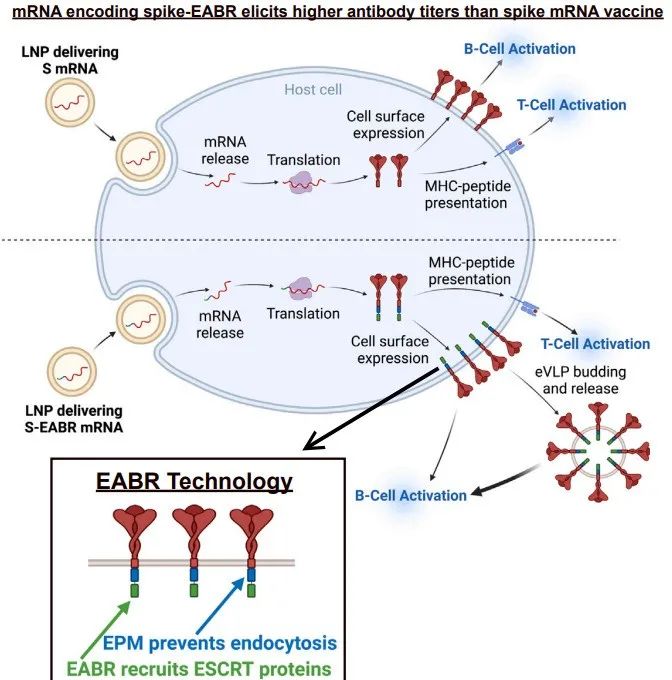
通过在SARS-CoV-2刺突蛋白的细胞质尾部添加EABR序列,以招募ESCRT蛋白,从而诱导包膜病毒样颗粒的组装。与传统的mRNA疫苗相比,编码刺突蛋白-EABR的COVID-19 mRNA疫苗在小鼠中引发更高效的抗体反应。
亮点:
EABR技术通过改造膜蛋白诱导包膜VLP的组装。
SARS-CoV-2刺突蛋白-EABR eVLPs以基因编码的形式通过mRNA疫苗传递。
Spike-EABR mRNA在小鼠中引发的抗体滴度高于传统的刺突蛋白mRNA。
Spike-EABR mRNA对Omicron变异株引发强效的抗体反应。
查看原文内容:
https://doi.org/10.1016/j.cell.2023.04.034
https://doi.org/10.1016/j.cell.2023.04.024
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习