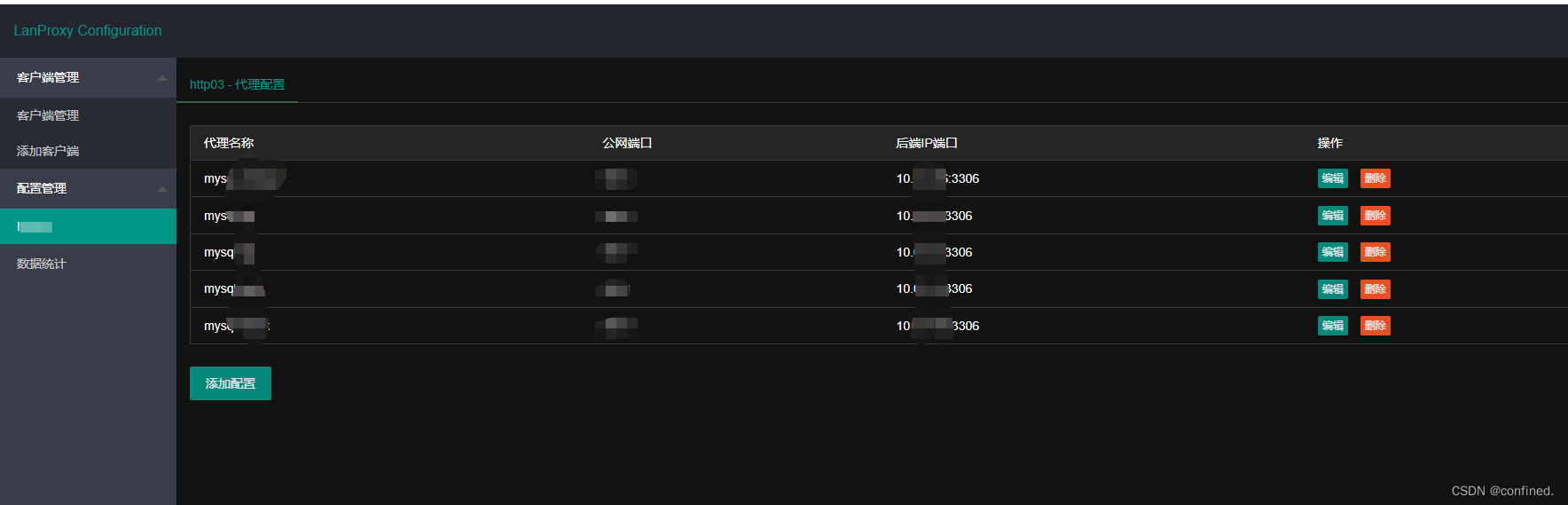
谷禾健康

我们的身体中有很多不同的器官,组织,腺体等会产生许多信号分子来精确控制和影响身体的反应和活动,这些信号分子包括激素、神经递质、生长因子、细胞因子等。它们可以促进或抑制细胞的生长和分化,调节细胞间的相互作用和通讯,影响身体的代谢和能量平衡,参与免疫系统的细胞和分子相互作用,调节身体的内环境和外环境的适应性等。
其中,激素是一类重要的生物活性物质,也可以说是信号分子,一般由特定的内分泌细胞,腺体或器官所产生,包括性激素、脂质激素、蛋白质激素、胰岛素、甲状腺激素、肾上腺素和去甲肾上腺素等。
这其中性激素是一类重要的激素,主要由生殖腺(如卵巢、睾丸)和肾上腺产生,包括雌激素、孕激素和雄激素等。它们在生殖系统中发挥重要作用,对女性月经周期、妊娠、分娩、哺乳等过程起调节作用,对男性性发育、精液生成、性欲等方面也具有重要影响。此外,性激素还与骨密度、心血管健康、认知能力等方面有关。
临床上性激素六项是生殖内分泌门诊常用的检查。性激素六项检查主要用于评估男女生殖内分泌功能,对月经失调、性功能障碍、不孕不育、生殖系统肿瘤、性染色体病等的鉴别和诊断及内分泌治疗的效果检测都具有重要的临床意义和参考价值。
近年来,越来越多的科学证据表明,肠道菌群与性激素(宿主的内源激素或外源补充激素)存在直接或间接的相互作用。性激素对于塑造肠道微生物群组成具有一定影响,与此同时,肠道微生物群本身也会影响性激素水平。
目前的研究主要基于横断面研究,基于纵向的检测肠道菌群发育以及激素水平变化的研究队列还较少,目前无法区分是性激素变化在前还是菌群变化在前,但是肠道菌群的失调和性激素的异常水平都与多种疾病的发生和发展有关,如肥胖症、炎症性肠病、乳腺增生、甲状腺疾病,妇科疾病、自身免疫疾病等。因此,保持肠道菌群和激素水平的平衡,对于维持人体的健康十分重要。
本文旨在阐述激素与肠道微生物群的相互作用,主要着重讲述性激素影响下的人体一些疾病和菌群的差异。
这些发现可能会在未来用于开发治疗激素紊乱相关疾病或与性别和激素活动相关的自身免疫性疾病、甲状腺疾病、代谢疾病甚至是压力等情绪状态的新疗法。
目录/contents
Part1:肠道微生物与激素的关联
Part2:肠道微生物通过激素对宿主的影响
Part3:性别差异下的肠道微生物群
Part4:肠道菌群与性激素的相互作用
Part5:性激素影响下的相关疾病
Part6:结语
01
肠道微生物与激素的关联
肠道微生物群以多种方式影响动物和人类的行为,甚至可能影响人类的情绪状态和疾病状态。最近揭示了菌群的一个关键作用:调节激素分泌。
微生物和激素之间的相互作用会影响宿主的新陈代谢、免疫力和行为。这种相互作用是双向的,因为微生物群已被证明既受宿主激素影响又影响宿主激素。
肠道微生物群通过激素影响宿主情绪、免疫及代谢等
微生物群对宿主激素水平的影响可能是直接的,即微生物群产生激素,也可能是间接的,即微生物可能调节肾上腺皮质(控制焦虑和压力反应)的功能,或调节炎症和免疫反应。

Neuman H,et al.FEMS Microbiol Rev.2015
激素水平调节微生物群的生长、毒性
多种宿主因素(如饮食、运动、情绪、健康状况、压力和性别)会导致激素水平发生变化,进而对微生物群产生多种影响(包括生长、毒力和抵抗力)。

Neuman H,et al.FEMS Microbiol Rev.2015
文献中已记载激素和微生物群之间的相互作用




Neuman H,et al.FEMS Microbiol Rev.2015
02
肠道微生物通过激素对宿主的影响
▸ 菌群通过影响神经激素前体调节肠道运动、情绪、食欲等
神经内分泌细胞响应神经元输入而分泌神经激素。尽管它们被分泌到血液中以发挥全身作用,但它们也可以充当神经递质。微生物群对行为的调节(例如小鼠的焦虑)被认为是通过神经激素前体(例如血清素、多巴胺)发生的。
最近,肠道细菌被证明可以产生和响应神经激素,例如血清素、多巴胺和去甲肾上腺素。
这些机制对于研究病原体的研究人员来说很有趣,因为它们可能会影响病原体对宿主防御反应的敏感性。例如,为了响应宿主肾上腺素,沙门氏菌会下调其对宿主抗菌肽的抵抗力并诱导关键的金属转运系统,从而影响细胞中的氧化应激平衡。
// 血清素
血清素,也称为 5-羟色胺 (5-HT),是大脑中的主要神经递质之一。然而,超过90%的哺乳动物宿主血清素都存在于肠道中。
肠道血清素的分泌受饮食影响,调节肠道运动、情绪、食欲、睡眠和认知功能。这种双重作用表明血清素可能将肠道(包括其微生物群)与宿主行为联系起来。
血清素与肠易激综合征和克罗恩病有关
大脑血清素可以通过血清素转运蛋白穿过血脑屏障进入血液,这表明肠-脑轴中存在另一个联系。血清素与肠易激综合征和克罗恩病等胃肠道疾病有关,这些疾病也与微生物群的差异有关。
// 多巴胺
多巴胺由芽孢杆菌(Bacillus)和沙雷氏菌(Serratia)等细菌产生 。
无菌小鼠中的游离管腔多巴胺水平显著低于常规小鼠,并且在接种表达β-葡萄糖醛酸酶的细菌后再次升高。
多巴胺不足与帕金森病有关
这些结果表明,在以多巴胺形成不足为特征的帕金森病等疾病中,肠道细菌与多巴胺水平之间可能存在相关性。
//γ-氨基丁酸
γ-氨基丁酸 (GABA) 是哺乳动物中枢神经系统中的主要抑制性神经递质,它也由微生物群产生,并可能影响宿主行为。这很有趣,因为中枢γ-氨基丁酸受体表达的改变与焦虑和抑郁的发病机制有关。
γ-氨基丁酸影响焦虑和抑郁
已经研究了由乳杆菌产生的γ-氨基丁酸,以试图大规模发酵安全的γ-氨基丁酸。因此,向小鼠施用鼠李糖乳杆菌会改变不同中枢神经系统区域中γ-氨基丁酸受体的表达,从而减少与焦虑和抑郁相关的行为。
▸ 菌群通过调节应激激素降低宿主焦虑行为
微生物群可以通过改变应激激素水平来帮助我们保持冷静和平衡。无菌小鼠具有升高的应激激素皮质酮和促肾上腺皮质激素 (ACTH) 血浆水平以响应轻度压力,增加与焦虑和压力相关的行为。
促肾上腺皮质激素通过进一步产生皮质类固醇在下丘脑-垂体-肾上腺轴中发挥重要作用。因此,两种特定物种,瑞士乳杆菌(Lactobacillus helveticus)和长双歧杆菌,降低了大鼠和健康人类的应激激素皮质醇水平和焦虑样行为。
此外,与对照组相比,长期接受益生菌鼠李糖乳杆菌治疗的小鼠在强迫游泳测试中皮质酮水平较低,抑郁行为也较少。
▸ 肠道菌群影响甲状腺激素的转化影响代谢
肠道菌群产生的代谢物对甲状腺和内分泌功能也是必不可少的。它影响硒、铁、锌和碘的吸收,这些都是甲状腺激素产生所需的重要矿物质。它制造短链脂肪酸(SCFAs)与甲状腺激素协同工作,以改善肠道屏障功能和加强细胞间紧密连接。
肠道菌群失衡是影响甲状腺激素转化的主要障碍。事实上,20%的T4(甲状腺素)在肠道中转化为活性的T3(三碘甲状腺原氨酸)形式,肠道菌群不健康,肠道内存在过多的病原体,肠道中甲状腺激素的转化也会减少。
此外当肠道屏障功能减弱时,毒素和未完全消化的食物残渣等颗粒会逃逸,导致肠胃不适和全身炎症。炎症会在组织水平损害甲状腺激素的转化。受体受损,身体也不能将T4激素转化为活性的T3形式。
▸ 细菌通过信息素影响宿主行为
信息素是在性识别、吸引力和交配行为以及攻击行为和支配行为中发挥重要作用的激素。
信息素也称为外激素,一种分泌到一个人体外并影响他人行为的化学物质。
共生细菌和信息素之间的这种联系也发生在哺乳动物身上。两种鬣狗的气味腺中有不同的细菌群落,这与气味分泌物中不同的挥发性脂肪酸特征有关。作者推测,共生细菌产生的代谢产物提供了物种特有的气味。
这进一步支持了细菌可以产生影响宿主行为的气味特征的观点。细菌也可以在配偶选择中发挥作用:雌性小鼠不会被感染沙门氏菌的雄性小鼠的尿液所吸引。
化学信号和嗅觉刺激也在人类行为中发挥作用,未来的研究将帮助我们了解细菌产生的气味是否会影响我们自身的相互作用,甚至可能影响进化。
▸ 肠道菌群代谢性激素影响健康
肠道菌群也影响雌激素,它们通过特定的酶对雌激素进行循环利用并产生雌激素代谢物。当肠道菌群失衡或不健康时,这些过程就会被破坏,从而导致健康问题。
例如,Prevotella intermedius吸收雌二醇和黄体酮,从而促进其生长。雌激素受体ER-β表达的变化也会影响肠道微生物群的组成。
雌二醇在卵巢中合成,是雌激素中含量最高的,活性最强的激素,经肝脏代谢后,通过胆道排泄到胃肠道,部分雌二醇被胃肠道重新吸收进入血液。肠道菌群可以通过改变雌二醇的活性和非活性状态,影响血清中类固醇激素的水平。
武汉大学人民医院转化医学研究所的李艳教授团队在cell metabolism上发表研究论文,发现绝经期前抑郁症患者肠道细菌Klebsiella aerogenes(产气克雷伯氏菌)的3β-羟基类固醇脱氢酶(3β-HSD)通过降解雌二醇诱导绝经期前女性出现抑郁症。
03
性别差异下的肠道微生物群
肠道微生物群作为人体最大的菌群库,动物和人类研究发现,肠道微生物群存在性别相关差异。
影响微生物群的重要因素(例如环境或激素)取决于不同的生命周期,并且在男性和女性中会有所不同。

Kim YS,et al.World J Mens Health.2020
需要注意的是,性激素对肠道微生物具有显著的影响,青春期、怀孕、更年期、多囊卵巢综合征和性腺切除术等各种因素会导致性激素水平(睾酮和雌二醇)发生变化,进而导致肠道菌群组成发生变化。
肠道微生物群与性激素之间的相互作用

Santos-Marcos JA,et al.Biol Sex Differ.2023
▷婴儿时期肠道菌群组成与性别相关的差异
婴儿期的特点是参与人乳低聚糖代谢的细菌种类占主导地位(据估计,婴儿细菌微生物群的25-30%来自母乳)并且肠道微生物群多样性的差异减少。
特别是,这个年龄段的特点是被属于双歧杆菌(Bifidobacterium)和链球菌(Streptococcus)的几种物种定殖,例如长双歧杆菌和嗜热链球菌。
6个月至2岁之间的年龄段的特点是将固体食物引入婴儿的饮食中,并伴随着肠道微生物群结构和功能多样性的快速增加。这是婴儿生长的关键时期,肠道微生物群开始接近成人特征。
最近对人类婴儿进行的几项研究发现了他们出生后第一年不同时间点肠道微生物群落的潜在性别依赖差异。
男婴α多样性较低
例如,对出生后前30天新生儿粪便样本的分析显示,与女性相比,男婴的α多样性较低,梭状芽孢杆菌的丰度也较高,而肠杆菌的丰度较低。
男婴双歧杆菌更丰富
在新生儿肠道中最早和最丰富的细菌定植者中,已知双歧杆菌可为宿主肠道提供健康益处。改变在从出生后一天到六个月大,在男性和女性阴道分娩的婴儿中观察到双歧杆菌丰度。发现与女孩相比,男孩的双歧杆菌水平更高。
▷儿童时期肠道菌群组成与性别相关的差异
在出生后的前12个月,婴儿的肠道因饮食中引入固体食物而发生变化,随之而来的是微生物群落的变化。
特别是,在引入固体食物后,婴儿大肠中厌氧菌种群的初始定植在数量和组成上开始与成人相似。几项研究表明,在没有饮食变化或抗生素治疗等外部压力因素的情况下,与儿童相比,成年期的肠道微生物群更加稳定和有弹性。
这表明尽管出现了部分趋同,但仍存在差异,因此分析这一生命阶段与性别差异的关系很有价值。
男孩双歧杆菌与乳酸杆菌之间的正相关性比女孩更强
对来自哥伦比亚两个不同地点的277名1至5岁儿童(154名女孩和123名男孩)的评估(研究临床腹泻的存在)表明,粪便微生物群受到多种宿主因素的影响,包括年龄、健康状况、地点和性别。
有趣的是,与女孩相比,健康男孩的双歧杆菌和乳酸杆菌之间存在显著更强的正相关性,而在受腹泻影响的儿童中未观察到显着相关性。
▷青春期与性别相关的肠道菌群差异最明显!
青春期是发展的关键时期,性激素,如雌激素和睾酮,在这个年龄段人群的肠道微生物群中发挥重要作用。
在性激素的影响下异性间微生物群差距变大
一项针对青春期肠道微生物群组成的人类研究表明,与同性双胞胎相比,青少年(13-17岁)异性双胞胎的粪便微生物群差异更大。
最近的一项研究得出结论,与青春期受试者(5-15岁)相比,非青春期的α和β多样性没有差异。随着青春期的开始,梭状芽孢杆菌(Clostridium)的水平降低,而变形杆菌(Proteus)的丰度增加。
在青春期受试者中,发现Adlercreutzia、Ruminococcus、Dorea、Clostridium和Parabacteroides与睾酮水平有关。
考虑到人类这一生命阶段的可用数据有限——必须使用啮齿动物模型的研究作为替代。在小鼠身上进行的实验表明,肠道微生物群的性别差异出现在与性激素水平相关的青春期开始时。
动物实验中青春期的菌群性别差异
特别是,仅在10至13周龄的非肥胖糖尿病青春期后小鼠中检测到α多样性的差异,与雄性相比,雌性的水平显著更高。
此外,雄性小鼠表现出更高丰度的卟啉单胞菌科(porphyromonas)、韦荣球菌科、消化球菌科、乳杆菌科和肠杆菌科与女性相比。而当雄性小鼠被阉割后,这些差异就消失了。
▷成年后肠道菌群组成与性别相关的差异
肠道微生物组在生命的最初几年大部分时间都不稳定,但在成年期变得更加稳定,之后细菌丰富度和组成可能伴随着特定疾病会发生变化。
在整个生命周期中,随着免疫和神经系统的成熟,肠道微生物群的伴随发育是性别二态性的,导致成年男性和女性的不同微生物群落以及免疫和神经炎症通路。
注:年龄、环境(饮食和身体活动)和地理位置在内的多种因素似乎在这些性别依赖性肠道菌群差异中发挥了作用。
分析来自结肠癌研究对照组的82名受试者得出结论,性别与肠道微生物组的整体组成显著相关。然而,这项研究包括的参与者数量相对较少,年龄范围相当广泛(30-83 岁),这可能混淆了研究的结果。
年轻女性肠道微生物α多样性比同年龄男性更高
在包括美国、英国在内的四个地理区域以及来自哥伦比亚和中国的两个队列中评估了年龄在20至69岁之间的三个大型队列中年龄、性别和肠道微生物群α多样性之间的关系。
有趣的是,与同年龄段的男性相比,年轻的成年女性(20-45 岁)表现出更高的α多样性。此外,性别和α多样性之间的关联在年轻人中比在中年人中更为明显,而当参与者的平均年龄为60岁时,男女之间的α多样性没有差异。这可以解释为更年期女性的雌激素水平下降。而更年期之后男性与女性的激素水平差异变小,肠道微生物群的相似程度更接近。
总之,对来自不同国家的男性和女性进行的人口研究发现人体肠道微生物群组成存在性别相关差异。
这意味着,性激素的动态变化会影响肠道共生,而青春期时激素的变化最大,此时男性与女性的肠道微生物群之间的差异非常明显。
注:由于该研究所覆盖的样本量还较小,年龄之间的跨度比较大,仅作为研究参考,还不能用于诊断标准。
整个生命周期中男性和女性肠道微生物群组成的差异



Valeri F,et al.Front Neuroendocrinol.2021
04
肠道菌群与性激素的相互作用
不仅肠道微生物群受性激素的影响,而且肠道微生物群本身也会影响激素水平。
▷ 微生物代谢雌激素进而影响多个器官
生殖内分泌功能涉及由复杂反馈机制控制的多种激素。卵巢、肾上腺和脂肪组织会产生雌激素。体内产生的或作为食物摄入的雌激素可以被肠道微生物代谢。
产生的代谢物再次影响宿主。性激素通过类固醇受体(包括雌激素受体β)直接调节细菌的新陈代谢。
具有雌激素代谢能力的肠道微生物群基因库

Yoon K,et al.J Neurogastroenterol Motil.2021
同时,具有β-葡萄糖醛酸酶活性的肠道微生物群解离胆汁中排出的结合循环雌激素。去结合使雌激素对系统的重吸收过程成为可能。去结合的雌激素通过雌激素受体循环并影响多个器官,不仅影响生殖器官,还影响骨骼系统、心血管系统和中枢神经系统。
雌激素循环途径

Valeri F,et al.Front Neuroendocrinol.2021
雌激素在几个组织中局部产生(主要是卵巢,但也有肾上腺和脂肪组织)。它们在血液中循环,到达多个靶器官,如肝脏和肾脏。一旦到达肝脏,它们就会通过葡萄糖醛酸化或磺化反应进行结合。
此外,结合雌激素被转化为水溶性分子,随后可以通过胆汁、尿液和粪便排出体外。某些部分的结合雌激素可以在肠道中被肠道微生物分解,并通过门静脉被重新吸收到肝脏中。
雌激素对发病机制具有影响
通常,雌激素与核受体结合,引起构象变化。通过肠道屏障通透性和免疫系统调节,中枢和外周改变与肠易激综合征 (IBS) 相关联。流行病学研究表明女性在肠易激综合征中比例更大,暗示性激素对其发病机制的影响。
雌激素受体作用的分子途径

Yoon K,et al.J Neurogastroenterol Motil.2021
▷ 微生物群影响雄激素的代谢
据报道,在雄激素代谢中,肠道微生物群是一个重要的调节因子。在小鼠的小肠内容物中,葡萄糖醛酸化睾酮和双氢睾酮含量很高。远端肠道具有高水平的游离双氢睾酮。
在年轻成年男性的粪便中观察到明显高水平的未结合双氢睾酮。在无菌小鼠中,葡萄糖醛酸化睾酮和双氢睾酮较高;然而,在远端肠道中发现游离水平非常低。这意味着肠道微生物群会影响双氢睾酮和睾酮的肠道代谢。
▷ 性激素高的人拥有更多样化的肠道微生物
血清睾酮升高的男性和雌二醇水平升高的女性分别拥有更多样化的肠道微生物群,许多细菌属与睾酮(Acinetobacter, Dorea, Ruminococcus和Megamonas)和雌二醇(Slackia和Butyricimonas)水平相关。
高雄激素的女性微生物群明显改变
在这方面,患有多囊卵巢综合征(高雄激素)的女性在妊娠早期到晚期的变化中,表现出明显的微生物群改变,变形菌(Proteobacteria)和放线菌(Actinobacteria)总体增加,丰富度降低。
肠道微生物群组成的性别差异在青春期增加,随着青春期的进展,女孩的肠道微生物群变得与成年人更相似。这些结果可能还表明肠道微生物群可能会影响青春期的时间,可能是通过调节宿主性激素水平。
雌激素水平与肠道微生物多样性密切相关
在男性和绝经后女性中,尿液中的雌激素水平与肠道微生物群丰富度和α多样性密切相关,而绝经前女性雌激素水平在月经周期中收集时变化很大,并未显示出这种关联。
▷ 微生物群可以预测粪菌移植后睾酮水平
最近报道,绝经后妇女的肠道菌群与男性比绝经前妇女更相似,绝经后妇女与同龄男性之间实际上没有显著差异。
这项研究还表明,性腺类固醇与微生物群差异之间存在关联,绝经前妇女的类固醇生物合成和降解途径丰富,并且与血浆睾酮水平显著相关。
此外,微生物群可以预测人类粪便转移后人类和(经抗生素处理的)雄性小鼠的循环睾酮水平。
综上所述,这些结果表明,肠道微生物群组成的差异与性别以及不同激素状态有关。
既然知道了肠道微生物群与性激素之间存在相互作用,那么它们具体是通过什么机制影响的呢?
性激素和肠道微生物组之间相互作用机制

He S,et al.Front Microbiol.2021
1
微生物群通过改变胆汁酸影响性激素水平
最近有人提出,肠道微生物群的部分性别差异可能取决于胆汁酸,因为男性的胆汁酸库比女性大。在肝脏中由胆固醇合成后,它们被肠道微生物群代谢为次级胆汁酸,从而改变微生物群的结构并导致各种病理。
因此,肠道微生物群通过依赖于法尼醇X受体(FXR)的机制调节回肠中成纤维细胞生长因子15(FGF15)和肝脏中胆固醇7α-羟化酶(CYP7A1)的表达,从而调节胆汁酸的二次代谢,并抑制胆汁酸在肝脏中的合成。
FGF15抑制肝脏中CYP7A1的表达,CYP7A1是一种催化和调节胆汁酸合成第一步的酶。
胆汁酸同时也能影响微生物群的结构和丰度
已经观察到胆汁酸的减少导致细菌增殖,并且法尼醇X受体抑制细菌过度生长。
几项研究证实了胆汁酸、性激素和肠道菌群组成之间的关系。通过这种方式,给大鼠服用胆汁酸引起的微生物群变化类似于高脂肪饮食引起的变化,以牺牲拟杆菌属为代价增加厚壁菌门的水平。
此外,粪便微生物群(来自瘦供体)的移植产生了与瘦供体相似的肠道微生物群和胆汁酸库的变化,而小鼠的性腺切除术也改变了胆汁酸模式。
由于睾酮是由胆汁酸衍生的,并且如上所述,胆汁酸水平会被微生物群改变,因此微生物群可能间接影响睾酮水平的说法是成立的。
2
微生物群通过酶促激活性激素
共生微生物群落可以通过其酶的活性影响性激素水平。通过这种方式,术语“strobolome”被创造出来,定义为肠道微生物群中能够从其无活性葡萄糖醛酸苷中激活雌激素的一组基因,这主要归功于β-葡萄糖醛酸苷酶,它将雌激素解离为活性形式。这些活性雌激素进入血液并作用于雌激素受体α(ERα) 和雌激素受体β(ERβ)。
同样,最近的一项研究得出结论,肠道微生物群参与双氢睾酮 (DHT) 和睾酮的代谢和肠道去葡萄糖化,从而导致最高水平的雄激素。
肠道微生物群在性别差异中的另一种可能作用机制可以在羟基类固醇脱氢酶 (HSD) 中找到,这些酶参与类固醇激素的代谢并控制类固醇与其核受体的结合,使它们充当激活剂或抑制剂。
✦ 肠道微生物还通过植物雌激素影响代谢
除了三种主要形式的雌激素(胆固醇衍生的类固醇激素)、雌二醇(E2,在绝经前的非孕妇中占主导地位)、雌酮(E1,在绝经后占主导地位)和雌三醇(E3,在怀孕期间占主导地位),还有一种称为植物雌激素的植物化合物,其结构和功能与雌激素相似。
植物雌激素是天然存在于植物中的化合物,植物雌激素包括异黄酮,如染料木黄酮和黄豆苷原,它们主要存在于大豆中,并在被肠道微生物群代谢后被激活。从这个意义上说,肠道微生物群允许从黄豆苷元中获得O-Desmethylangolensin (ODMA) 和雌马酚,这两种物质都具有雌激素活性。
与雌激素类似,植物雌激素通过影响细胞信号传导引起生理效应,因为它们可以通过激活或抑制雌激素受体α或雌激素受体β来诱导或抑制雌激素作用,并且还可能引发表观遗传效应和细胞内信号级联反应。
植物雌激素可以调节内分泌系统改善病症
与此相关的是,几项人类研究表明,植物雌激素可以通过调节内分泌系统来改善各种病症,包括更年期症状,并且可以逆转代谢性内毒素血症的症状。
在这方面,植物雌激素代谢物雌马酚通过促进雌激素的尿液排泄和改变女性的血液水平,与降低女性激素相关疾病的风险有关,而不产生O-Desmethylangolensin与肥胖有关。
植物雌激素在饮食中被消耗,因为它们出现在水果、蔬菜、豆类和一些谷物中。事实上,饮食成分对肠道微生物群生态系统具有急性影响。通过促进更多样化和更稳定的微生物系统的发展,以植物为基础的饮食似乎对人类健康更有益。
!
药物和益生菌治疗的性别差异
已有一些关于药物治疗和微生物群性别差异的报道。
▷男女服用同一种抗炎药后微生物变化有差异
一项人体研究调查了23名健康男性和女性在非甾体抗炎药诱导的肠道屏障功能和微生物组方面的差异。使用 16S 核糖体 RNA 测序确定了十二指肠和粪便微生物群组成。健康女性的肠道通透性较低,十二指肠和粪便微生物多样性高于健康男性。
两性服用吲哚美辛后肠道通透性增加。然而,只有雌性在摄入吲哚美辛后粪便微生物多样性下降,包括普氏菌丰度增加。十二指肠微生物群组成没有表现出性别特异性变化。
▷益生菌给药存在性别差异
如今,益生菌因多种原因而流行,并且有人认为其效果可能因性别而异。
一项研究报告说,将5种乳杆菌菌株的益生菌混合物给予易患狼疮的小鼠可改善肾功能,并在雌性和阉割的雄性小鼠中显示出抗炎作用,但在性腺完整的雄性小鼠中则没有,这表明益生菌给药存在性别差异。
另一项研究报告了金枪鱼油和海藻油混合物对肠道微生物群的抗衰老作用存在性别差异。雄性小鼠在特定混合油比例下表现出比雌性小鼠更好的抗衰老效果。
05
性激素影响下的相关疾病
肠道菌群失调引发的疾病在两性之间表现不同。研究最多的疾病主要是代谢性疾病。研究发现,性激素等多种因素影响这些疾病,它们密切相关,相互作用。
▼
肥胖
▸ 全球肥胖发病率越来越高
肥胖症的体重指数(BMI)为30kg/m2或更高,在全球各国成人和儿童中的流行率都在增加。这种病理学是复杂的遗传、社会经济和文化相互作用的结果,会导致严重的健康、经济和社会问题。
科学研究表明,一些代谢紊乱的发生与身体脂肪的分布有关,而且这种分布表现出性别二态性。脂肪倾向于堆积在男性的躯干和腹部周围,而女性的脂肪一般在臀部和大腿周围。
•腹部肥胖
腹部肥胖,尤其是内脏肥胖,会导致血糖和甘油三酯升高、高密度脂蛋白胆固醇降低和低密度脂蛋白 (LDL) 颗粒的增加,以及炎症标志物的增加 。
•臀部肥胖
相反,臀部脂肪与保护性脂质和葡萄糖水平以及降低代谢风险有关,似乎通过长期脂肪酸储存和有益的脂肪因子水平(与瘦素和脂联素水平呈正相关,与炎性细胞因子水平负相关)发挥其保护作用。
肥胖中的微生物多样性和性激素

Brettle H,et al.Front Immunol.2022
在肥胖症中,拟杆菌门决定了疾病的严重程度。肥胖男性的物种丰富度较低,并且发现睾酮与厚壁菌门增加有关,因此会释放更多的抗炎丁酸盐。
另一方面,肥胖女性尽管微生物多样性更高,但雌二醇和拟杆菌增加,导致脂多糖释放更多,从而引发更强的免疫反应。
脂肪组织分布、性激素和肥胖的代谢紊乱

Brettle H,et al.Front Immunol.2022
与绝经前女性相比,男性和绝经后女性心血管风险增加,腹部/内脏肥胖和胰岛素皮下脂肪分布减少。男性和绝经后女性体内的脂肪组织比绝经前女性的脂肪组织更具促炎性。
√性激素调节身体脂肪分布
大量证据支持性类固醇调节身体脂肪分布的观点。在这方面,青春期激素的变化与不同性别之间的体重增加有关,这是由于男孩的瘦体重增加和女孩的脂肪量增加,以及男性和女性的脂肪分布。
此外,几项研究表明,一些基因参与了在体脂分布中观察到的性别二态性,以及性类固醇激素在这些基因调节中的潜在作用。
睾酮影响不同部位的脂肪堆积
在男性中,睾酮抑制腹内区域甘油三酯的摄取,并似乎促进它们在皮下区域的积累,同时导致儿茶酚胺刺激的皮下脂肪分解减少,而不是内脏脂肪分解。
这些过程似乎受到雄激素受体 (AR) 基因的影响,因为在雄激素受体敲除小鼠模型中,雄激素受体的缺失通过减少脂肪分解导致肥胖增加,尤其是晚期肥胖。
此外,caveolin-1蛋白(CAV1)似乎在脂肪堆积中起着重要作用,并且它受雌激素(雌二醇)和雄激素(双氢睾酮)的不同调节。
√性激素影响脂肪细胞功能
在细胞水平上,已经观察到性激素(雄激素和雌激素)对白色脂肪组织中脂肪细胞功能影响的差异,涉及脂肪细胞分化、脂肪分解、脂肪生成、胰岛素敏感性和脂肪因子产生/分泌等关键方面。
在这种情况下,睾酮和双氢睾酮调节小鼠间充质干细胞的分化,以雄激素依赖性方式分别促进和抑制它们向肌细胞和脂肪细胞的分化。
双氢睾酮增加脂肪分解
同样,在对人体细胞进行的体外研究中,双氢睾酮以雄激素受体依赖性方式抑制人间充质干细胞和人前脂肪细胞的脂肪形成分化,增加脂肪分解并减少脂质积累。
睾酮阻止脂肪细胞肥大和脂肪细胞生成
在阉割小鼠(雄性性腺功能减退症模型)中,脂肪量通过脂肪细胞肥大和脂肪生成增加,而当这些小鼠接受激素替代疗法时,睾酮阻止内脏和皮下脂肪量的扩张。
此外,致肥胖脂肪生成也通过抑制雄激素受体活性而升高。这项研究还显示了脂肪分布的不同调节,睾酮衍生的雌二醇和双氢睾酮分别阻止了内脏和皮下脂肪的增加。
√睾酮浓度较高利于减少内脏脂肪
睾酮浓度与向心性肥胖呈负相关,并且已发现睾酮治疗可减少具有雄激素缺乏症状和低血清睾酮水平的男性的内脏脂肪。
睾酮含量下降后脂肪更多的积累
此外,随着年龄的增长,睾丸激素的下降伴随着肥胖的增加,腹部脂肪的优先积累和内脏脂肪组织的更多积累。
还有报道称,内脏脂肪组织与生物可利用和游离睾酮呈负相关,皮下脂肪组织与性激素结合球蛋白 (SHBG) 呈负相关。
√雌二醇水平较低的女性易患向心性肥胖
在女性中,向心性肥胖与睾酮水平升高和雌二醇降低相关。更年期的荷尔蒙变化导致脂肪重新分布,与总脂肪和年龄无关,然而,一些研究表明,绝经后上半身脂肪的分布可能是由于衰老而不是绝经本身。
向心性肥胖——指患者体内脂肪沉积是以心脏、腹部为中心发展的一种肥胖类型。
最近发现,绝经前妇女的身体或躯干脂肪量与较低的总雌二醇和较高的游离雌二醇浓度有关,绝经前和绝经后妇女的总睾酮和计算游离睾酮浓度较高,性激素结合球蛋白和胰岛素样生长因子-I(IGF-I)浓度较低。
▼
代谢综合征
代谢综合征是一种以腹部肥胖、胰岛素抵抗、高血压和高血脂为特征的病理状况,已遍布全球并导致2型糖尿病、冠心病和中风等疾病患病率上升。
性激素对肥胖、代谢综合征和2型糖尿病的影响

Santos-Marcos JA,et al.Biol Sex Differ.2023
√代谢综合征患者中男女的菌群差异
在代谢综合征患者中也观察到特定菌属的丰度差异。男性中韦荣氏球菌属(Veillonella)、Methanobrevibacter、Acidaminococcus、梭状芽孢杆菌(Clostridium)、罗氏菌属(Roseburia)和Faecalibacterium的丰度较高,而女性中嗜胆菌属(Bilophila)、瘤胃球菌属(Ruminococcus)和拟杆菌属(Bacteroides)的丰度更高。
√睾酮水平会影响代谢综合征
在睾酮对代谢综合征的影响中观察到的性别二态性似乎是雄激素受体依赖性的,并且已经提出了几种机制来解释睾酮水平与代谢综合征之间的关联。
男性中睾酮水平高不易患代谢综合征
在男性中,有证据表明睾酮与内脏肥胖、胰岛素抵抗和代谢综合症的发展呈负相关。沿着这些思路,在男性和啮齿动物中都报道了睾酮的雄激素受体介导的抗肥胖作用。
过量的睾酮可能导致女性胰岛素分泌受损
在女性中,据报道睾酮水平升高与胰岛素抵抗和葡萄糖耐受不良相关,因为它会降低全身葡萄糖的摄取。
关于睾酮对胰腺的作用,一项小鼠研究表明,雄激素受体调节男性胰岛β细胞生理,因此该受体的缺乏会降低葡萄糖刺激的胰岛素分泌并导致葡萄糖耐受不良。相反,有人提出,过量的睾酮可能通过雄激素受体依赖性机制导致女性胰岛β细胞功能障碍,胰岛素分泌受损。
√雌激素缺乏的女性代谢综合征患病率较高
雌激素水平似乎也影响代谢综合症的患病率。因此,大鼠卵巢切除术引起的雌激素耗竭导致大多数代谢综合征成分(脂质、葡萄糖、高密度脂蛋白和低密度脂蛋白)恶化,而在50岁以下的女性中,即经历更年期,其患病率增加。
卵巢切除的女性血糖和血压升高
此外,据报道,在接受过子宫切除术(通常伴随双侧卵巢切除术以预防后续卵巢癌)的女性中,血糖水平和高血压升高。
绝经导致性激素结合球蛋白水平下降,至少部分是由于雌激素减少,而睾酮水平在绝经期间没有改变 。从这个意义上说,绝经可以被认为是代谢综合征及其独立于年龄的所有独立组成部分的预测因素(风险因素)。
此外,已经描述了性激素结合球蛋白和代谢综合征之间的负相关,尤其是在绝经后妇女中。
▼
2型糖尿病
糖尿病包括一组疾病,根据其发展机制进行区分,这些疾病会降低调节血流中葡萄糖水平的能力,并导致长期高血糖症。
由于自身免疫和代谢过程,糖尿病有两种主要形式,即胰岛素依赖型糖尿病(1型糖尿病,T1D)和非胰岛素依赖型糖尿病(2型糖尿病,T2D)。
2型糖尿病的特征是胰岛B细胞产生的胰岛素不足和肝脏葡萄糖代谢受损,以及胰岛素抵抗,导致组织对胰岛素的反应性降低。
√糖尿病前期的症状表现出性别差异
空腹血糖受损 (IFG) 和葡萄糖耐量受损 (IGT) 作为2型糖尿病的前期阶段发生,表现出性别二态性,葡萄糖耐量受损在女性中更常见,而空腹血糖受损在男性中更常见。
有人提出,性激素可能是造成这种二态性的原因。事实上,更年期的雌激素治疗会降低空腹血糖并恶化葡萄糖耐量。
√男性的2型糖尿病发病率高于女性
此外,已证实男性的2型糖尿病发病率高于女性,这进一步支持了性激素参与这种病理学的发展。更年期2型糖尿病的风险增加,而更年期的激素治疗可能会延迟2型糖尿病的发作。
√睾酮水平影响男性2型糖尿病患病率
患有2型糖尿病的男性总睾酮和游离睾酮水平较低。与此相关的是,低水平的睾酮和性激素结合球蛋白与男性胰岛素抵抗和随后的2型糖尿病的发展有关。
低睾酮水平男性死亡率增加
此外,高水平性激素结合球蛋白和低水平睾酮的结合与2型糖尿病男性死亡率增加有关。其他研究表明,在患有2型糖尿病的男性中,低睾酮水平本身与死亡率增加相关,而睾酮替代疗法可能会提高这些男性的生存率。
同样,据报道,经过2年的睾酮治疗后,患有2型糖尿病的男性比例有所降低。此外,已发现前列腺癌的雄激素剥夺疗法会增加患糖尿病的风险。
患有2型糖尿病的男性睾酮水平往往较低
与上述一致,患有2型糖尿病的男性往往睾酮水平较低,而且他们中的大多数患有性腺功能减退症。事实上,许多研究已经证实,患有性腺功能减退症和低睾酮水平的肥胖2型糖尿病患者在接受睾酮替代疗法 (TRT) 后表现出改善的胰岛素抵抗和血糖控制。
√雌二醇水平高的男性患2型糖尿病的风险增加
关于女性荷尔蒙,雌二醇水平高的男性患2型糖尿病的风险增加,这种高雌二醇浓度与低性激素结合球蛋白浓度一起对男性患2型糖尿病的风险产生不利影响。
√女性睾酮水平较高可能易患2型糖尿病
与男性相反,女性的高睾酮水平与胰岛素抵抗和2型糖尿病相关。然而一项研究表明,中国女性性激素结合球蛋白值升高与患2型糖尿病的可能性降低相关,但雌二醇和睾酮水平与该族群中的2型糖尿病无关。
注:这些关于睾酮与2型糖尿病发病率之间关系的相互矛盾的结果可能是由于睾酮的测量,一些作者使用总睾酮而其他人使用游离睾酮,并且根据最近的一项研究,不同研究的分析方法可能不同。
此外,当性激素结合球蛋白浓度低于30nmol/L时,游离雄激素指数(FAI)不是游离睾酮的可靠指标,这将导致性激素结合球蛋白水平较低的女性可能出现研究错误。
因此,在女性中,总睾酮与2型糖尿病之间没有关联,尽管游离睾酮水平较高与2型糖尿病风险增加有关。
√雌二醇水平异常会增加2型糖尿病发病率
关于雌二醇,据报道患有2型糖尿病的绝经后女性的雌二醇水平高于健康女性。然而,基于早期初潮或绝经以及子宫切除术和卵巢切除术实践的大量证据表明,非生理性雌二醇水平(高于或低于正常值)可能是导致2型糖尿病发病率增加的原因。
月经初潮提前会增加2型糖尿病的风险
在这方面,月经初潮提前似乎会增加患2型糖尿病的风险。然而,一些研究表明,初潮早导致的2型糖尿病风险的部分原因可能是肥胖增加,因为早期月经初潮已被证明也与成年期体重指数的增加有关。
提前绝经和卵巢功能不全导致2型糖尿病风险增加
另一方面,提前绝经或卵巢功能不全会导致患2型糖尿病的风险增加。在接受双侧卵巢切除术的绝经后妇女中也观察到了类似的结果。
切除卵巢的女性2型糖尿病风险增加
最后,伴有双侧输卵管卵巢切除术(BSO)的子宫切除术显示2型糖尿病的风险高于子宫切除术本身。然而,其他研究表明子宫切除术与2型糖尿病风险增加有关,而双侧输卵管卵巢切除术本身或与子宫切除术一起并没有增加2型糖尿病的风险。
研究表明表明接受子宫切除术或卵巢切除术的女性患2型糖尿病的风险增加,但并未区分这两种情况是单独发生还是同时发生。
另一项研究表明,相对于完整女性,双侧卵巢切除的子宫切除女性的总睾酮和生物可利用睾酮水平较低,而保留卵巢的子宫切除女性的睾酮水平居中。
与此相关,绝经后妇女(子宫完整和子宫切除)的雌激素和孕激素激素疗法降低了糖尿病的发病率。
▼
肠易激综合征
肠易激综合征是一组持续或间歇发作,以腹痛、腹胀、排便习惯或大便性状改变为临床表现,胃肠道结构和生化异常的肠道功能紊乱性疾病。
√女性患肠易激综合征的比例更高
肠易激综合征 (IBS) 是一种具有性别差异的代表性疾病,通常在女性中的发生频率是男性的两倍。特别是,到三级中心就诊的患有严重症状的肠易激综合征患者的女性比例更高。
感染性结肠炎后肠易激综合征的风险增加,约10%的肠易激综合征患者在感染性结肠炎后开始出现症状。有趣的是,感染后肠易激综合征的发病率在女性中较高,这表明性别间肠道微生物群的差异可能在肠易激综合征的发病机制中发挥重要作用。
√肠易激综合征的症状存在性别差异
女性更有可能出现腹痛和便秘
肠易激综合征症状存在性别差异:具体而言,IBS-C在女性中占主导地位,而IBS-D在男性中占主导地位。
便秘型肠易激综合征(IBS-C)是肠易激综合征的一种亚型:至少25%的排便为硬粪或干球粪,且松散(糊状)粪或水样粪<25%。
腹泻型肠易激综合征(IBS-D):至少25%的排便为松散(糊状)粪或水样粪,且硬粪或干球粪<25%。
在对22项关于肠易激综合征症状性别差异的研究进行的系统回顾和荟萃分析中,发现女性比男性更可能出现腹痛和便秘相关症状。便秘型肠易激综合征在患有肠易激综合征的女性中的合并患病率为40%,而在患有肠易激综合征的男性中为21%。
男性出现腹泻症状更多
相比之下,患有肠易激综合征的男性比女性更有可能报告腹泻相关症状。腹泻型肠易激综合征(IBS-D)在患有肠易激综合征的女性中的合并患病率为 31%,而在男性中为50%。
√女性月经期间肠易激综合征症状加重
女性在月经期间报告更频繁和更严重的肠易激综合征症状,例如稀便、腹胀和腹痛加重,这些症状的增加可能与月经周期的变化有关。
在冰岛进行的一项基于人群的邮政研究表明,患有痛经的女性比没有痛经的女性更容易出现肠易激综合征症状。此外,更年期似乎与肠易激综合征症状的恶化有关。也就是说,女性在绝经后报告的腹痛比绝经前更严重。
此外,纤维肌痛、慢性疲劳综合征、慢性盆腔痛和偏头痛等经常与肠易激综合征重叠的慢性疼痛疾病的患病率在肠易激综合征女性中更高,这表明她们的症状与激素之间存在关联。
▼
甲状腺疾病
甲状腺是重要的内分泌腺。甲状腺的主要功能是分泌含碘的甲状腺激素三碘甲状腺原氨酸(T3)和甲状腺素(T4)以及肽类激素降钙素,通过影响新陈代谢和组织发育来影响心血管和生殖疾病。
肠道微生物群在甲状腺疾病中起着至关重要的作用,包括桥本氏甲状腺炎 (HT) 和格雷夫斯氏病 (GD)。桥本氏甲状腺炎和格雷夫斯氏病分别是甲状腺功能减退症和甲状腺功能亢进症的主要原因。
√女性甲状腺疾病发病率高于男性
甲状腺疾病性别差异特别的显著,它的高发人群多为中年的女性,男性的患病率相对来说比较低,而之所以会这样是因为女性的内分泌活跃程度很高,没有一定的稳定性。
在平时压力大和情绪发生变化的情况下,会导致自身的免疫调节出现异常,致使甲状腺激素分泌过多,从而就会容易造成甲状腺疾病的发生。
√胆汁酸的组成可以反映甲状腺功能
胆汁酸是肠道微生物群的重要代谢产物,在甲状腺疾病中起着至关重要的作用。甲亢和甲减患者的血清胆汁酸谱不同,胆汁酸的组成可以反映甲状腺功能。甲状腺功能减退患者中最主要的胆汁酸是次级胆汁酸脱氧胆酸,而鹅去氧胆酸是甲状腺功能亢进患者中最主要的胆汁酸。
胆汁酸的组成和水平参与甲状腺激素的分泌,促甲状腺激素水平与亚临床甲减患者血清总胆汁酸呈负相关。
√短链脂肪酸与甲状腺激素相互作用影响女性情绪健康
短链脂肪酸是肠道菌群代谢的主要产物之一,短链脂肪酸与甲状腺激素三碘甲状腺原氨酸相互作用,并通过调节肠细胞基因转录来影响激素的分泌。例如,粪便短链脂肪酸酯可通过影响高脂血症和甲状腺疾病来影响女性的情绪健康。
▼
卵巢癌
卵巢癌症的病因尚不清楚,可能与环境、生殖、行为和遗传因素有关。在这些因素中,雌激素水平的失调和雌激素的活性被认为是重要因素。
肠道微生物群可能通过影响雌激素水平参与卵巢的发育。发现17β-雌二醇治疗会改变卵巢癌小鼠模型的病理生理学,导致肿瘤提前发作、缩短总生存时间,并具有典型的乳头组织学特征。
√雌激素促进细胞粘附和迁移从而影响卵巢癌的病症
利用不同的卵巢癌症细胞系进行了一项体外研究,以确认雌激素受体在卵巢癌症病因中的需求。
他们的结果表明,雌激素治疗后,雌激素受体阳性细胞系的粘附和迁移能力增强,而雌激素受体阴性细胞系的粘附和移动能力没有显著变化。
这些结果表明,雌激素的作用与雌激素受体的表达直接相关,雌激素促进细胞粘附和迁移,从而影响卵巢癌症的转移和定植。
√微生物通过影响活性雌激素含量影响卵巢癌
如上所述,具有 β-葡萄糖醛酸酶活性的细菌可以介导雌激素的去结合,从而影响循环中活性雌激素的数量。结合雌激素水平和活性在卵巢癌病因学中所起的作用,我们可以推断肠道微生物组可能通过影响活性雌激素的量来促进雌激素驱动的疾病(如卵巢癌)的发展。
▼
绝经后骨质疏松症
绝经后骨质疏松症 (PMOP) 是一种由雌激素缺乏引起的骨质疏松症,会导致绝经后妇女骨折频率增加。
√雌激素缺乏易引起骨质疏松
目前的研究表明,肠道微生物群与骨重塑以及骨代谢疾病之间存在潜在的密切关系。
研究人员发现,在无菌小鼠中,性类固醇缺乏不能诱导破骨细胞因子表达增加、骨吸收激活,这表明肠道微生物组在性类固醇缺乏导致的骨质疏松中至关重要。
他们进一步证明,用益生菌鼠李糖乳杆菌或市售益生菌补充剂每周两次治疗性类固醇缺乏小鼠可以避免骨质疏松。这种情况的发生可能是由于肠道通透性的降低、肠道和骨髓炎症的抑制。
相比之下,补充非益生菌大肠杆菌菌株或突变鼠李糖乳杆菌并没有显示出对骨丢失的保护作用。
上述结果表明,肠道微生物群失调可能导致肠道通透性增加,并触发重要炎症通路的激活,从而导致性类固醇缺乏小鼠的骨质流失。
这些结果将雌激素缺乏引起的骨质疏松症与肠道微生物多样性、肠道通透性和炎症联系起来。
▼
多囊卵巢综合征
√高雄激素可能导致多囊卵巢综合征
多囊卵巢综合征是育龄妇女常见的内分泌疾病,其病因可能与高雄激素血症、胰岛素抵抗和神经内分泌功能障碍有关。
一些研究关注多囊卵巢综合征患者的肠道微生物组,这些研究发现肠道微生物组与多囊卵巢综合征之间存在某种关联。然而,与多囊卵巢综合征相关的微生物的确切机制尚未确定。
√多囊卵巢综合征患者肠道微生物多样性较低
一些研究人员发现,患有多囊卵巢综合征的患者肠道微生物组的多样性明显低于健康对照组。在多囊卵巢综合征患者的肠道微生物组中,普通拟杆菌(Bacteroides vulgatus)显著升高,脱氧胆酸和熊去氧胆酸水平降低。
通过比较多囊卵巢综合征女性的粪便微生物组、肠上皮通透性和炎症状态,一些研究提出了一个假设,即肠上皮高通透性导致的毒血症与炎症、胰岛素抵抗和高雄激素血症有关。不过还需要更深入的研究来阐明内毒素血症的具体机制。
√调节肠道微生物有助于改善多囊卵巢综合征
菊粉和二甲双胍对多囊卵巢综合征的缓解作用与抗炎和肠道微生物群的调节有关,这可能有助于多囊卵巢综合症的潜在临床治疗。
环丙孕酮Diane-35(雌激素和孕激素)和益生菌可以帮助重建肠道微生物群的多样性,减少肠道菌群紊乱可以改善多囊卵巢综合征样大鼠的生殖功能。
还需要进一步的研究来确定改善肠道微生物组是否可以作为多囊卵巢综合征的有效治疗方法。
小结
根据性激素和肠道微生物组之间的相互作用,性激素相关疾病的可能治疗策略的显示在下图:

He S,et al.Front Microbiol.2021
在对性激素相关疾病治疗的过程中发现了肠道微生物群的变化,未来通过对肠道微生物的检测或许有助于判断性激素相关疾病的治疗效果。
06
结语
性激素,特别是雌激素和睾酮,与肠道微生物群的结构和组成有关,性激素与肠道微生物群的相互作用对疾病的发展和性别差异具有重要影响。
肠道微生物群的特定变化可能有助于缓解激素紊乱相关的疾病,因此肠道微生物群被认为是一个重要治疗靶点。
在制定治疗策略时,确定导致疾病发病率中性别二态性的机制具有特殊的重要性,因为肠道微生物群的组成取决于与性激素的相互作用以及其他因素。治疗与这些疾病相关的肠道微生物群失调的疗法可能具有性别特异性效应。
总之,肠道微生物群与激素相互作用在疾病中的影响已经成为了一个备受关注的研究领域。肠道微生物群在激素变化及其带来的健康风险的重要作用及其检测的意义也被越来越多的人所认识。未来,随着相关研究的不断深入,肠道微生物群与激素相互作用的机制和应用价值也将会进一步得到探索和发展。
主要参考文献
Santos-Marcos JA, Mora-Ortiz M, Tena-Sempere M, Lopez-Miranda J, Camargo A. Interaction between gut microbiota and sex hormones and their relation to sexual dimorphism in metabolic diseases. Biol Sex Differ. 2023 Feb 7;14(1):4.
Li D, Sun T, Tong Y, Le J, Yao Q, Tao J, Liu H, Jiao W, Mei Y, Chen J, Liu Z, Wang G, Li Y. Gut-microbiome-expressed 3β-hydroxysteroid dehydrogenase degrades estradiol and is linked to depression in premenopausal females. Cell Metab. 2023 Apr 4;35(4):685-694.e5.
Brettle H, Tran V, Drummond GR, Franks AE, Petrovski S, Vinh A, Jelinic M. Sex hormones, intestinal inflammation, and the gut microbiome: Major influencers of the sexual dimorphisms in obesity. Front Immunol. 2022 Sep 27;13:971048.
Kautzky-Willer A, Harreiter J, Pacini G. Sex and Gender Differences in Risk, Pathophysiology and Complications of Type 2 Diabetes Mellitus. Endocr Rev. 2016 Jun;37(3):278-316.
Saklayen MG. The global epidemic of the metabolic syndrome. Curr Hypertens Rep. 2018;20(2):12.
Paschou SA, Papanas N. Type 2 diabetes mellitus and menopausal hormone therapy: an update. Diabetes Ther. 2019;10(6):2313–2320.
Valeri F, Endres K. How biological sex of the host shapes its gut microbiota. Front Neuroendocrinol. 2021 Apr;61:100912.
Kim YS, Unno T, Kim BY, Park MS. Sex Differences in Gut Microbiota. World J Mens Health. 2020 Jan;38(1):48-60.
Yoon K, Kim N. Roles of Sex Hormones and Gender in the Gut Microbiota. J Neurogastroenterol Motil. 2021 Jul 30;27(3):314-325.
He S, Li H, Yu Z, Zhang F, Liang S, Liu H, Chen H, Lü M. The Gut Microbiome and Sex Hormone-Related Diseases. Front Microbiol. 2021 Sep 28;12:711137.