文章信息
题目:The IbBBX24–IbTOE3–IbPRX17 module enhances abiotic stress tolerance by scavenging reactive oxygen species in sweet potato
刊名:New Phytologist
作者:Huan Zhang,Shaozhen He et al.
单位:China Agricultural University
日期:13 November 2021
01
摘要
土壤盐分和干旱限制了甘薯的产量。过氧化物酶 (PRX) 清除活性氧 (ROS) 在植物胁迫响应期间是必不可少的,但在非生物胁迫下如何调节PRX表达尚不清楚。
在这里,我们报告 B box (BBX) 家族转录因子 IbBBX24通过与其启动子结合来激活 III 类过氧化物酶基因IbPRX17的表达。IbBBX24和IbPRX17的过表达显着提高了甘薯对盐和干旱胁迫的耐受性,而降低IbBBX24表达增加了它们的易感性。在非生物胁迫下,与野生型相比, IbBBX24-和IbPRX17-过表达系表现出更高的过氧化物酶活性和更低的H 2 O 2积累。RNA 测序分析显示 IbBBX24 调节编码 ROS 清除酶的基因的表达,包括 PRX。
此外,IbBBX24 与 APETALA2 (AP2) 蛋白 IbTOE3 之间的相互作用增强了 IbBBX24 激活IbPRX17转录的能力。IbTOE3的过表达通过清除 ROS 提高了烟草植物对盐和干旱胁迫的耐受性。
总之,我们的研究结果阐明了 IbBBX24–IbTOE3–IbPRX17 模块响应甘薯非生物胁迫的机制,并确定了开发具有增强的非生物胁迫耐受性的优良作物品种的候选基因。
02
技术路线
salt-tolerant sweet potato (Ipomoea batatas (L.) Lam.) line‘ND98’,
salt-sensitive sweet potato variety ‘Lizixiang
Sequence isolation and analysis
qRT-PCR、RNA-seq
Production of transgenic plants
Assay for promoter activity
Assays for salt, drought and oxidation tolerance
Measurement of indices of abiotic stress tolerance
Electrophoretic mobility shift assay (EMSA)
Dual-luciferase assay
Subcellular localization analysis
Dual-luciferase assay
Transcriptional activation assay
Protein interaction assays
03
主要结果
3.1 非生物胁迫诱导IbBBX24及其启动子
我们之前进行了cDNA扩增片段长度多态性和RNA-seq分析,以鉴定耐盐甘薯品系ND98和盐敏感品种lizixiang在盐胁迫下的差异表达基因(DEG)和IbBBX24在两种种质之间差异表达。为了研究IbBBX24在非生物胁迫耐受中的潜在作用,我们在耐盐甘薯背景ND98中进行了qRT-PCR分析,以确定其在各种胁迫条件下的相对转录物丰度。用NaCl、PEG6000和H2O2处理1h后,IbBBX14的表达分别快速诱导了2.35倍、6.03倍和3.05倍,然后逐渐减少(图1a)。
在IbBBX24的2067 bp启动子区中鉴定了各种非生物胁迫响应元件
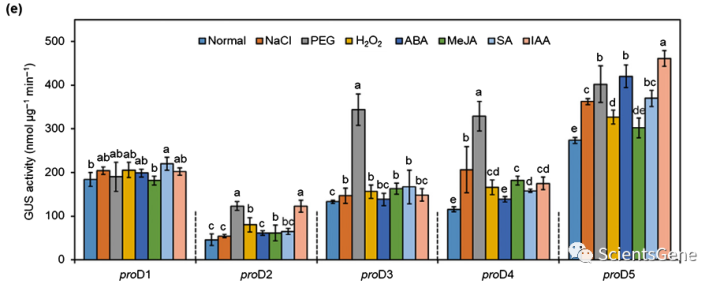
,包括冷和脱水响应元件(例如LTR、C-repeat/DRE和MBS)、抗氧化响应元件ARE、MeJA响应元件CGTCA基序和SA响应元件W1盒(图1b)。然后,我们产生携带5个50个IbBBX24启动子片段(proD1至proD5)的转基因烟草植株,并测量由相应启动子片段控制的GUS活性(图1b,c)。在1个月龄的幼苗中,所有启动子片段都驱动叶片、茎和根中的GUS活性(图1d)。353 bp proD5片段在所有组织中表现出比其他缺失片段更高的启动子活性(图1d),并且在叶片中被NaCl、PEG6000、H2O2、ABA、SA和IAA处理显著诱导(图1e)。这些结果表明,IbBBX24及其启动子是由非生物胁迫诱导的。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
3.2 IbBBX24的过度表达增强了盐、干旱和氧化耐受性
我们使用了20个过表达系(OE-B1至OE-B20)和6个RNA干扰(RNAi)系(Ri-B1至Ri-B6),这些是在我们之前的研究中产生的,以研究IbBBX24对甘薯非生物胁迫耐受的贡献。
我们在体外培养期间对所有20个IbBBX24 OE系、6个IbBBX24 RNAi系和WT的表型进行了表征。当单独在MS培养基上生长时,体外生长的IbBBX24 OE系与WT系无法区分,但在含有86mM NaCl或30%PEG6000的MS培养基中表现出比WT植物更强的生长和生根(图2a;表S2)。IbBBX24 OE系,特别是OE-B3、OE-B12、OE-B15和OE-B16系的鲜重、POD活性、SOD活性和脯氨酸含量高于WT和IbBBX14 RNAi植物,而MDA含量较低,表明过表达系的氧化应激量较低(表S2)。所有转基因和WT植物在转移到温室或田间的土壤中后显示出100%的存活率。
Fig. 2a
我们选择了8个IbBBX24 OE系和2个IbBBX24 RNAi系进行进一步表型分析。与WT一起,我们在单独(正常)或含有86mM NaCl(高盐度)或30%PEG6000(模拟干旱胁迫)的半强度Hoagland溶液中种植插条。在对照条件下,所有插条的生长和生根均正常(图2b;表S3)。然而,当暴露于NaCl或PEG时,过表达系OE-B3、OE-B12、OE-B15和OE-B16产生新的叶和根,而其余四个IbBBX24 OE系存活;相比之下,WT和IbBBX24 RNAi系死亡(图2b;表S3)。
Fig. 2b
盐和干旱胁迫会导致植物的氧化损伤。暴露于MV会产生ROS,从而模拟氧化应激。我们在移栽箱中培育了四个IbBBX24 OE系(OE-B3、OE-B12、OEB15和OE-B16,它们对NaCl和PEG处理表现出最强的耐受性)、两个IbBBX24 RNAi系(Ri-B1和Ri-B3)和WT,并使所有植物经受200mM NaCl、干旱胁迫或MV处理。在正常条件下,我们观察到生长或生根没有显著差异(图2c)。与WT植物相比,IbBBX24 OE系在盐度、干旱和MV胁迫下表现出更好的生长和生根以及更高的FW和DW,而IbBBX14 RNAi系比WT植物更早变黄和死亡(图2c,S1)。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2c
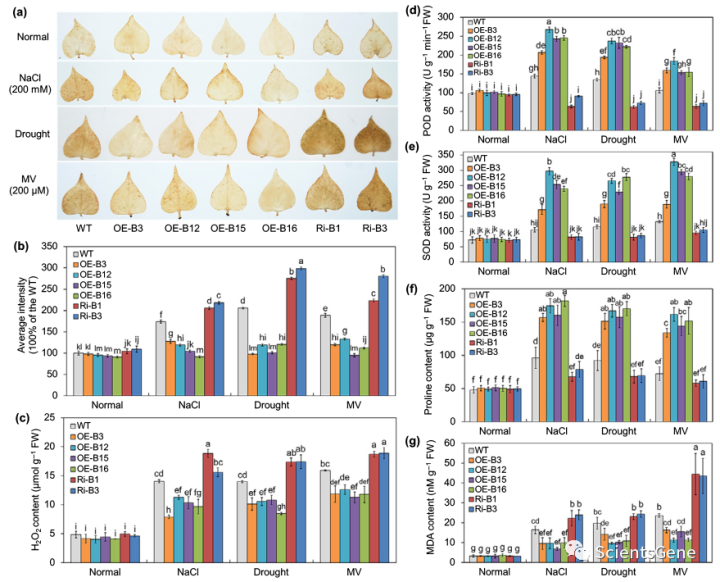
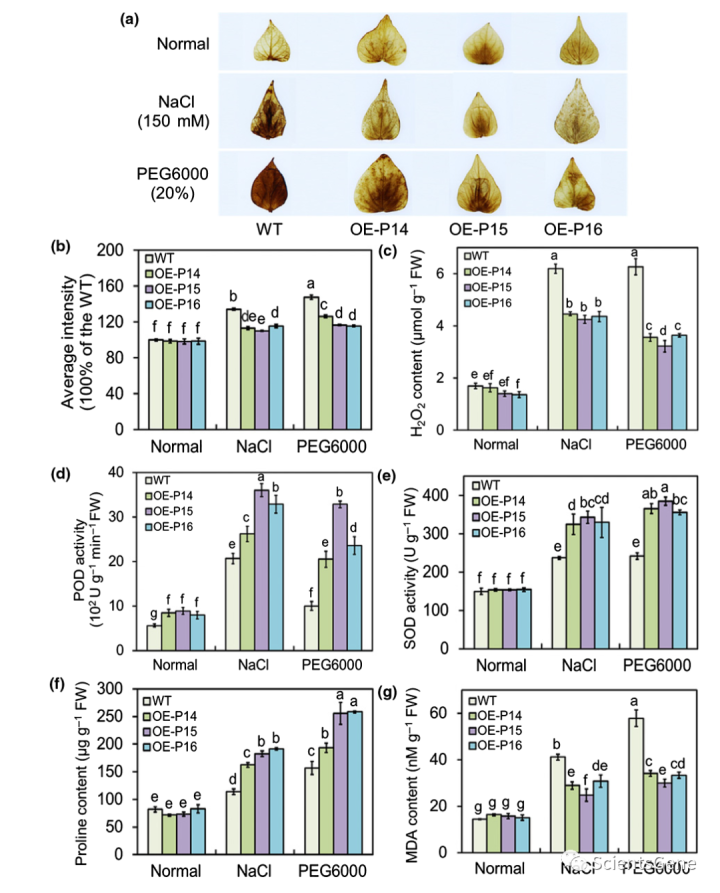
在盐度、干旱和MV胁迫下,DAB染色和H2O2浓度测定表明,IbBBX24 OE系比WT系积累更少的H2O2,而IbBBX14 RNAi系产生更多的H2O2;在对照条件下生长时,转基因和WT植物之间没有显著差异(图3a-c)。此外,在暴露于应激后,我们测量到IbBBX24 OE系中的POD和SOD活性、脯氨酸含量以及MDA含量高于WT系。相比之下,IbBBX24 RNAi系在各自的生理指标上遵循相反的模式(图3d–g)。这些结果表明,过表达IbBBX24激活了盐敏感品种lizixiang的ROS清除系统并增强了非生物胁迫耐受性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.3 IbBBX24调节ROS清除相关基因的转录
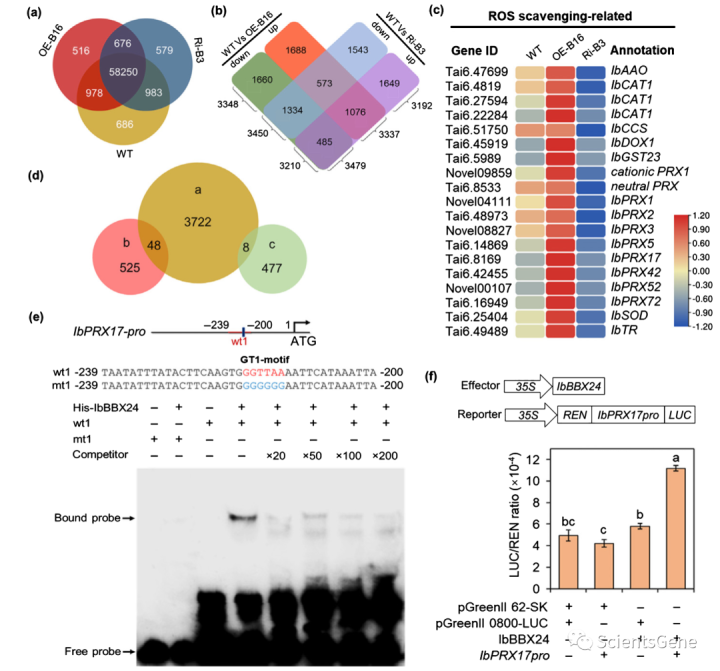
为了探索IbBBX24介导的非生物胁迫耐受的分子机制,我们对用86 mM 的NaCl处理的lizixiang(WT)和IbBBX14转基因的植物(OE-B16和Ri-B3)进行了RNA序列分析。我们检测到58250个基因在过表达系OE-B16、RNAi系Ri-B3和WT中的表达(图4a),其中10 008个基因受到差异调节(阈值为FDR<0.05)。我们在OE-B16系中鉴定了3337个上调和3479个下调基因,在Ri-B3系中鉴定出3210个上调和3350个下调基因(图4b)。此外,超过1000个基因在IbBBX24过表达和RNAi系之间显示出差异效应,其中573个基因在OE-B16系中上调,但在Ri-B3系中下调,另外485个基因在暴露于盐胁迫时在OE-B16系中下调但在Ri-B3系中上调(图4b;表S4)。
我们使用GO数据库对之前描述的573个基因进行功能注释和分类。基因本体富集分析确定,这些DEG在诸如离子结合(GO:0043167)、蛋白质结合(GO:0005515)、氧化还原过程(GO:0055114)、氧化还原酶活性(GO:0016491)、基因表达调节(GO:00010468)、刺激反应(GO:00050896)、离子通道活性(GO-0005216)、钾离子转运(GO:0006813)、,和防御反应(GO:0006952)(图S2)。参与ROS清除的基因,如PRXs、CATALASE、谷胱甘肽过氧化物酶、谷肽转移酶(GST)和SOD,在OE-B16系中上调,但在Ri-B3系中下调,与盐胁迫下的WT相比(图4c;表S4)。氧化应激诱导细胞膜损伤,抑制光合器官的功能,并通过降低细胞内钾(K+)浓度破坏细胞内离子稳态。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
在盐胁迫下,与WT相比,参与ABA信号传导、渗透调节、信号转导和离子转运的基因以及其他非生物胁迫响应基因在OE-B16系中显著上调(特征是ROS浓度较低),而在Ri-B3系中下调(ROS含量较高)(图S3a-d;表S4)。与这些结果一致,在盐、干旱和MV胁迫下,与WT相比,IbBBX24 OE系的ABA含量、光合速率、气孔导度、蒸腾速率和相对Chl含量较高,而IbBBX14 RNAi系则较低(图S4a-e)。盐胁迫下,与WT和IbBBX24 RNAi系相比,IbBBX14 OE系的钠(Na+)含量较低,而K+含量和K+∶Na+比率较高(图S4f–h)。这些数据表明,IbBBX24影响甘薯中与ROS清除和相关途径相关的基因转录和生理代谢反应。接下来,我们进行qRT-PCR来分析非生物胁迫响应基因的表达水平。IbBBX24、ROS清除相关基因IbPRX17、IbSOD、脯氨酸生物合成相关基因IpP5CR(吡咯啉-5-羧酸还原酶)、ABA生物合成相关的基因IbNCED(9-CIS-环氧类胡萝卜素二氧化酶)、光合作用相关基因IbpsbA(编码光系统II蛋白D1)、IbBBX24 OE系中的IbPRK(磷酸肌激酶)和离子转运蛋白基因IbNHX(钠/氢交换)高于暴露于高盐度、干旱和MV胁迫下的WT和IbBBX14 RNAi植物(图S5)。
3.4 IbPRX17由非生物胁迫诱导,其蛋白动态定位
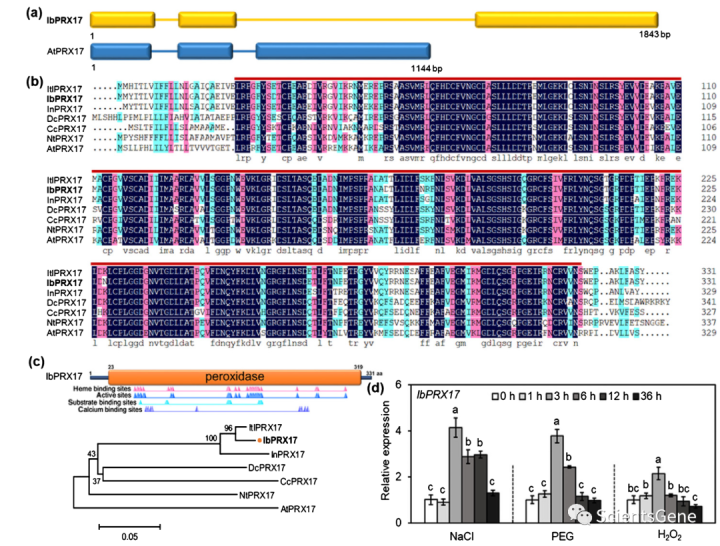
IbPRX17的1843 bp基因组序列由三个外显子和两个内含子组成,与拟南芥PRX17外显子-内含子模式相似(图5a)。IbPRX17的996 bp开放阅读框(ORF)编码331个氨基酸的蛋白质,预测分子量为36.75 kDa,等电点(pI)为4.43,结合和催化功能。系统发育分析表明,IbPRX17最接近甘薯二倍体野生亲本Ipomoea triloba L.(2n=2x=30)的ItlPRX17和拟南芥PRX17(图5c)。此外,与IbBBX24一样,NaCl(4.13倍)、PEG6000(3.77倍)和H2O2(2.14倍)显著诱导IbPRX17(图5d)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
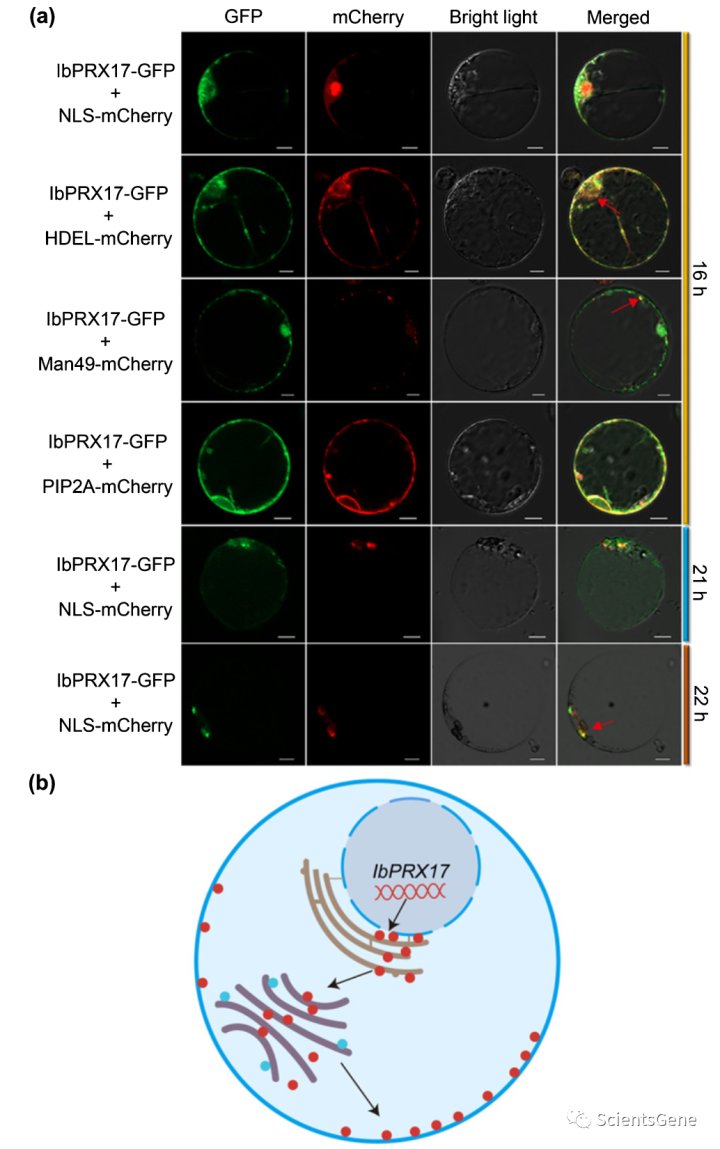
这些结果表明,IbBBX24可能通过IbPRX17介导的氧化应激保护增强非生物应激耐受性。接下来,我们通过瞬时共转染表达IbPRX17 GFP的构建体以及原生质体中细胞核、ER、高尔基体和质膜的各种标记物,研究了IbPRX17的亚细胞定位。共转染16小时后,IbPRX17 GFP与ER、高尔基体和膜标记物共定位(图6a)。共感染21小时后,可在细胞核中观察到IbPRX17 GFP的部分信号(图6a)。该观察表明IbPRX17是动态局部化的。这种蛋白质定位于内质网,在内质网中,它可以被包装成囊泡,然后输出到高尔基体和细胞膜,随后部分蛋白质从细胞质重新定位到细胞核(图6b)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
3.5 IbPRX17的过度表达增强了对盐和干旱胁迫的耐受性
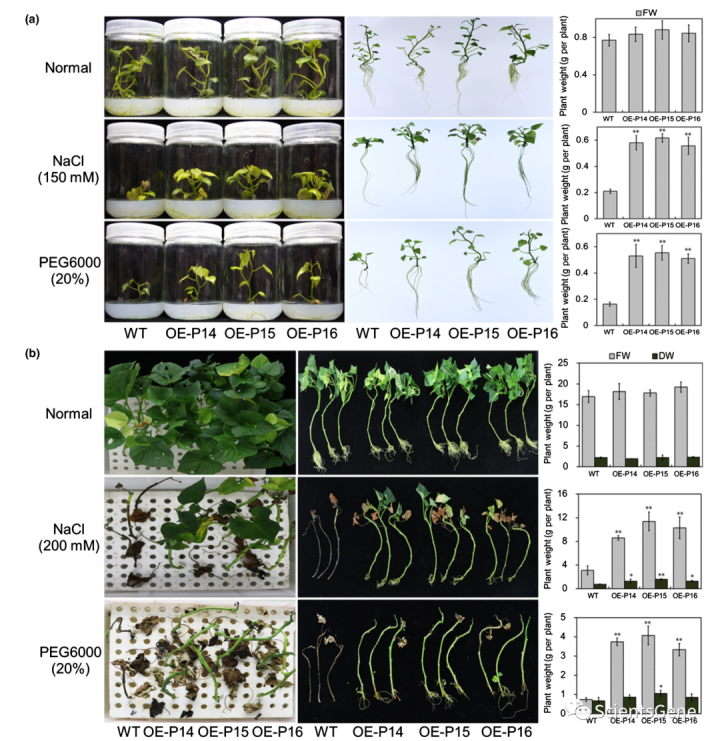
III类PRX在植物胁迫响应中发挥重要作用。然而,CIII PRXs在甘薯对不利生长条件的耐受性方面的功能在很大程度上尚未被探索。为了研究IbPRX17在非生物胁迫耐受中的作用,我们在甘薯中过表达了IbPRX17(图S6),并选择了三个IbPRX27转录丰度较高的品系,通过qRT-PCR(OE-P14、OE-P15和OE-P16;图S6h)进行非生物胁迫耐性测定。当单独在MS培养基上生长时,体外生长的IbPRX17 OE系表现正常,但在含有150 mM NaCl或20%PEG6000的MS培养基中比WT植物生长更大,产生更多的根(图7a)。
我们还将田间生长的IbPRX17 OE系和WT植物的插条暴露于单独或添加200mM NaCl或20%PEG6000的半强度Hoagland溶液中的水培培养中。在对照条件下,所有插条的生长和生根均正常(图7b)。IbPRX17 OE系在PEG处理施加的高盐度和干旱胁迫下表现更好,因为它们产生了新的叶子和根,表现出比WT植物更好的生长和生根,FW和DW更大,WT植物变为棕色,死亡更早(图7b)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 7
此外,在NaCl或PEG存在的情况下,我们测量了IbPRX17 OE品系中的POD和SOD活性和脯氨酸含量,以及H2O2和MDA含量低于WT(图8)。然后,我们通过qRT-PCR测定了IbPRX17过表达植物中非生物胁迫响应基因的相对转录物丰度。当暴露于150mM NaCl或20%PEG6000时,IbPRX17和非生物胁迫响应基因IbSOD、IbP5CR和IbPRK在IbPRX17 OE系中表现出比WT更高的表达(图S7)。综上所述,这些结果表明IbPRX17促进ROS清除,并作为甘薯耐盐和干旱胁迫的积极调节因子发挥作用。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 8
3.6 IbTOE3和IbBBX24之间的相互作用增强了IbPRX17上IbBBX14的激活
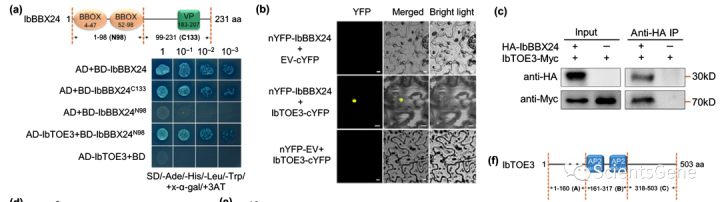
我们还将AP2型转录因子IbTOE3鉴定为推测的IbBBX24相互作用蛋白,并通过Y2H、BiFC和co-IP分析验证了这一结果:IbBBX14通过其N端98个氨基酸与IbTOE 3相互作用,其中包含两个BBX结构域(图9a-c)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 9a-c
IbTOE3的1512 bp ORF编码由两个AP2结构域组成的503个氨基酸蛋白质,预测分子量为55.2 kDa,pI为5.96。IbTOE 3转录物丰度在3个月大的田间生长ND98甘薯植株的茎中最高(图9d)。此外,NaCl(7.0倍)、PEG6000(3.6倍)和H2O2(3.4倍)处理显著诱导了IbTOE3(图9e)。
为了研究IbTOE3是否表现出转录激活活性,我们将编码全长IbTOE 3(BD-IbTOE4)或氨基酸1–160(BD-Ib TOE3A)、161–317(BD-Ib-TOE3B,包含两个AP2结构域)或317–503(BD-IbTOE3C)的四个片段克隆到GAL4 DNA结合pGBKT7载体中;将所得构建体单独引入酵母细胞。含有BD-IbTOE3或BD-IbTOE3A的酵母菌落在缺乏Trp、His、Ade且含有X-a-gal的SD培养基上生长并变为蓝色(图9f)。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 9d-f
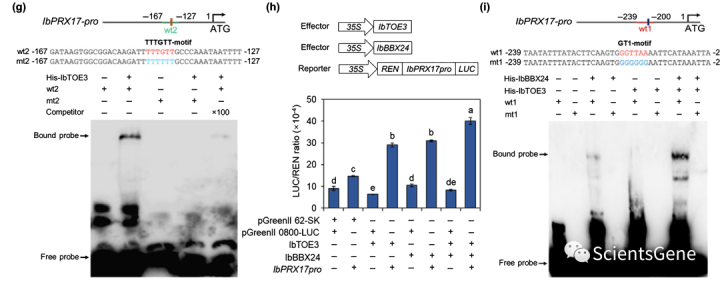
这些结果表明IbTOE3是一种转录激活物,并且转录激活域位于蛋白质的前160个氨基酸内。APETALA2与拟南芥中的TTTGTT或AACAAA序列特异性结合。我们在IbPRX17启动子中鉴定了一个典型的TTTGTT基序(图9g),促使我们通过EMSA测试IbTOE3与IbPRX17启动子的该基序的结合。IbTOE3通过该TTTGTT基序直接与IbPRX17启动子结合,并且结合被过量的未标记探针竞争。此外,将TTTGTT基序突变为TTTTTT可消除IbTOE3与IbPRX17启动子探针的结合(图9g)。
总的来说,这些数据表明转录激活物IbTOE3与IbBBX24相互作用,并通过与IbPRX17启动子中的TTTGTT基序结合而成为IbPRX27的上游调节物。
我们在原生质体中进行了瞬时双荧光素酶分析,以研究IbBBX24和IbTOE3如何影响IbPRX17的表达。荧光素酶活性分析表明,IbBBX14和Ib TOE3分别激活IbPRX27的表达,并且在很大程度上,在一起激活时(图9h)。
我们使用EMSA进一步剖析IbBBX24和IbTOE3调节IbPRX17转录的分子机制。添加IbBBX24后,IbTOE3与IbPRX17启动子中TTTGTT基序的结合强度没有变化(图S8)。添加IbTOE3显著增强了IbBBX24与IbPRX17启动子GT-1基序的结合(图9i)。总之,这些结果表明IbBBX24与IbTOE3相互作用,并且IbTOE 3的存在增强了IbBBX14对IbPRX17的激活。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 9g-i
3.7 IbTOE3在耐盐和干旱胁迫中发挥积极作用
AP2 TF在植物的发育过程和应激相关反应中发挥着各种作用。然而,IbTOE3在植物非生物胁迫耐受中的作用尚不清楚。为了确定IbTOE3的过度表达是否影响植物对非生物胁迫的耐受性,我们产生了过度表达IbTOE 3的转基因烟草,并用盐或干旱胁迫对其进行胁迫。
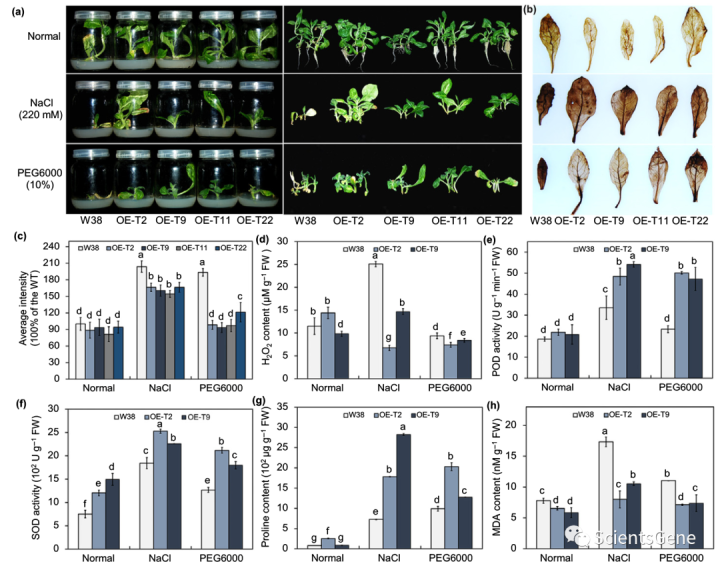
当在含有220 mM NaCl或10%PEG6000的MS培养基上生长时,体外生长的IbTOE3 OE植物显示出比WT W38更好的生长(图10a)。3,30-二氨基联苯胺染色和H2O2测量也表明,在胁迫开始后,IbTOE3 OE系比WT W38系积累的H2O2更少,但在对照条件下生长时没有(图10b-d)。
此外,与W38相比,我们测量了IbTOE3 OE系中较高的POD和SOD活性以及脯氨酸含量和较低的MDA含量(图10e–h)。然后我们分析了WT和IbTOE3 OE烟草中非生物应激反应基因的表达水平。当暴露于220 mM NaCl或10%PEG6000时,与W38相比,非生物胁迫响应基因IbTOE3、NtPRX、NtSOD和NtP5CS(编码吡咯烷-5-羧酸合成酶)在IbTOE 3 OE系中的表达更高(图S9)。
综上所述,这些结果表明,IbTOE3是一种对盐和干旱胁迫耐受性的积极调节器,可能是通过增加植物中的ROS清除。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 10
04
结论
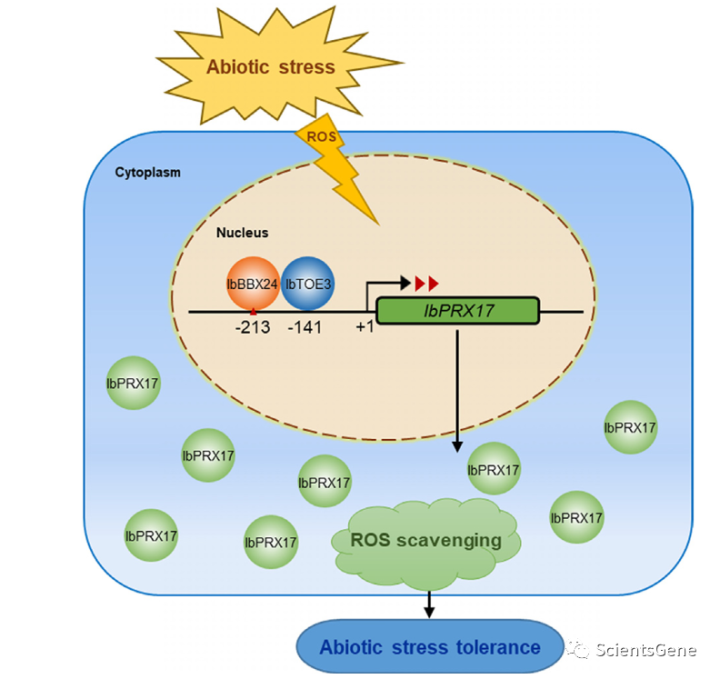
总之,我们确定了赋予甘薯非生物胁迫耐受性的正调控机制,该机制由IbBBX24及其伴侣IbTOE3通过促进IbPRX17的转录和其他非生物胁迫反应相关途径介导(图11)。BBX和AP2蛋白的结合亲和力,以及它们与PRX相互作用以调节非生物反应,尚未得到广泛研究。这些基因在消除非生物胁迫条件下ROS积累方面起着主导作用,并有可能提高甘薯和其他植物的非生物胁迫耐受性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 11
05
获取原文
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.17860
PDF获取:
https://www.scientsgene.com/h-nd-117.html#_np=107_423
文末附件。
赛思基因www.scientsgene.com致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。

![[附源码]Python计算机毕业设计SSM临港新片区招商引资项目管理系统的设计与实现(程序+LW)](https://img-blog.csdnimg.cn/04b74db8709f4e3c9ee49536cb8557b4.png)