越来越多的研究表明,“禁食”不仅与免疫系统调控 、血糖调节有关,还对多种疾病的治疗有改善效果,如心血管疾病和癌症等。
这里的“禁食”与节食不同,一般指的是间歇性禁食,包括多种方案,例如 FMD (Fasting-mimicking diet),即模拟禁食,是一种周期性对摄入卡路里、蛋白、碳水化合物进行限制的禁食方案;周期性禁食 (Periodic fasting) 是定期禁食,禁食期间仅提供水。
近日,意大利 IRCCS Ospedale Policlinico San Martino 的 Alessio Nencioni 和 FIRC Institute of Molecular Oncology 的 Valter D. Longo 团队合作在 Nature 发表了题为 “Fasting-mimicking diet and hormone therapy induce breast cancer regression” 的研究论文,为“禁食疗法”增强抗癌作用再添一锤!
摘要:
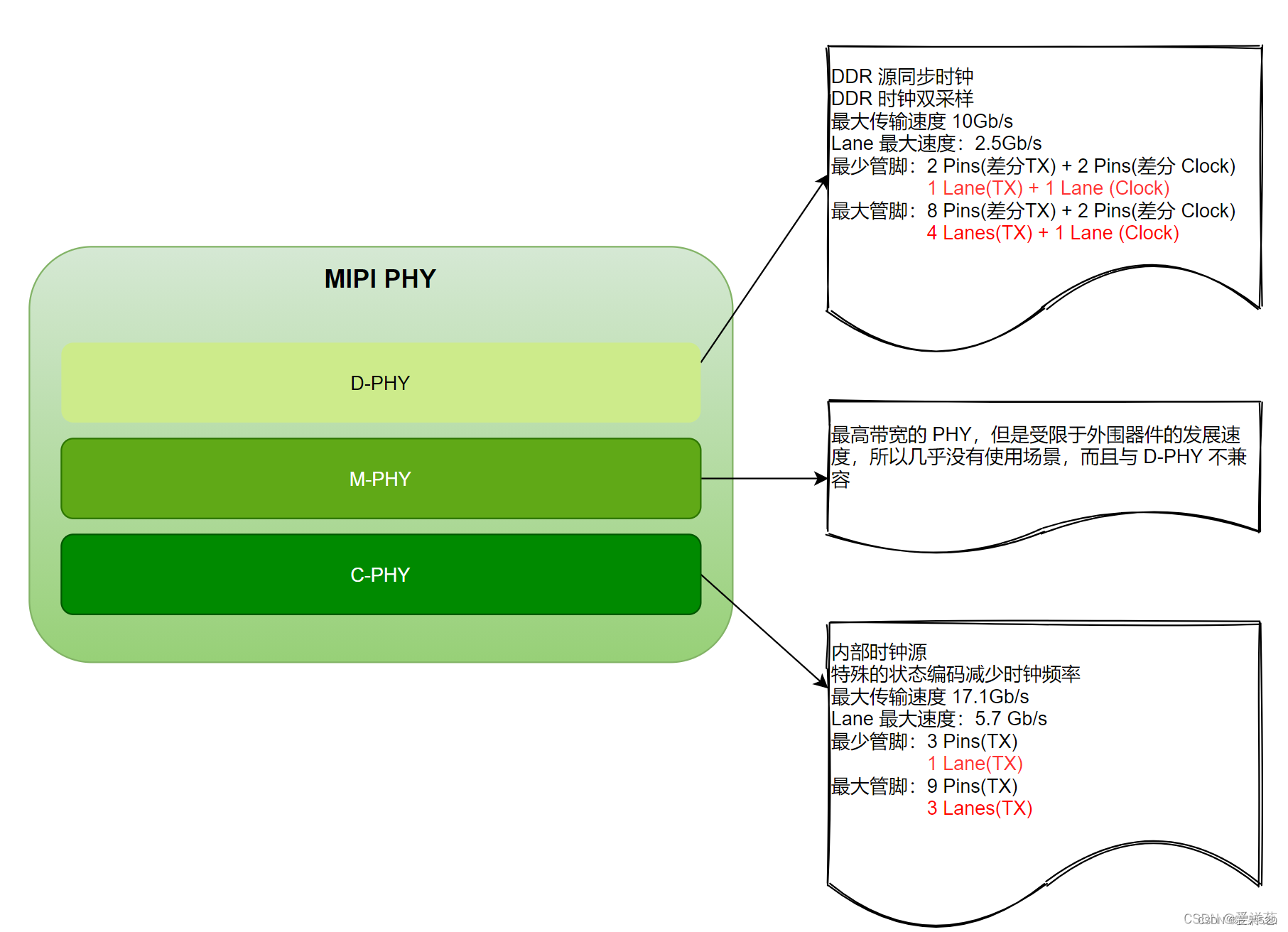
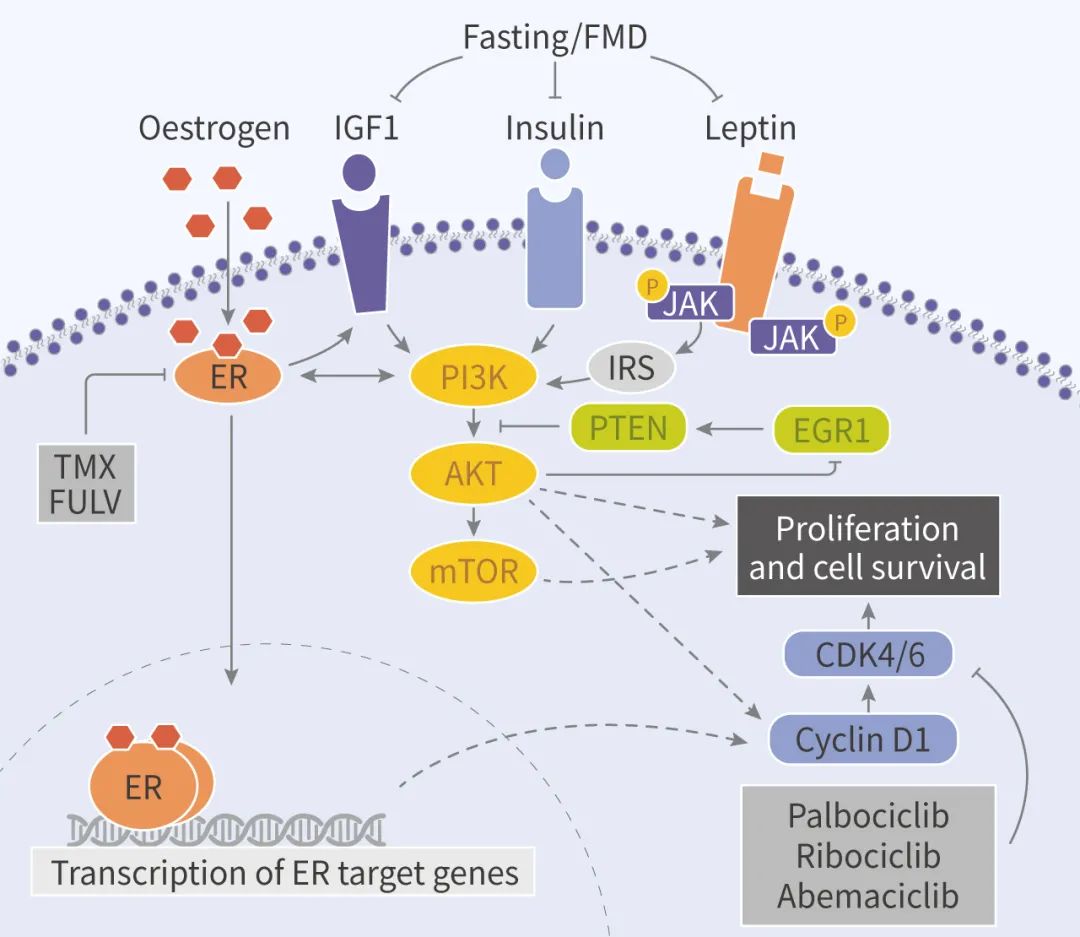
在激素受体阳性 (HR+) 乳腺癌小鼠模型中,周期性禁食或 FMD 通过降低血液循环系统中的胰岛素样生长因子 (IGF1)、胰岛素 (Insulin) 和瘦素水平,以及上调 EGR1 和 PTEN 来抑制 AKT-mTOR 信号,增强了雌激素疗法 Tamoxifen 和 Fulvestrant 的效果。另外,当联合使用 Fulvestrant 和 CDK4/6 抑制剂 Palbociclib 时,加入 FMD 能促进肿瘤长期消退,并逆转药物治疗产生的获得性耐药性。而且,周期性禁食/FMD 都能够防止 Tamoxifen 诱导的子宫内膜增生。临床和临床前研究均支持了 FMD 作为 HR+ 乳腺癌雌激素治疗的辅助疗法。
IF=42.778
背景
1. 大约 75% 的乳腺癌表达雌激素和/或孕激素受体。内分泌治疗通常对这些激素受体阳性肿瘤有效,但原发性和获得性耐药性限制了其长期疗效。
2. 生长因子通过 PI3K-AKT-mTOR-MAPK 轴增强雌激素受体活性,也是构成乳腺肿瘤雌激素治疗抵抗的基础。
3. 饮食限制能减少血液循环系统中生长因子水平,如胰岛素和 IGF1。
因此,作者团队推测饮食限制能增强雌激素疗法 (Endocrine therapy, ET) 的活性并延缓雌激素治疗抵抗。
研究方法
■ 细胞&小鼠模型
细胞系:MCF7、ZR-75-1 和 T47D HR+/HER2- 乳腺癌 (BC) 细胞
小鼠模型:MCF7 肿瘤异体移植小鼠模型
■ 主要方法
免疫印迹;定量 PCR;ELISA 分析;流式细胞仪进行细胞周期分析;萤光素酶报告基因检测;基因表达谱和功能分析;免疫组化;基因表达微阵列和基因集富集分析 (GSEA);CT 扫描
研究结果
1、FMD 改善雌激素疗法
模拟禁食增加激素治疗药物他莫昔芬 (Tamoxifen) 和氟维司群 (Fulvestrant) 在细胞中的抗肿瘤活性,同种细胞系小鼠异种移植模型的周期性禁食 (下面全部以“禁食”的说法代替“周期性禁食”) 或 FMD 结果一致。
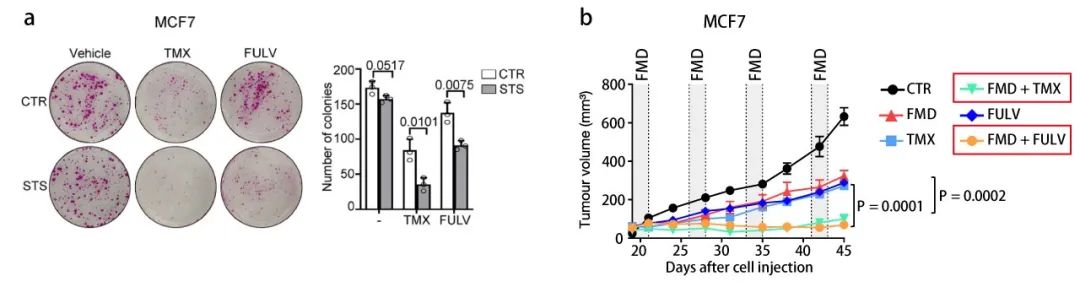
【a:细胞实验;b:肿瘤移植小鼠实验;CTR: Control;TMX: Tamoxifen;FULV: Fulvestrant;FMD:模拟禁食;STS:短期饥饿,即短时间低血清,低葡萄糖细胞培养条件】
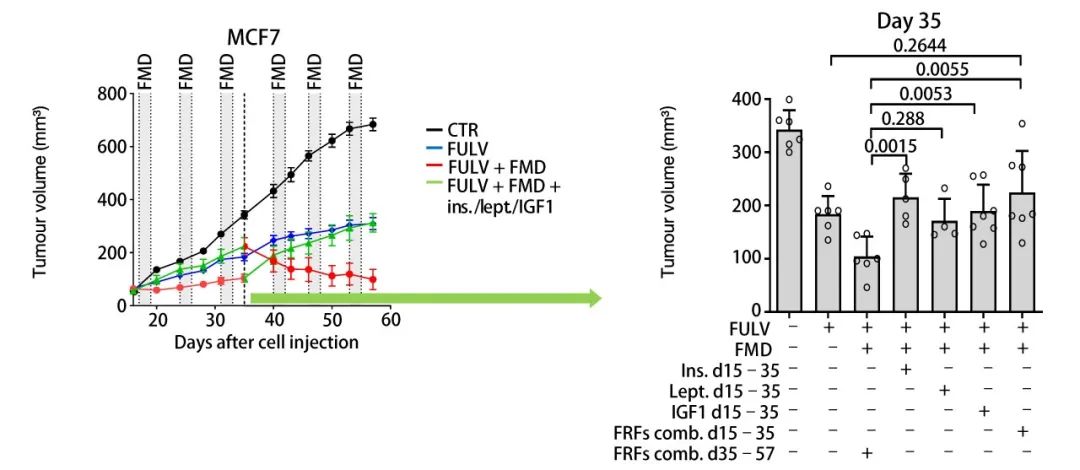
另外,他们还发现了禁食/FMD 会降低 IGF1 的生物利用度,禁食/FMD 联合雌激素疗法会降低瘦素 (Leptin) 水平 (瘦素能作为 HR+ 乳腺癌发育的生长因子,降低雌激素疗法效果)。
已知生长因子能降低雌激素疗法效果,基于以上实验结果,补充胰岛素、瘦素和 IGF1 作为禁食削减因子 (FRFs),逆转了小鼠中 Fulvestrant+FMD 的抗肿瘤增强效果,与其细胞实验结果一致。
2、PI3K-AKT-mTOR 轴
为什么 FRFs 的减少能够增强雌激素疗法抗肿瘤活性呢?已有文献报道,胰岛素的降低提高了各种癌症中 PI3K 抑制剂的活性,以上的结果与之一致。FRFs 补充组 (FRFs 在第 35 天撤销) 小鼠离体肿瘤中,AKT 和 p70S6K (mTOR 的靶点) 的磷酸化降低。HR+ 乳腺癌细胞或类器官中,STS 和 FMD 联合雌激素疗法可以上调 PTEN (AKT-mTOR 信号通路的负调节因子) 的表达。
在众多 PTEN 表达增强因子中,重点关注早期生长应答因子 EGR1。已有报道 EGR1 的表达与乳腺癌患者良好的预后有关,它在禁食后组织中上调。
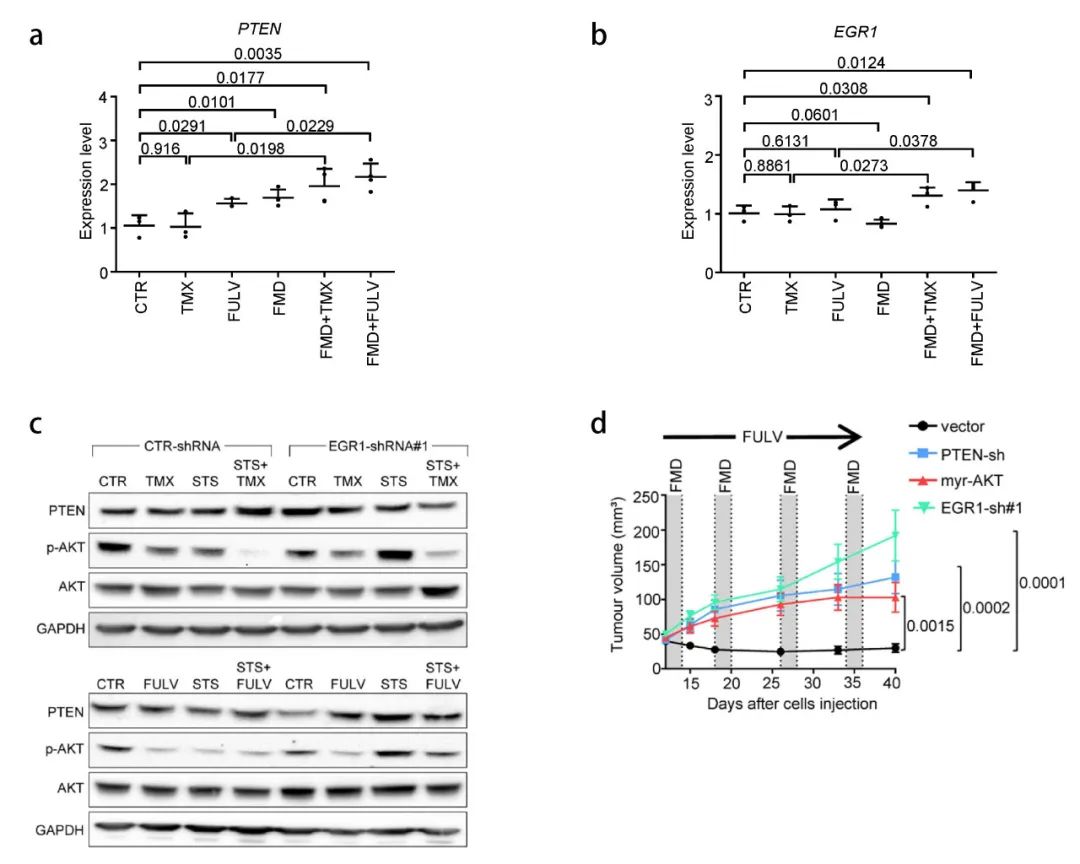
【a-b: PTEN 和 EGR1 在雌激素疗法+STS/FMD 小鼠离体肿瘤中的水平;c:Tamoxifen+STS (上),Fulvestrant + STS (下) 处理的 MCF7 细胞中,EGR1 沉默;d:在小鼠中分别移植 PTEN、EGR1 沉默和组成型激活 AKT 的 MCF7 细胞】
雌激素疗法+STS/FMD 处理后,HR+ 乳腺癌细胞、类器官和离体肿瘤中的 EGR1 水平增加,EGR1 沉默阻止了雌激素疗法-STS 诱导的 PTEN 积累和 AKT 抑制作用,降低了雌激素疗法+STS/FMD 的抗肿瘤活性。AKT 抑制剂 (GDC0068、AZD5363)、PI3K 抑制剂 (LY294002)、PTEN 的沉默和组成型激活 AKT 的表达 (myr-AKT) 又拮抗了 EGR1 沉默的作用。
3、雌激素受体的活性
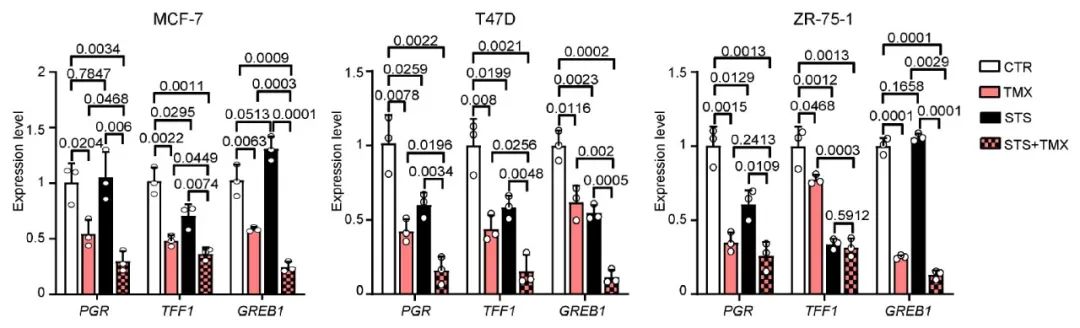
雌激素受体活性对 HR+ 乳腺癌细胞的存活和增殖至关重要,胰岛素,IGF1 和瘦素可增强雌激素受体活性。STS 不仅降低了雌激素受体依赖的转录,还增强了 Fulvestrant 和 Tamoxifen 介导的雌激素受体抑制,降低雌激素受体靶基因 TFF1,PGR 和 GREB1 的表达水平。因此,STS 和雌激素疗法也协同抑制雌激素受体的活性。
4、FMD+Palbociclib+Fulvestrant 的抗肿瘤效果
首先,通过 GSEA 发现以及细胞实验验证,EGR1 的上调和 AKT 抑制通过雌激素疗法+STS 介导 CCND1 的下调,并因此导致细胞周期停滞。
作者团队推测,利用 CDK4/6 抑制剂帕博西尼 (Palbociclib,In vivo 实验所用购自 MedChemExpress) 下调 CCND1,联合雌激素疗法和 FMD 可能会产生额外的治疗益处。在携带原位 MCF7 异种移植物的小鼠中,FMD 或者 Palbociclib 联合 Fulvestrant 能够延缓但不能避免 Fulvestrant 抗性的产生,而三者联合处理,不仅能在 160 天内抑制肿瘤生长,还能诱导肿瘤缓慢而稳定地收缩。
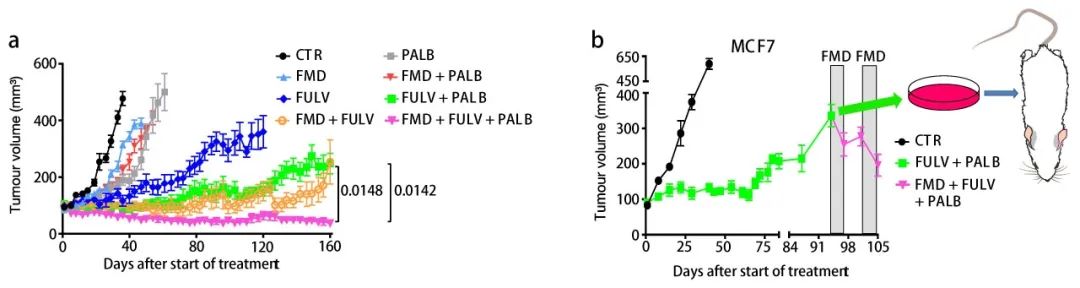
另外,小鼠剖检实验发现 Tamoxifen 联合禁食/FMD 组的子宫比单独使用 Tamoxifen 组小,禁食/FMD 降低 Tamoxifen 诱导的小鼠子宫内膜增生,以及雌激素受体活性和 AKT 激活。最后,禁食/FMD 与 Tamoxifen 协同作用减少小鼠的腹腔内脂肪。
5、FMD 对疾病控制和 FRF 的影响
作者团队还对 HR+ 乳腺癌患者进行了定期 FMD 和雌激素疗法的组合试验,发现 FMD+Fulvestrant+Palbociclib 在患者中表现出良好的临床效果,降低了血糖、血清 IGF1,瘦素和 C 肽,同时增加循环系统中的酮体,而且瘦素和 IGF1 长期处于较低水平。MCF7 细胞异体移植小鼠模型中也观察到了类似的结果。另外,雌激素疗法+FMD 预处理后接种肿瘤细胞也能减缓 MCF7 异种移植物的生长。
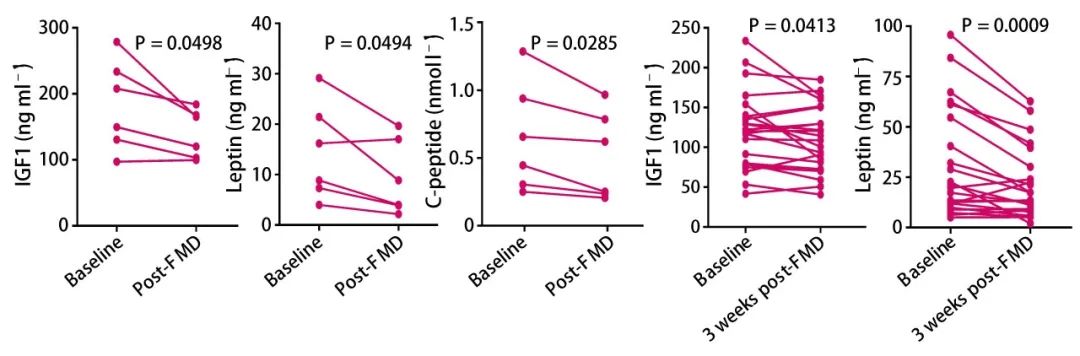
总之,定期禁食或 FMD 会增加 Tamoxifen 和 Fulvestrant 的抗癌活性,并且与 Fulvestrant 和 Palbociclib 联合使用,会使肿瘤缓慢消退,并逆转处理对象对这两种药物的获得性耐药。禁食或 FMD 增强雌激素疗法抗肿瘤活性的关键原因可能是血液胰岛素,IGF1 和瘦蛋白的降低,从而抑制了 PI3K-AKT-mTOR 途径。雌激素疗法+FMD 降低瘦素和 IGF1 的作用持续到 FMD 期之后,并与移转抗癌活性相关。该研究也证实了周期性的 FMD 具有潜在的预防癌症的作用。
这项研究结果为 FMD 改善 HR+ 乳腺癌的临床疗效和用于胰岛素、IGF1 或瘦蛋白缺乏症敏感的其他癌症的研究提供了支持。
| 相关产品 |
| Tamoxifen |
| 口服有效的,选择性雌激素受体 (ER) 调节剂 (SERM),可阻断乳腺细胞中的雌激素作用,并可激活其他细胞,如骨骼,肝脏和子宫细胞中的雌激素活性。 |
| Fulvestrant |
| 抗雌激素,也是一种有效的雌激素受体 (ER) 拮抗剂,能有效抑制 ER 阳性 MCF-7 细胞的生长,还可诱导细胞自噬 (autophagy) 和凋亡 (apoptosis),具有抗肿瘤功效。 |
| LY294002 |
| 广谱 PI3K 抑制剂,抑制 PI3Kα, PI3Kδ 和 PI3Kβ 的 IC50 分别为 0.5, 0.57, 0.97 μM。 |
| Pipendoxifene hydrochloride |
| 选择性的雌激素受体 (ER) 调节剂,可用于乳腺癌的研究。 |
| Kaempferol |
| 在乳腺癌细胞中抑制雌激素受体 α (ER α) 表达,可用于乳腺癌研究。 |
| Raloxifene hydrochloride |
| 选择性且具有口服活性的雌激素受体 (ER) 调节剂。 |
| Ospemifene |
| 雌激素受体 (ER) 调节剂,对 ERα 与 ERβ 的 Ki 值分别为 380 nM 和 410 nM 。 |
原文阅读:DOI: 10.1038/s41586-020-2502-7