提到免疫,总会让人联想到由免疫失调引起的疾病,例如病毒感染,自身免疫病类风湿性关节炎,癌症等。实际上,机体的免疫应答受到严格的调控,并存在多种机制预防对自身蛋白的免疫反应。
在过去的 20 年中,已发现多种细胞外“检查点分子” (免疫检查点),如 CTLA-4、PD-1、LAG-3、TIM-3,它们不仅调节 T 细胞对机体自身蛋白的反应,也在慢性感染和肿瘤中起作用。

免疫检查点在机体内起着复杂的制衡作用,它们组成了维持自身耐受和协助免疫反应的抑制和刺激途径,刺激途径可促进 T 细胞的激活,以及效应、记忆和调节性 T 细胞反应。抑制途径则抑制 T 细胞激活,并具有调节炎症、耐受性和体内平衡多种作用。
T 细胞刺激途径和抑制途径取决于两种信号:
信号 1:抗原特异性信号,由肿瘤细胞或肿瘤浸润性 APCs (抗原呈递细胞) 上的 pMHC (主要组织相容性复合物) 呈递的肽抗原与 TCR 结合产生,将细胞外结合事件转化为高度协调的细胞内信号级联反应。
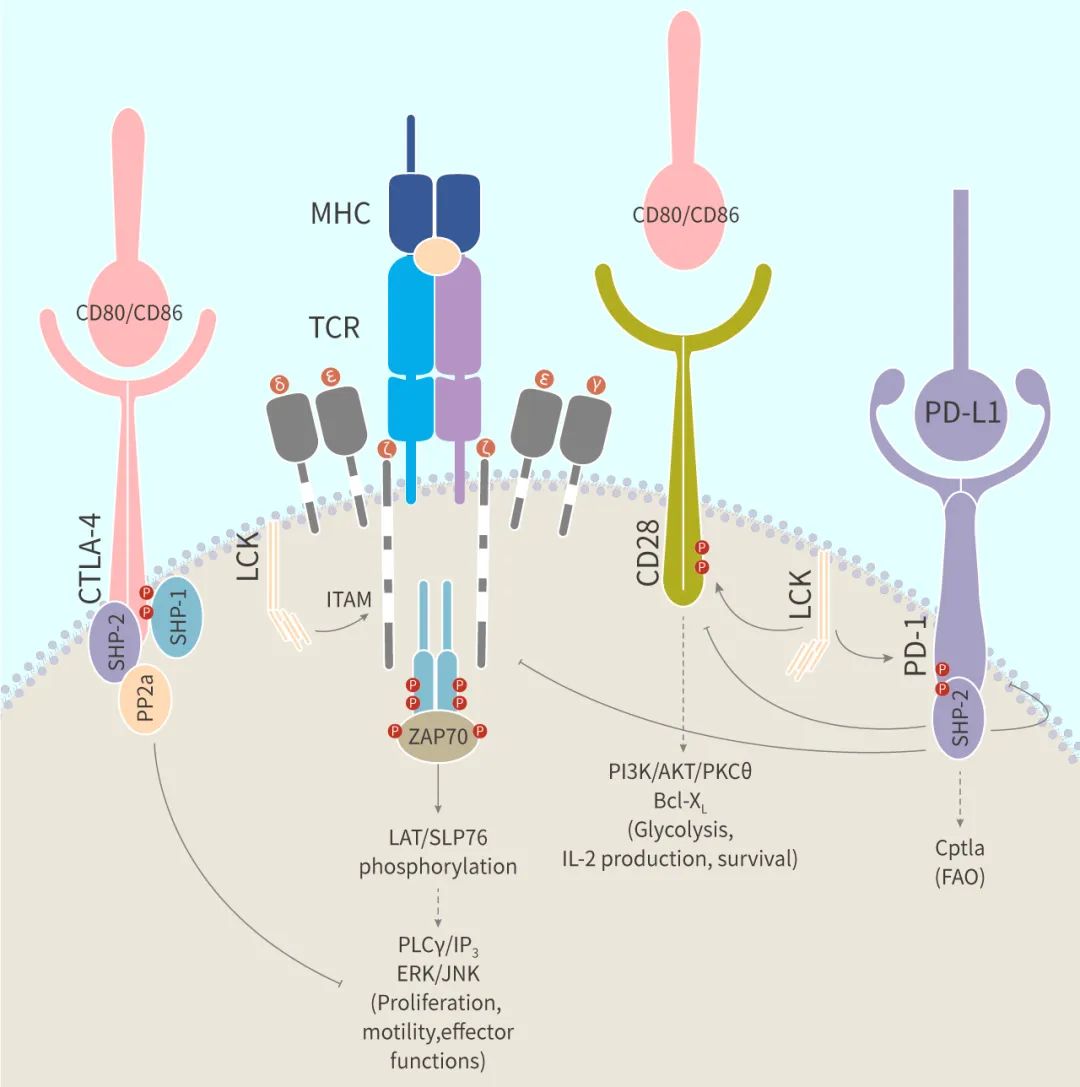
TCR 包含与配体结合的可变 TCRαβ 异二聚体,以及信号转导亚基 CD3γ、CD3δ、CD3ɛ 和 CD3ζ,它们包含基于免疫受体酪氨酸的激活基序 (ITAM)。pMHC 与 TCR 结合后,通过 Lck 诱导 CD3ζ 亚基的 ITAM 磷酸化,然后触发包括 ZAP70 活化和 LAT (接头蛋白) 的磷酸化信号转导事件,最终激活 ERK、JNK 等途径,并涉及到多个细胞过程,例如增殖、分化、运动、应激反应、细胞凋亡和存活。此时,T 细胞还需要第二种共刺激信号才能摆脱这种 T 细胞无能状态 (Anergy)。
信号 2:抗原非特异性信号,具体分为共刺激信号和共抑制信号,而免疫检查点又是重要的共刺激和共抑制受体/配体。
共刺激信号,以典型的 APC 表面配体 CD80 (B7-1)/CD86 (B7-2) 和 T 细胞表面的共刺激性受体 CD28 作用为例:CD28 与 CD80/CD86 结合产生,并激活共刺激下游通路如 PI3K/AKT,T 细胞被激活。T 细胞被激活后,机体会阻止 T 细胞持续活化。
同样,T 细胞活性减弱也受到两种信号的调控。一种还是上述的信号 1,另一种是共抑制信号,即当 T 细胞激活后,T 细胞开始表达共抑制信号,如 CTLA-4 和 PD-1。和 CD28 一样,CTLA-4 也结合 CD80 或 CD86,不过亲和力更高。CTLA-4 与 CD80 或 CD86 的结合能抑制共刺激,并阻止持续的 T 细胞活化,切断 TCR 和 CD28 下游信号通路。和 CTLA-4 与 CD28 竞争模型不同,PD1 与配体 PD-L1 结合会直接抑制 TCR 受体信号。
具体来说,PD1 在 PD-L1 结合后,PD-1 细胞质尾部的两个酪氨酸残基也被磷酸化,SHP-2 (或 SHP-1) 被募集到 PD-1 的 ITSM (基于免疫受体酪氨酸的开关基序) 处,导致 TCR 和 CD28 近端信号分子 (如 ZAP70、PKCθ) 去磷酸化,最终抑制 TCR 信号以及共刺激下游信号传导,如 PI3K/Akt 和 Ras/MAPK/ERK 通路,导致糖酵解和氨基酸代谢的下调以及促进脂肪酸氧化。
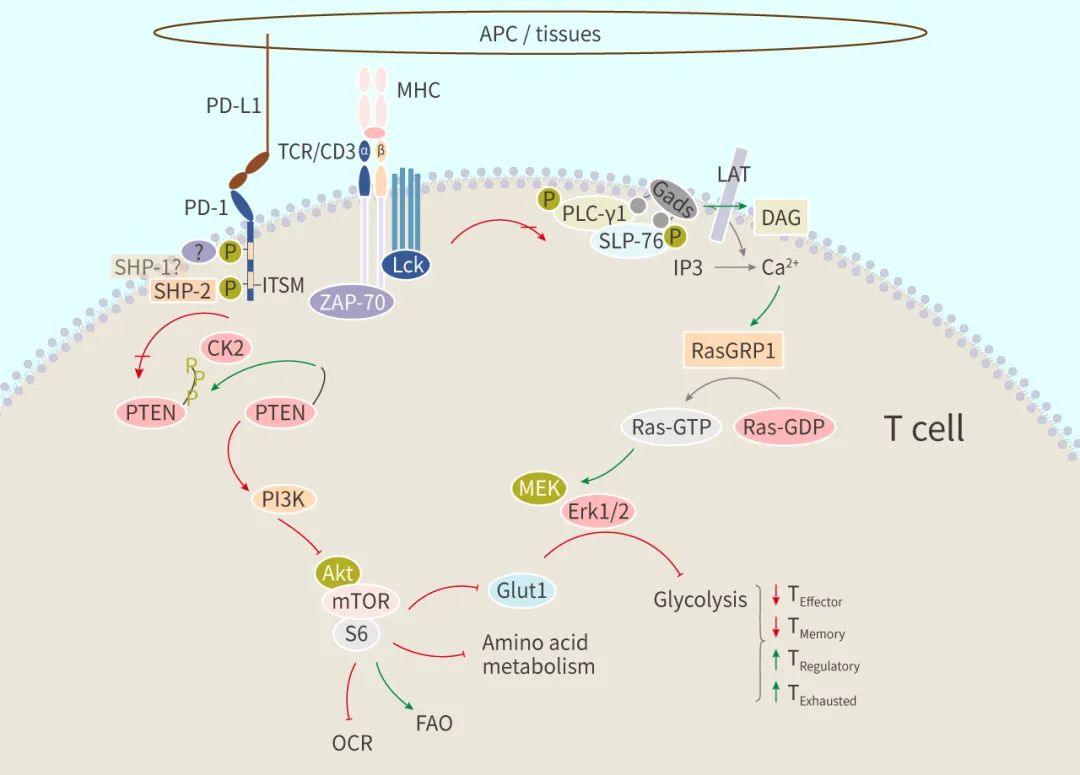
在癌症中,癌细胞通过不同的机制来逃避免疫监视,包括激活抑制抗肿瘤免疫反应的免疫检查点途径。例如,PD-L1 经常在肿瘤或肿瘤微环境中表达,以 PD-1/PD-L1 为靶标的抑制剂能使肿瘤部位的 T 细胞恢复活力。
在过去十几年中,基于 PD-1/PD-L1 和 CTLA-4 开发的抑制剂已经在癌症治疗中取得巨大成功,如 PD-1 抑制剂 Nivolumab (纳武利尤单抗/纳武单抗)、Pembrolizumab (帕博利珠单抗) 和 CTLA-4 抑制剂 Ipilimumab (伊匹单抗)。因此,靶向免疫检查点可以说是免疫肿瘤学领域的革命性里程碑。
CTLA-4 和 PD-1/PD-L 是目前研究最广泛的抑制性检查点途径,通过阻断免疫检查点来治疗恶性肿瘤的研究已经扩展到 CTLA-4 和 PD-1/PD-L1 之外,如 LAG-3、TIM-3、TIGIT、VISTA、B7/H3 等抑制性检查点和 OX40、ICOS、GITR、4-1BB、CD40 等刺激性检查点的靶向药物正处于研发阶段。
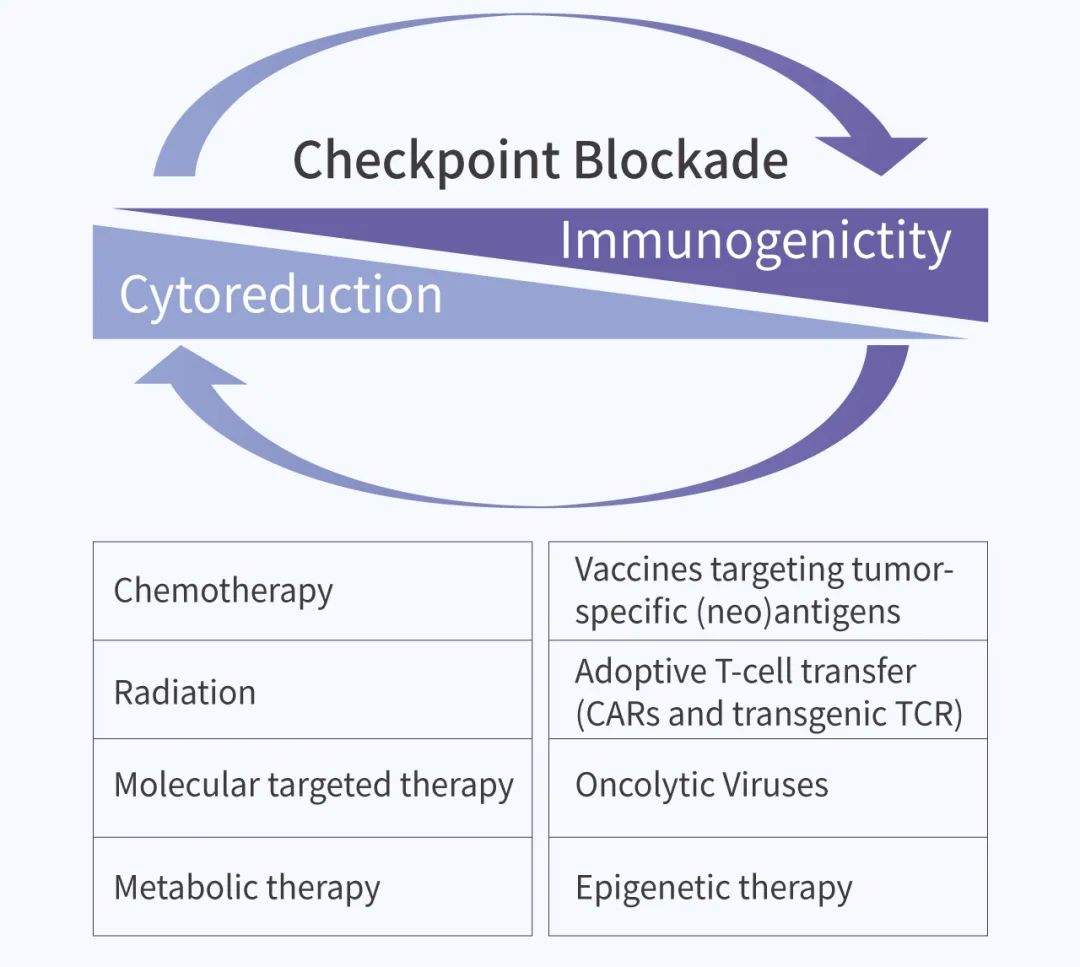
大量证据表明,在一些肿瘤和慢性感染中,多个免疫检查点分子在 T 细胞上共表达 (如 PD-1 常与其他免疫检查点分子的共表达)。因此,除了靶向单个的免疫检查点外,基于免疫检查点的组合治疗也显示出优越的抗肿瘤活性。例如,分子靶向疗法和靶向免疫检查点的组合治疗,在结直肠癌中 MEK 抑制剂 (如 Cobimetinib) 与 PD-L1 抑制剂联合治疗,在非小细胞癌中进行 KRAS 抑制剂 (如 AMG 510) 与 PD-1/L1 抑制剂联合治疗等。即使免疫检查点治疗显示出有效的抗肿瘤活性,但一些通过免疫检查点治疗介导的不良事件也不容忽视。
总之,随着新的免疫抑制剂,新的免疫检查点以及合理的联合策略的发现,免疫疗法将会带来更快、更好的癌症治疗效果。
| 相关化合物 | 抑制剂及其作用机制 |
| 免疫/炎症化 合物库 | 收录了 1600+ 种免疫炎症相关产品,可以用于免疫炎症研究及自身免疫炎症疾病的药物开发 |
| 肿瘤免疫小分子 化合物库 | 收录了 200+ 种生物活性肿瘤免疫化合物,用于高通量筛选 (HTS) 和高含量筛选 (HCS) |
| 抗癌症 化合物库 | 收录了 3900+ 种抗肿瘤化合物,主要靶向激酶、细胞周期调控的关键蛋白,肿瘤发生相关的信号通路等,是筛选抗肿瘤药物的有用工具 |
MCE 的所有产品仅用作科学研究,我们不为任何个人用途提供产品和服务
参考文献
1. Nirschl C J, et al. Molecular pathways: coexpression of immune checkpoint molecules: signaling pathways and implications for cancer immunotherapy. Clin Cancer Res.2013;19(18):4917-4924.
2. Sharpe A H. Introduction to checkpoint inhibitors and cancer immunotherapy. Immunol Rev. 2017;276(1):5-8.
3. Marin-Acevedo JA, etal. Next generation of immune checkpoint therapy in cancer: new developmentsand challenges. J Hematol Oncol. 2018;11(1):39. Published 2018 Mar15.
4.Chen L, et al. Molecular mechanisms of T cellco-stimulation and co-inhibition [published correction appears in Nat RevImmunol. 2013 Jul;13(7):542]. Nat Rev Immunol. 2013;13(4):227-242.
5. Philip M, et al. Heterogeneity and fate choice:T cell exhaustion in cancer and chronic infections. Curr Opin Immunol.2019;58:98-103.
6. Havel J J, et al. The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Nat Rev Cancer.2019;19(3):133-150.
7. Bardhan K, et al. The PD1:PD-L1/2 Pathway fromDiscovery to Clinical Implementation. Front Immunol. 2016;7:550.Published 2016 Dec 12.
8. Darvin P, et al. Immune checkpoint inhibitors:recent progress and potential biomarkers. Exp Mol Med. 2018;50(12):1-11.Published 2018 Dec 13.
9. Zappasodi R, et al. Emerging Concepts forImmune Checkpoint Blockade-Based Combination Therapies [published correctionappears in Cancer Cell. 2018 Oct 8;34(4):690]. Cancer Cell. 2018;33(4):581-598.
10. Qin S, et al. Novel immune checkpoint targets:moving beyond PD-1 and CTLA-4. Mol Cancer. 2019;18(1):155.Published 2019 Nov 6.