蛋白质是组成生物细胞、组织的重要成分,生物的所有生命活动都离不开蛋白质的参与。蛋白质是生命的物质基础,是构成细胞的基本有机物,是生命活动的主要承担者。生物材料中蛋白质含量的测定是生物学研究中最重要也是最基本的实验操作之一,目前常见的测定方法有考马斯亮蓝法(Bradford法)、紫外吸收法、双缩脲法(Biuret法)、Folin-酚试剂法(Lorry法)、二喹啉甲酸法(BCA法)和凯式定氮法(Kjedahl法)等。每种方法原理不同,操作不同,都有其优点和局限性。
本文介绍的是考马斯亮蓝法,即Bradford法测定蛋白质的相关内容,它是通过染色方法测定溶液中蛋白质浓度的方法,是目前迅速可靠且灵敏度最高的蛋白质测定方法之一。
实验原理:
Bradford蛋白质测定法是根据蛋白质与染料结合的原理设计的。考马斯亮蓝染料(G-250)在酸性溶液中与蛋白质的碱性氨基酸和芳香族氨基酸残基结合,使得染料的最大光吸收峰位置由原来的465nm变为595nm,溶液颜色也由原来的棕红色变为蓝色,反应迅速且稳定,形成的化合物颜色深浅在一定范围内与蛋白质浓度成正比关系,因此可通过测定结合染色后溶液在595nm处的光吸收度值来计算溶液中蛋白质的含量。

通过分光光度计先测定已知浓度的标准蛋白溶液染色后在波长595nm的吸光度A595并绘制标准曲线,然后测定同样染色后的待测蛋白溶液在波长595nm的吸光度值,根据标准曲线即可计算出待测蛋白质的浓度。
实验器材:
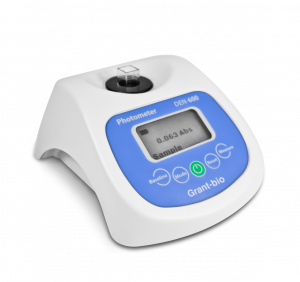
- 分光光度计(例如点成DEN-600小型光度计)
- 涡旋混匀器
- 试管及试管架
- 塑料/玻璃比色皿
- 微量移液器
主要溶液/试剂:
- 标准蛋白质溶液:可用牛血清白蛋白(BSA)作为标准蛋白。配制成1.0mg/ml的标准蛋白质溶液,4℃存放。
- 考马斯亮蓝G250染料试剂:称取100 mg考马斯亮蓝G250,溶于50mL的95%乙醇后加入120mL 85%的磷酸,最后加入去离子水将试剂稀释到1L。
- 待测蛋白溶液
实验操作:
- 制取不同浓度的标准蛋白溶液:可取普通洁净的试管7支,1号管取放0.1mL去离子水作为空白组,2-6号用微量移液器分别加入1.0mg/mL的BSA溶液0.02、0.04、0.06、0.08、0.10mL,然后每管均用去离子水补充到0.1mL,另外7号试管取放待测蛋白溶液0.1mL,所有试管用涡旋混匀器充分混匀;
- 加入染色试剂:用移液器或者移液管向上述试管分别加入3.0mL考马斯亮蓝G250试剂,用涡旋混匀器轻轻快速混合均匀;
- 比色:考马斯亮蓝试剂与蛋白质结合速度快,2-5分钟即可完成,1小时内保持稳定,故可以在溶液静置5分钟后在分光光度计上测定各试管溶液在波长595nm处的光吸收值A595;
- 比色时使用的比色皿最好选用玻璃或者塑料比色皿,不要使用石英或者硅胶比色皿,因为考马斯亮蓝染料容易结合附着于石英或硅胶材料上,不易洗去染色。
- 比色完成后及时用水清洗,再用40%乙醇润洗,洗去颜色,最后再用水洗净。
- 如果使用的是塑料比色皿,乙醇润洗时间不宜过长,决不能在乙醇或者丙酮中长时间浸泡,因为那会导致塑料比色皿溶胀失真。
- 制作标准曲线:以标准蛋白溶液浓度(mg/mL)为横坐标,吸光度值A595为纵坐标作图,可进行直线拟合,即可得到一条标准曲线;
- 计算待测蛋白质浓度:将分光光度计测出的待测蛋白质溶液的光吸收度A595值,对照标准曲线即可算出待测蛋白质浓度。
点成DEN-600光度计, 是一款紧凑、便携、可电池供电的光度计,可以方便地放置在生物安全柜、培养箱中,该设备可容纳10mm光程的标准比色皿、普通圆底试管或离心管等。USB连接和DEN软件可进行数据传输、数据处理和计算。600 nm波长光学系统设计可以进行如下测量:估算细胞总数(OD600)、浊度测量(McFarland单位)、蛋白质浓度测量(Bradford 蛋白质测定法)。分光光度计通常应用于这些领域,因此DEN-600可作为分光光度计的平价替代品。



![【C++】重载运算符+-=>/*[]==++-- MyString 智能指针(* ->)](https://img-blog.csdnimg.cn/71604cfea51243ed9fb573052c90645c.png)