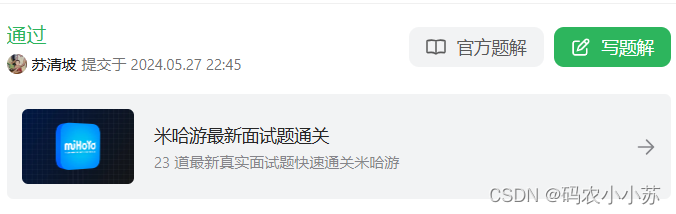
人类微生物群构成了一个复杂的多王国群落,与宿主在多个身体部位共生相互作用。宿主-微生物群的相互作用影响多 种生理过程和各种多因素的疾病条件。在过去的十年中,微生物群落被认为会影响多种癌症类型的发展、进展、转移 形成和治疗反应。虽然微生物对癌症生物学的影响的因果证据才刚刚开始被揭示,但增强对这种与癌症调节的相互作用和对癌症治疗的影响的分子理解被认为具有重要的科学重要性和临床相关性。
微生物群生态位和癌症
据估计,人体中有3万亿个细菌成员,它们协调了生理过程和疾病易感性的综合相互作用。虽然有类似数量的细菌细胞与人类细胞在体内,但100倍的细菌遗传多样性编码杰出的机械和代谢能力,不仅影响自己的微生物生态位,而且影响着宿主组织和免疫细胞功能。除了细菌外,人类的微生物群也由真核真菌和原生动物和病毒组成。总的来说,在健康条件下,宿主及其微生物群作为一种元生物共生存在,通过提供一个营养丰富的微环境,以帮助消化和代谢。众所周知,肠道、皮肤和口腔微生物群具有高度丰富多样的微生物群;然而,阴道微生物群也得到了充分的研究,但其多样性较低,具有高度特异性和优势微生物成员。此外,随着下一代测序技术(NGS)的出现,肺、前列腺、膀胱、乳房、肝脏和胰腺、等器官和组织现在被确定为潜在的低生物量微生物种群。然而,这些微生物群的确切性质是否是来自于共生位点特异性种群,还是代表着从邻近地点进行的短暂迁移仍在争论之中。
癌症的一般发展和进展被认为具有多种可区分但互补的和经常重叠的特征。通过维持增殖、逃避细胞生长抑制、激活侵袭和转移途径,使复制免疫、诱导血管生成和抵抗自噬,癌细胞有效地增殖和逃避免疫系统。虽然这些过程已经被广泛研究了几十年,但微生物组对癌症发展、进展和治疗反应的潜在影响直到最近仍然难以捉摸。在疾病场景中,每个微生物生态位(如图1所示)可能通过改变微生物组配置的社区交互影响癌症促进(也称为“生态失调”)或通过分泌或调节代谢物。生态位特异性微生物群对癌症的影响可以通过口腔微生物群对口腔癌症(口腔鳞状细胞癌[OSCC])、结肠(结肠直肠癌)和胰腺(胰腺导管腺癌[PDAC])的调节来证明。同样,男性和女性盆腔器官的微生物群对泌尿系统具有重要影响和妇科,包括前列腺癌、宫颈、子宫内膜、卵巢和膀胱。
促癌微生物
目前,只有11种生物(7种病毒、3种扁形虫和1种细菌)被正式认定为人类癌症的独特原因:eb(EBV)(HBV)乙型肝炎和丙型肝炎(HCV)病毒;卡波西肉瘤病毒(KSV);人类免疫缺陷病毒1(HIV);人类乳头瘤病毒(HPV);人类T细胞淋巴病毒1型(HTLV);华氏睾吸虫;华支睾吸虫;血吸虫;和幽门螺杆菌。总的来说,这些微生物通过多种机制导致癌症进展,包括诱导B细胞分化,破坏细胞周期的决心,和免疫过度激活(EBV HBV,HCV和艾滋病毒感染),T细胞失调(EBV和HTLV感染),和直接肿瘤发生引起的肝炎病毒和KSV肝细胞癌和卡波西肉瘤,分别。KSV和HPV一样,通过直接参与致癌蛋白有效减少细胞凋亡。这三种致癌的扁形虫与胆管癌、肝细胞癌、膀胱癌以及S。血液病,通过诱导慢性炎症导致氧化应激和DNA毒性。
癌症相关细菌
尽管国际癌症研究机构(IARC)认可的致瘤微生物名单在微生物和微生物组研究方面取得了进展,但最近的研究表明,除了幽门螺杆菌,数十种微生物可以调节或促进癌症。这类微生物群相关致癌物的显著例子总结如下,并在图2中详细描述。
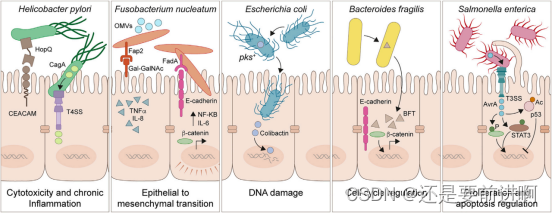
图2。微生物对上皮细胞肿瘤过程的影响是微生物对癌症相关上皮细胞通路影响的几个标志。幽门螺杆菌通过外膜粘附素HopQ结合CEACAM与胃上皮细胞结合,通过T4SS将毒力因子CagA直接注入胃上皮细胞。CagA激活Wnt/b-连环蛋白通路,导致细胞周转和凋亡失调。核梭菌可能通过多种途径引发癌症。毒力因子如FadA粘附素允许细胞内化和诱导NF-kB和IL-6介导的促炎级联反应。Fap2是另一种重要的粘附素,它与肿瘤表面的d -半乳糖-b (1-3)- n -乙酰- d -半乳糖胺(Gal-GalNAc)碳水化合物相互作用,通过Wnt/b-catenin途径促进细胞增殖,增加促炎细胞因子的产生,参与EMT,是癌细胞侵袭、转移、干性和耐药的重要特征。致病性大肠杆菌具有一系列与致病性相关的毒力因子和毒素,包括分泌的基因毒素大肠杆菌素。一旦被宿主细胞内化,它就会诱导链间交联和双链DNA断裂,伴随着促肿瘤细胞转化和在多种癌症基因组中检测到的突变特征。Enterotoxigenic B. fragilis (ETBF)编码BFT,其靶向肠细胞紧密连接,导致E-cadherin的裂解。因此,这增加了肠道通透性,通过NF-kB信号和活性氧增加的组织损伤诱导慢性肠道炎症,导致结直肠癌。肠链球菌3型分泌系统(T3SS)驱动细胞内注射毒力因子,如多功能效应物AvrA,通过激活Wnt/b-catenin激活引发的细胞增殖促进肿瘤形成。MAPK和AKT通路的进一步激活对于维持肿瘤细胞转化至关重要。
幽门螺旋杆菌
幽门螺杆菌是一种公认的致癌物,年龄标准化发病率为每年每10万人8.7例,在世界上超过一半的人口中可检测到。总的来说,H。幽门螺杆菌通过干扰调节细胞周转和凋亡的Wnt/b-链瘤通路,导致消化性溃疡、胃癌和粘膜相关淋巴组织(MALT)淋巴瘤。幽门螺杆菌通过科雷亚途径可以间接影响癌症的发展,通过慢性炎症反应由招募多形核中性粒细胞和侵袭单核淋巴细胞,通过白细胞介素(IL)-1B、肿瘤坏死因子(TNF)a和干扰素(IFN)Y促炎信号刺激Th1型反应。H. 幽门螺杆菌通过外膜粘附素HopQ与癌胚抗原相关细胞粘附分子(CEACAM)结合,附着于胃上皮细胞,然后通过4型分泌系统(T4SS)直接注射到上皮细胞中。在胃上皮细胞中,它与致癌的SHP2磷酸酶和PI3K相互作用,从而表明H。幽门螺杆菌在上皮细胞的肿瘤转化中起直接作用。
核粒梭菌
在进行探索性研究,以确定结直肠肿瘤中存在的细菌。发现了核粒梭菌的转录本。CRC肿瘤组织中的核素水平是匹配的健康组织的400倍,表明与OSCC相关的口腔病原体也可能影响远处身体部位的癌症。此外,核粒梭菌核素与肝转移相关,进一步扩大了其在癌症中的应用潜力。核粒梭菌核体通过FadA粘附素与宿主上皮细胞和内皮细胞结合,从而允许病原体的细胞内化,诱导核因子(NF)-kB和IL-6介导的促炎级联,以及可能的途径OSCC细胞的变异。在体外,外膜囊泡(OMV)产生F。核状体通过结肠上皮细胞分泌IL-8和TNFa来刺激炎症。此外,F。核体定位于肿瘤部位,并通过其Fap2半乳糖结合凝集素与d-半乳糖-b(1-3)-n-乙酰d(GalGalNAc)碳水化合物部分和乳腺癌相互作用结合。F.核体也可能有助于上皮间充质转化(EMT),而EMT是癌细胞侵袭、转移、干性和治疗耐药性的一个显著特征。
大肠杆菌
菌株通过诱导炎症、氧化应激和细胞生态位的变化,以及对宿主细胞周期的干扰和操纵,促进癌症的形成。此外,大肠杆菌素是一种由致病性大肠杆菌分泌并由pks致病性岛编码的基因毒素,可在真核上皮细胞中诱导链间交联和双链DNA断裂。此外,大肠杆菌可能通过产生促进细胞增殖和肿瘤生长的生长因子来促进衰老,这在CRC小鼠模型中得到证实和CRC人体活检。值得注意的是,大肠杆菌诱导的DNA损伤反应,以及它对Wnt信号的间接影响(两者都有助于细胞转化)经常在CRC中被观察到。
脆弱杆菌
虽然脆弱杆菌是一种在整个结肠中繁荣的共生体,但肠产毒素脆弱杆菌(ETBF)菌株通过在癌症患者的粪便和粘膜样本中富集,与诱导结肠炎和结肠肿瘤发生有关。ETBF编码金属蛋白酶脆弱拟杆菌毒素(Bacteroides Fragilis Toxin, BFT), BFT通过靶向肠细胞紧密连接,切割E-cadherin,从而增加炎症和肠道通透性,诱发结直肠癌的慢性肠道炎症和组织损伤。此外,Wnt/b-catenin和NF-kB信号以及Th17适应性免疫在这一过程中被激活。从机制上讲,ETBF感染可能通过toll样受体(TLR4)依赖通路中表观遗传和转录调节因子水平的上调,在干性调节中发挥重要作用,从而在体外和体内促进结直肠癌的发生。
肠沙门氏菌
在小鼠模型和细胞感染沙门氏菌期间,MAPK和AKT通路的激活对于维持胆囊癌细胞转化至关重要。3型分泌系统(T3SS)将环调节蛋白样蛋白伤寒毒素和多功能效应物AvrA等效应蛋白转移到靶细胞中,这两种效应蛋白都通过基因毒素介导的突变引发癌症。此外,cyclomodulin样蛋白允许细胞内细菌存活并有利于生态失调,而AvrA促进Wnt/b-catenin和JAK/STAT通路激活、细胞增殖和分化,并增强靶向p53的乙酰转移酶活性,共同驱动细胞周期阻滞和细胞凋亡抑制,导致肿瘤发生。
非细菌性癌症相关微生物
除了细菌外,微生物组中的其他领域,包括病毒组、真菌组和寄生虫组,也可能导致癌症。虽然这些例子如下,但更广泛地描述了病毒的重要贡献、寄生虫和真菌对健康和疾病(包括癌症)的影响在其他地方进行了讨论。
病毒
与细菌微生物组类似,病毒组由98%的噬菌体和2%的真核病毒组成,是一个复杂的共生和致病病毒的集合,存在于出生后1个月的多个身体部位。最近的研究表明,全局病毒组特征可能作为癌症发展的标志物。在肺腺癌活检和100多个肿瘤样本中检测到病毒宏基因组特征,包括口腔、乳腺癌、结肠癌和泌尿生殖系统癌。Cantalupo等人认为,HPV是宫颈癌和其他泌尿生殖系统癌的已知病因,它还与头颈癌和膀胱癌的肿瘤进展相关。在这些病例中,基因表达和突变谱表明HPV可能驱动肿瘤发生,但HPV参与癌症诱导的确切机制仍然难以捉摸。
除真核病毒外,噬菌体也可作为癌症的调节剂。例如,一些噬菌体可能与癌细胞相互作用,下调整合素和其他参与癌变和转移的蛋白质的表达。其他噬菌体,包括梅毒病毒科和肌病毒科,在结直肠癌患者粪便中富集。由于这些噬菌体中的大多数是温带的,因此尚不清楚它们是否代表真正的生物信号,或者是遗传参考数据库中温带噬菌体过度代表性的结果。同样,与对照组相比,在结直肠癌患者的肠道中检测到多种链球菌特异性噬菌体和一种弧菌噬菌体的数量增加。据推测,这些噬菌体的改变可能会启动基因交换,从而实现宿主内的生态适应和社区网络,从而影响癌症。尽管存在这些关联,噬菌体对癌变的直接影响尚未得到证实。病毒、其细菌同伴和真核细胞之间潜在的跨界相互作用的一个优雅的例子,可能与癌症有关,涉及皮肤相关的表皮葡萄球菌,它激活内源性皮肤逆转录病毒成分的表达,进而引发一种促进组织修复的共生特异性T细胞反应。未来几年,类似的微生物机制是否会影响癌症相关过程,可能会成为癌症微生物组研究的令人兴奋的途径。
真菌
越来越多的人认为,一种益生菌群与多种病理有关,包括急性移植物抗宿主病,以及口腔癌和CRC 。14种真菌生物标志物与结直肠癌相关,并与细菌生态失调相关,包括梭杆菌门和马拉色菌属真菌分别在结直肠癌和胰腺癌中富集。从机制上说,马拉塞菌迁移到胰腺,并通过宿主甘露糖结合凝集素与真菌细胞壁结合激活补体级联反应。最近,一种白色念珠菌的生长与胃癌有关,甚至被认为可以预测胃癌。几种推测的机制可能将白色念珠菌与癌症风险联系起来,包括亚硝胺的产生,已知亚硝胺会改变口腔癌的细胞增殖,通过tnf fa和IL-18诱导免疫调节,以及促进肿瘤细胞与上皮细胞的粘附。这些值得未来的机制研究。在稳态和疾病情况下,真菌组和细菌微生物组也可能相互影响及其宿主,例如使用抗生素后真菌恢复,以及真菌-细菌相互作用驱动放射治疗对肿瘤的差异反应在小鼠乳腺癌和黑色素瘤模型中。这些相互作用已经在其他地方进行了回顾;然而,许多与潜在的真菌群对癌症的影响相关的方面在机械上仍然难以捉摸。
寄生虫
除了国际癌症研究机构确认的已知寄生致癌物外(国际癌症研究机构,2009年),寄生体尚未被完全描述为影响癌症发展。寄生菌群成员可能通过诱导促进癌症的生态失调间接调节其他微生物群王国。例如,革兰氏阴性菌,如沙门氏菌、克雷伯氏菌和大肠杆菌,在与血链球菌相关的膀胱癌患者中更为普遍。此外,寄生虫可能通过诱导免疫调节直接调节癌症的发展。例如,除了诱导T调节性细胞活性外,多种寄生虫还可以通过调节tlr和炎性小体诱导先天和适应性免疫反应。相反,寄生虫可能诱导抗肿瘤作用的有益作用,甚至被建议作为癌症治疗的佐剂。这些和其他寄生虫对癌症的贡献值得进一步的机制探索。
微生物群落群落的改变和癌症
除了微生物群中离散的致病或共生成员直接导致癌症发展外,越来越多的人认为,共生细菌群体中更多的全球性干扰,即生态失调,通过各种涉及细菌-细菌相互作用的群落驱动机制,有助于癌症的发展。以口腔为例,暴露于吸烟或饮食变化可引起生态位变化(如pH值改变),从而影响共生居民及其分泌的副产品,从而在人口水平上发生变化。口腔生态失调与龋齿、牙周炎的发病有关和口咽癌(如OSCC) ,并在一定程度上通过机会致病菌的扩张介导,如变形链球菌、具核F.和牙龈P. 。同样,下消化道内微生物组的变化与胃肠道癌症和结直肠癌相关。例如,健康的肠道微生物群通常由乳酸菌、拟杆菌和双歧杆菌等具有代表性的物种组成。crc的特征是梭杆菌、卟啉单胞菌、细小单胞菌、胃链球菌和Gemella的过度代表,表明微生物生态失调。当考虑到肿瘤发生的不同阶段时,这种生态失调的相关性变得更加复杂。Nakatsu等人报道,当结直肠肿瘤从腺瘤发展为癌时,形成了微栖息地,每个微栖息地都有自己的微生物元群落。此外,与邻近粘膜相比,结直肠病变具有疾病特异性微生物组配置,包括口腔相关微生物如梭杆菌的扩展代表。作为另一个例子,健康的阴道微生物组的特点是乳酸杆菌主导的共生生物多样性低。厌氧细菌的生长导致细菌性阴道病(BV),而阴道真菌群成员(如白色念珠菌)的扩张可能导致阴道炎,其特征是局部宿主炎症反应。除了HPV (IARC, 2009), BV还与宫颈癌前病变和上皮内瘤变相关。最近的一项荟萃分析还确定,BV是hpv阳性女性宫颈癌的辅助因素,表明这种生态失调可能在宫颈癌的发病中起着直接和额外的作用。值得注意的是,上述生态失调与癌症的相关性主要是一种关联关系,而不是因果关系。因此,尚不清楚人口迁移是否会导致癌变,或者更确切地说,是新出现的肿瘤的结果。这一重要的区别将成为未来十年癌症微生物组研究的焦点。
本文是文献的直接翻译,而且只展示了文献中的一部分内容,感兴趣的同志可以去看看原文。