小罗碎碎念
2024-05-27|文献速递
接下来打算把人工智能在主流癌种治疗中的应用,每天和大家做一期推送,方便大家了解各自领域最新的一个进展。
因为小罗的课题是鼻咽癌相关的,所以这一期推文就先从人工智能在鼻咽癌中最新的应用开始。

2024-05-27|个人观点分享
在开始今天的文献分享之前,小罗想分享一个昨天刷到的视频——标题是【工作和专业不对口怎么办?北斗三号卫星系统总师给你支招】

视频内容也挺有意思,感兴趣可以直接点开链接看,不过我主要想分享的就是这三句话:
- “我说,你们只要在三十岁之前”
- “你要能搞清楚自己想要什么”
- “太难了”
我今年暑假就要24岁了,不敢说我想明白了整个人生要追求什么,毕竟太远了,未来太多变数。但是硕士期间该干什么,还是有清晰的规划,也时刻关注着自己的状态,以及外部的反馈。
开始写公众号以来,每天都有师兄师姐和老师添加我的微信(也有几个商业领域的,想洽谈未来的商业合作)。目前为止,添加我微信的人,不论备注是否详细,我一律通过,不为别的,就因为我现在要积累资源——资源拿来干嘛——卷学历&赚钱(这俩都是最浅层的规划,拿来做铺垫的,是起点而不是终点)。
一定有人质疑,也可能会有少数人赞同。但是,我可以告诉你,你给出哪个评价由什么决定——由你所在的环境和你的眼界决定。人往高处走,水往低处流。要想走的又快又远,离不开抱团和站队,这俩本质上是一个东西——投资。投资“物”不是最刺激的,也不是最有成就感的,投资“人”才是。
人与人相识,本身就是一场双向的筛选。我是小罗同学,希望我们每天都能见!!
交流群
欢迎大家来到【医学AI】交流群,本群设立的初衷是提供交流平台,方便大家后续课题合作。

一、AI精准医疗助力淋巴瘤预后预测,放射科医生的新伙伴!

文献概述
这篇文章的标题是《Artificial intelligence for diagnosis and prognosis prediction of natural killer/T cell lymphoma using magnetic resonance imaging》,作者是YuChen Zhang, YiShu Deng, QiHua Zou等人,发表于2024年5月21日的《Cell Reports Medicine》期刊上。文章的主要内容是关于使用人工智能(AI)系统和磁共振成像(MRI)技术来辅助诊断和预测自然杀伤/T细胞淋巴瘤(NKTCL)的预后。
文章的主要亮点包括:
- AI系统在MRI图像评估中提供了额外的优势。
- 诊断系统有助于鼻咽部病变的鉴别诊断。
- 预后系统预测NKTCL的预后,并可能协助治疗优化。
研究团队构建并验证了使用人工智能算法和MRI的预测系统,这些系统能够协助对NKTCL进行准确诊断和预后预测,并可能为早期患者的治疗偏好提供指导。
研究背景部分指出,NKTCL是一种独特的非霍奇金淋巴瘤亚型,通常涉及上呼吸道消化道,如鼻咽部,导致其隐匿性发病。NKTCL和鼻咽癌(NPC)在东亚的发病率显著较高,是鼻咽部发生的两种最常见的恶性肿瘤。NKTCL的早期临床表现与NPC相似,但预后和治疗选择不同。文章提到,及时准确的诊断鼻咽部恶性肿瘤有助于早期干预和改善预后。
研究方法部分,研究者使用来自中国9家医院的MRI数据构建了一个两步AI诊断系统,用于检测鼻咽部恶性病变,并区分NKTCL与NPC。此外,他们还开发了一个AI预后系统来预测NKTCL患者的无进展生存期(PFS)。
研究结果部分,诊断系统的模型性能表现良好,内部和外部验证集的准确度、敏感性、特异性、阳性预测值(PPV)和阴性预测值(NPV)均有不错的表现。与放射科医生的比较表明,AI系统的诊断能力在检测恶性病变方面与资深放射科医生相当,在区分NKTCL与NPC方面也显示出较高的准确性。
预后系统方面,使用随机生存森林模型开发的基于放射组学特征(MRI评分)或结合放射组学特征和临床变量(总评分)的预后系统,在预测NKTCL患者的生存结果方面显示出有希望的性能,并且在预测3年PFS和总生存期(OS)方面优于几种临床模型。
文章的结论是,基于AI算法和MRI图像的诊断系统可能有助于鼻咽部病变的辅助诊断,预后系统可能提高预后预测的精确度,并可能为早期NKTCL患者的治疗偏好提供指导。
此外,文章还提到了一些研究限制,包括建模基于回顾性收集,可能存在偏差;预后系统需要手动标记鼻咽部病变,这也可能带来偏差;所有患者均来自中国队列,需要进一步验证其在其他人群中的使用。
最后,文章提到了由研究团队开发的在线分析系统—NAIS(natural killer/T cell lymphoma artificial intelligence system; http://naids.sysucc.org.cn/),这是一个用户友好的网站,帮助临床医生对鼻咽部病变进行放射学诊断,并为NKTCL患者提供预后预测。
重点关注
Figure 1展示了使用人工智能(AI)和磁共振成像(MRI)构建和验证诊断和预后系统的工作流程。
该流程主要分为以下几个步骤:

-
数据收集:研究从9家医院收集了3276名患者的MRI图像数据,这些患者均在治疗前接受了鼻咽部的MRI检查。
-
数据筛选:在收集的3276名患者中,排除了188名不符合标准的患者,包括没有明确病理诊断的、在MRI前进行了活检的、有其他恶性肿瘤史的、MRI图像不包含整个病变的、分辨率不足或层数不一致的患者。
-
AI系统开发数据集:剩下的3088名患者的MRI图像被用于AI系统开发,分为良性与恶性病变的比较(2937例,包括932例良性病变和2005例恶性病变)和NKTCL与NPC的比较(1132例,包括373例NKTCL和759例NPC)。
-
训练和内部验证集:使用SYSUCC的患者数据进行模型的训练和内部验证。训练集(1761例)、内部验证集(373例)和测试集(373例)被用于模型的最佳模型识别和优化。
-
外部验证集:8家其他医院的患者数据(430例)被用作外部验证集,以评估模型的泛化能力。
-
诊断系统的构建与验证:诊断系统通过比较良性病变与恶性病变(SYSUCC训练集516例,内部验证集109例)以及NKTCL与NPC(SYSUCC训练集516例,内部验证集109例)来构建和验证。
-
预后系统的构建与验证:预后系统使用288名NKTCL患者的数据进行构建,这些患者具有完整的基线临床数据。同样,SYSUCC的患者数据用于训练和内部验证,而其他中心的患者数据用于外部验证。
-
放射科医生标注:放射科医生手动标注了用于AI系统开发的MRI图像。
-
模型性能评估:通过比较AI系统与不同资历的放射科医生(住院医生、主治医生和高级医生)的诊断能力,评估了模型的性能。
整个工作流程体现了一个从数据收集、预处理、模型训练与优化、到内部和外部验证的完整AI系统开发过程,旨在提高鼻咽部病变的诊断准确性和NKTCL患者预后的预测能力。此外,流程中特别提到了中山大学肿瘤中心(SYSUCC)在数据集构建和模型验证中的核心作用。
二、 面对异质性:鼻咽癌MRI分割的突破与挑战

文献概述
这篇文章是关于深度学习在磁共振成像(MRI)中鼻咽癌分割的系统评价和元分析。以下是对文章的详细概括:
标题与作者
- 文章标题:深度学习在磁共振成像中鼻咽癌分割的系统评价和元分析
- 作者:Chih-Keng Wang, Ting-Wei Wang, Ya-Xuan Yang, Yu-Te Wu
- 发布日期:2024年5月17日
摘要
- MRI因其卓越的软组织对比度成为NPC的首选诊断工具。
- 文章通过PubMed、Embase和Web of Science数据库的搜索,遵循PRISMA 2020指南,关注使用深度学习(DL)在成人MRI中进行NPC分割的研究。
- 通过数据提取和元分析评估DL模型的性能,主要通过Dice分数衡量。
- 分析包括17项研究,DL模型的综合Dice分数为78%,表明DL模型具有中到高度的分割准确性。
- 研究间存在显著的异质性和发表偏差。
结果
- 通过PRISMA图表展示了详尽的搜索和选择方法。
- 初步搜索得到176项研究,最终17项研究被纳入详细分析。
- 包括的研究采用回顾性方法,涉及7830名个体。
- MRI特征包括不同的磁场强度、序列和制造商。
讨论
- DL模型,特别是CNN,在MRI扫描中提高NPC分割的准确性方面表现出色。
- 尽管DL模型表现出了希望,但评价仍面临包括出版偏差和显著研究异质性在内的限制。
结论
- 系统评价和元分析强调了DL模型在提高MRI扫描中NPC分割准确性方面的有效性。
- 未来的研究应该发展更先进的DL模型,以适应MRI数据的内在变异性。
- 将DL整合到临床实践,有望通过提供更准确的工具,改善NPC的管理和患者结果。
三、血浆脂蛋白如何成为鼻咽癌治疗的关键?

文献概述
这篇文章是一项关于鼻咽癌(NPC)诱导化疗(IC)疗效预测的研究。研究团队利用血浆代谢组学特征,通过1H-NMR技术获取IC治疗前后的血浆脂蛋白谱,并运用AI辅助的放射组学方法评估疗效。通过机器学习方法,研究团队在发现队列中识别出与IC疗效相关的代谢生物标志物,并在验证队列中进行验证。
主要发现包括:
- 不同患者对IC的反应存在差异,且与代谢物谱的变化相关。
- XGB模型在预测IC疗效方面表现出色,具有较好的稳定性和泛化能力。
- 血浆脂蛋白的失调可能导致NPC患者对IC的抵抗性。
- 研究构建的预测模型基于血浆代谢物谱,显示出良好的预测能力和现实世界泛化的潜力。
这项研究的意义在于为NPC患者的个性化治疗提供了新的生物标志物,并可能有助于提高IC的疗效和患者的生存质量。
四、跨域学习框架的应用:AI辅助鼻咽癌(NPC)原发肿瘤全自动诊断

文献概述
这篇文章提出了一个用于鼻咽癌(NPC)原发肿瘤全自动诊断的跨域互助学习框架。该框架利用H&N MR图像进行T分期的准确诊断,这对于指导治疗决策和预测不同风险组的结果至关重要。现有基于深度学习的技术在NPC的T分期中应用较少,且由于忽略了对原发肿瘤诊断至关重要的特定领域知识,性能常常不尽如人意。
为了解决这些问题,作者提出了一个新的端到端的3D跨域互助学习框架,包括以下几个关键部分:
-
跨域知识感知网络(CKP net):利用双判别器生成对抗网络(GAN)架构,将输入图像转换到分割图域和距离变换图域,专注于肿瘤强度变化和内部异质性。
-
多域互信息共享融合网络(M2SF net):包含双路径领域特定表示模块和互信息融合模块,用于智能评估和整合多域、多尺度T分期诊断导向特征。
-
评估:在内部和外部MR图像数据集上进行了三重交叉验证评估。实验结果表明,所提出的方法优于现有算法,并且在肿瘤分割和T分期方面展现出了有希望的性能。
-
贡献:提出了第一个自动化NPC整个原发肿瘤诊断过程的CAD系统,填补了现有研究的空白;提出的框架采用跨域协作互助学习方案,与临床诊断过程紧密对应,并有效提取关键的临床相关诊断信息;多域互信息共享融合网络设计模仿人类视觉注意力机制,使其能够识别和专注于与T分期诊断任务相关的显著诊断特征。
-
相关工作:讨论了生成对抗网络(GAN)在医学图像分割任务中的应用,以及特征融合在提高模型最终预测性能方面的重要性。
-
方法论:详细介绍了提出的跨域互助学习框架,包括两个深度卷积神经网络子网络(CKP net和M2SF net)的设计和功能。
-
实验和结果:使用两个独立数据集对提出的方法进行了评估,并与其他方法进行了比较,证明了所提方法的有效性。
-
讨论:强调了精确诊断和制定个性化治疗方案的重要性,并讨论了该研究的局限性和未来的挑战。
-
结论:提出了一个端到端的跨域互助学习框架,用于NPC原发肿瘤的全自动诊断,具有潜在的临床应用价值。
文章由Yu Zhang、Shujun Liang等人撰写,得到了中国国家自然科学基金、广州科技计划项目和广东医学图像处理重点实验室的部分支持。
重点关注
Fig. 2 展示了所提出的端到端跨域互助学习框架的示意图。
这个框架由两个深度卷积神经网络子网络组成,分别是跨域知识感知网络(Cross-domain Knowledge Perception Network,简称CKP net)和多域互信息共享融合网络(Multi-domain Mutual-information Sharing Fusion Network,简称M2SF net)。
跨域知识感知网络(CKP net):
- 这个网络利用双判别器生成对抗网络(GAN)架构,将输入图像转换到两个不同的空间域:分割图域和距离变换图域。
- 分割图域专注于捕获肿瘤强度变化和内部异质性的跨域不变特征。
- 距离变换图域支持后续的双路径领域特定表示模块,强调与肿瘤周围异质性相关的特征。
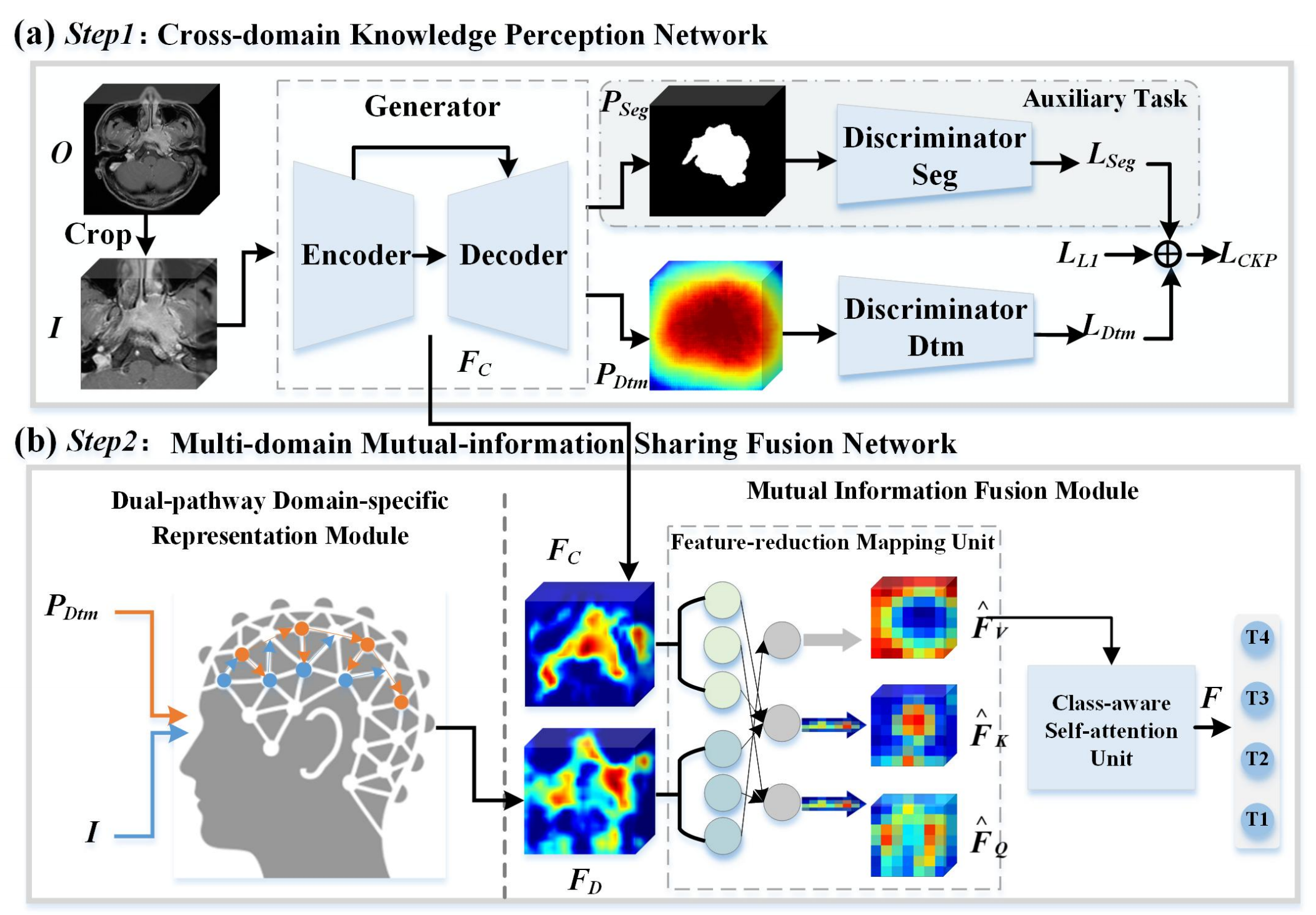
多域互信息共享融合网络(M2SF net):
- 这个网络由双路径领域特定表示模块和互信息融合模块组成。
- 双路径领域特定表示模块用于提取有关肿瘤侵袭范围的空间相关性特征。
- 互信息融合模块将多域和多尺度的诊断特征整合起来,执行协作互助学习,与CKP net协同工作。
整体来看,该框架旨在通过自动化的方式,结合多域诊断知识,实现NPC原发肿瘤的精确分割和T分期。通过这种设计,框架能够同时处理分割和分类任务,提高了诊断的准确性和效率。这种端到端的方法允许从原始图像直接进行肿瘤分割和T分期,无需人工干预,这对于临床应用来说是一个显著的优势。
五、揭示治疗前后MRI影像在鼻咽癌预测中的决定性作用

文献概述
这篇文章的标题为《Enhancing Nasopharyngeal Carcinoma Survival Prediction: Integrating Pre‑ and Post‑Treatment MRI Radiomics with Clinical Data》,由Luong Huu Dang等人撰写,发表在《Journal of Imaging Informatics in Medicine》上。
文章的主要目的是开发一个预测模型,用于提高鼻咽癌(NPC)患者生存预测的准确性。该模型结合了治疗前后的磁共振成像(MRI)放射组学特征和临床数据,重点关注3年无进展生存期(PFS)作为主要结果。
研究方法:
- 回顾性收集了来自台湾三家独立医院的276名合格的NPC患者的临床和MRI数据。
- 这些患者都接受了两次MRI扫描,一次在治疗前2个月内,一次在治疗后10个月内。
- 从治疗前后的对比增强T1加权图像中提取了3404个放射组学特征。
- 特征选择流程后,使用Cox比例风险模型进行生存分析。
- 通过接收者操作特征(ROC)分析、Kaplan-Meier方法和列线图构建来评估模型。
主要发现:
- 研究揭示了几个关键的NPC生存预测因子,特别强调了治疗前后数据在临床和放射组学评估中的协同组合。
- 预测模型表现出强大的性能,在训练队列中AUC为0.66,测试队列中为0.717,验证队列中为0.827。
- 研究提出了一个新颖有效的NPC生存预测模型,利用治疗前后的临床数据结合MRI特征。
研究意义:
- 该模型为NPC研究提供了潜在的重要意义,为临床医生提供了一个有价值的工具,用于个性化治疗计划和患者咨询。
文章还详细介绍了鼻咽癌的背景、数据获取、MRI图像预处理、生存预测因子的识别、模型构建和统计分析方法。此外,还讨论了研究结果的意义、局限性和未来研究方向。
重点关注
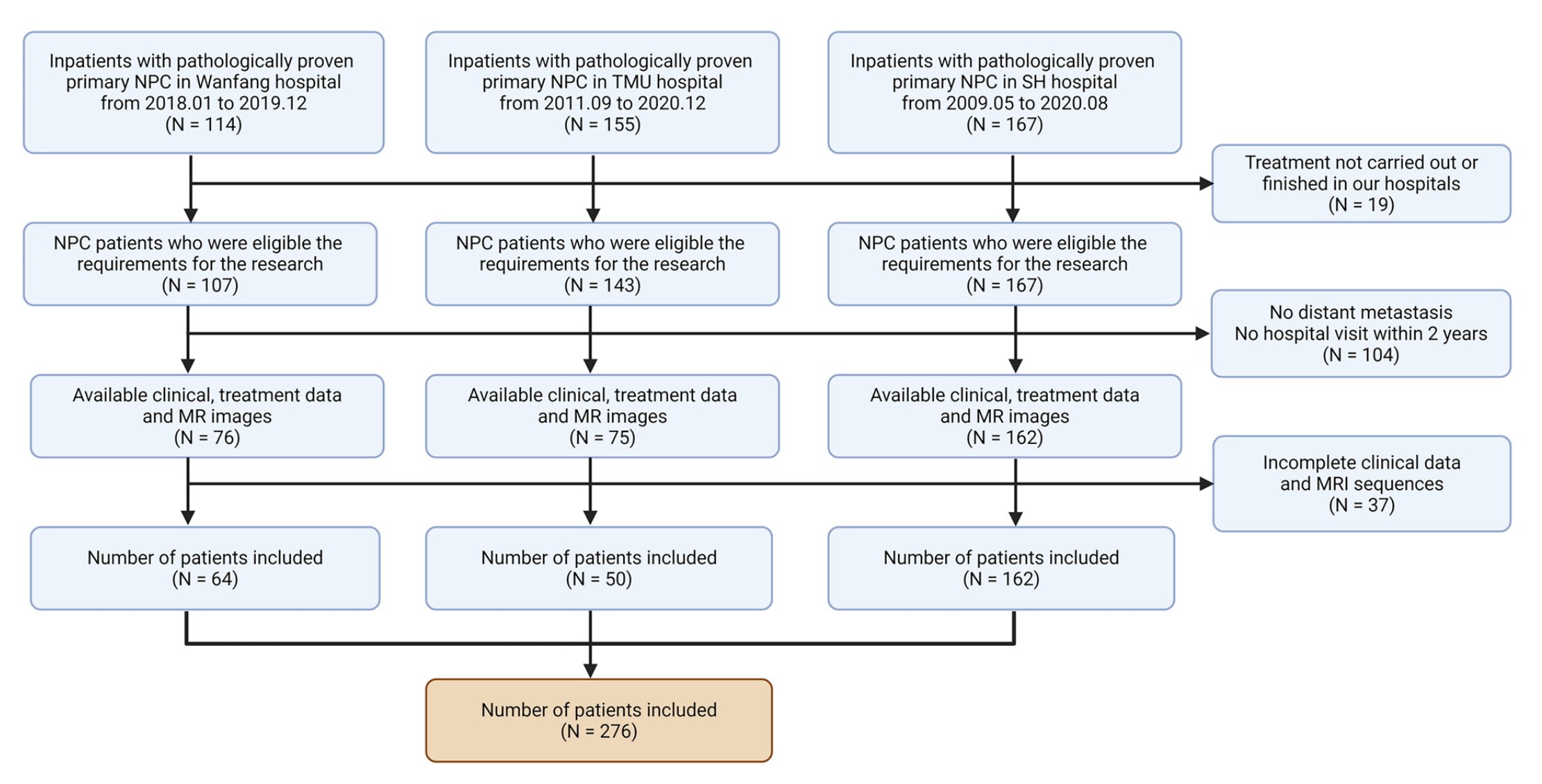
Fig. 1 在文章中提供了一个流程图,展示了合格鼻咽癌(NPC)患者临床和MRI数据收集的过程。
-
患者筛选:流程图从患者筛选开始,包括纳入和排除标准的应用。研究者会根据特定的标准(如组织学证实的原发性NPC、无远处转移、规律的随访等)来确定哪些患者符合研究条件。
-
数据收集:符合条件的患者会被纳入研究,研究者会收集他们的临床数据和MRI影像资料。这可能包括患者的基本信息、疾病特征、治疗历史等。
-
治疗前后MRI扫描:流程图展示了患者在治疗前后接受MRI扫描的步骤。治疗前扫描通常在治疗开始前2个月内进行,而治疗后扫描则在治疗完成后10个月内进行。
-
图像处理和分析:收集到的MRI图像会经过专业的图像处理,包括图像分割、感兴趣区域(ROI)的确定等,以便提取放射组学特征。
-
特征提取:从治疗前后的MRI图像中提取放射组学特征,这些特征可能包括形状、纹理、信号强度分布等参数。
-
数据整合:将提取的放射组学特征与临床数据结合,形成完整的数据集,用于后续的统计分析和模型构建。
-
模型开发和验证:使用收集的数据开发生存预测模型,并通过训练、测试和验证队列来评估模型的性能。
-
结果解释:基于模型结果,研究者可以对NPC患者的3年无进展生存期(PFS)进行预测,并根据风险评分将患者分为高风险和低风险组。
六、LVPA-UNet|自动勾画鼻咽癌的靶区体积
文献概述
这篇文章是关于一种新型的医学图像分割网络——LVPA-UNet的研究,该网络用于自动勾画鼻咽癌的靶区体积(GTV)。
研究背景与目的:
- 精确勾画GTV对于放疗计划的制定至关重要。
- 现有的基于深度学习的2D和3D GTV分割模型存在局限性,如空间特征丢失、各向异性问题、肿瘤特征的变异性、边界模糊和背景干扰等。
- 本研究旨在解决这些问题,提出一种新的基于2D-3D架构的Layer-Volume Parallel Attention (LVPA)-UNet模型。
LVPA-UNet模型介绍:
- 该模型引入了三种策略:2D和3D工作流程的并行化、多分支深度方向条形卷积、Layer-Channel Attention机制。
- 2D和3D工作流程并行工作,互相指导,可以提取2D MRI切片的精细特征和肿瘤的3D解剖结构及空间特征。
- 多分支深度方向条形卷积使模型适应不同形状和大小的肿瘤,实现对模糊边界的精细处理。
- Layer-Channel Attention机制根据其不同的肿瘤信息自适应调整切片和通道的权重,突出显示包含肿瘤的切片和通道。
实验与结果:
- 在1010个鼻咽癌(NPC)MRI数据集上对LVPA-UNet进行了实验,这些数据集来自三个中心。
- 实验结果显示,LVPA-UNet在DSC(Dice相似系数)、精确度、召回率和HD95(95% Hausdorff距离)等指标上均优于其他八个典型模型。
- 与基线模型相比,LVPA-UNet在DSC上提高了2.14%,在精确度上提高了2.96%,在召回率上提高了1.01%,同时将HD95降低了0.5434毫米。
结论:
- LVPA-UNet能够确保分割效率,同时为放疗提供更优越的GTV勾画结果,支持精准医疗。
- 该模型通过深度学习技术实现GTV的自动和一致的精确分割,消除了主观判断的差异。
数据可用性声明:
- LVPA-UNet的源代码可在GitHub上获得,数据可根据要求提供。
文章还详细讨论了LVPA-UNet的设计细节、网络编码器和解码器的架构、实验数据、性能评估指标、与其他模型的比较以及逐步集成不同模块的效果。此外,还探讨了该模型在医学应用中的潜在价值和普遍性,以及未来的研究方向。
重点关注
Fig. 1 展示了所提出的 LVPA-UNet 的网络架构。
下面是对这个架构的分析:
-
输入数据:LVPA-UNet 的输入是一个3D T1加权MRI图像,表示为 ( X ),其维度是$ RC \times D \times H \times W $。这里,( X ) 由 ( D ) 个2D空间分辨率为 ( H × W H \times W H×W ) 的切片组成。由于输入模态仅为T1加权,所以通道数 ( C ) 为1。
-
UNet架构:LVPA-UNet基于UNet架构,主要由编码器(encoder)和解码器(decoder)两部分组成。
-
编码器:编码器由多个阶段组成,每个阶段都利用LVPA模块来生成高级别信息。这些阶段通过整合三种先进的机制来实现:
- 并行2D和3D工作流程:改善2D切片细节和3D空间信息。
- L-MSCA和V-MSCA:由并行多分支深度方向条形卷积构成,这些卷积用于扩大感受野,并且更加关注边界处理和不同形状的肿瘤。
- Layer-Channel Attention模块:增加对与肿瘤相关的切片和通道的关注。
-
解码器:在解码器模块中,每个阶段使用跳跃连接(skip connection)来融合编码器和解码器中相应阶段的信息,逐步生成分割图。
-
分割结果的形成:最终的高分辨率分割结果是通过结合相邻阶段的地图来形成的。

特点分析:
- 并行处理:LVPA-UNet通过并行2D和3D处理,可以同时捕获图像的局部细节和整体结构信息。
- 深度方向条形卷积:这种设计扩大了模型的感受野,有助于更准确地识别肿瘤的边界,即使这些边界在图像中可能不够清晰。
- Layer-Channel Attention机制:通过这种机制,模型可以自适应地调整对肿瘤区域的关注,从而提高分割的精确度。
- 跳跃连接:解码器中的跳跃连接有助于恢复图像的空间分辨率,确保分割结果的精度和细节。
综上所述,LVPA-UNet的设计考虑了医学图像分割中的关键挑战,并采用了创新的结构和技术来提高分割的准确性和效率。