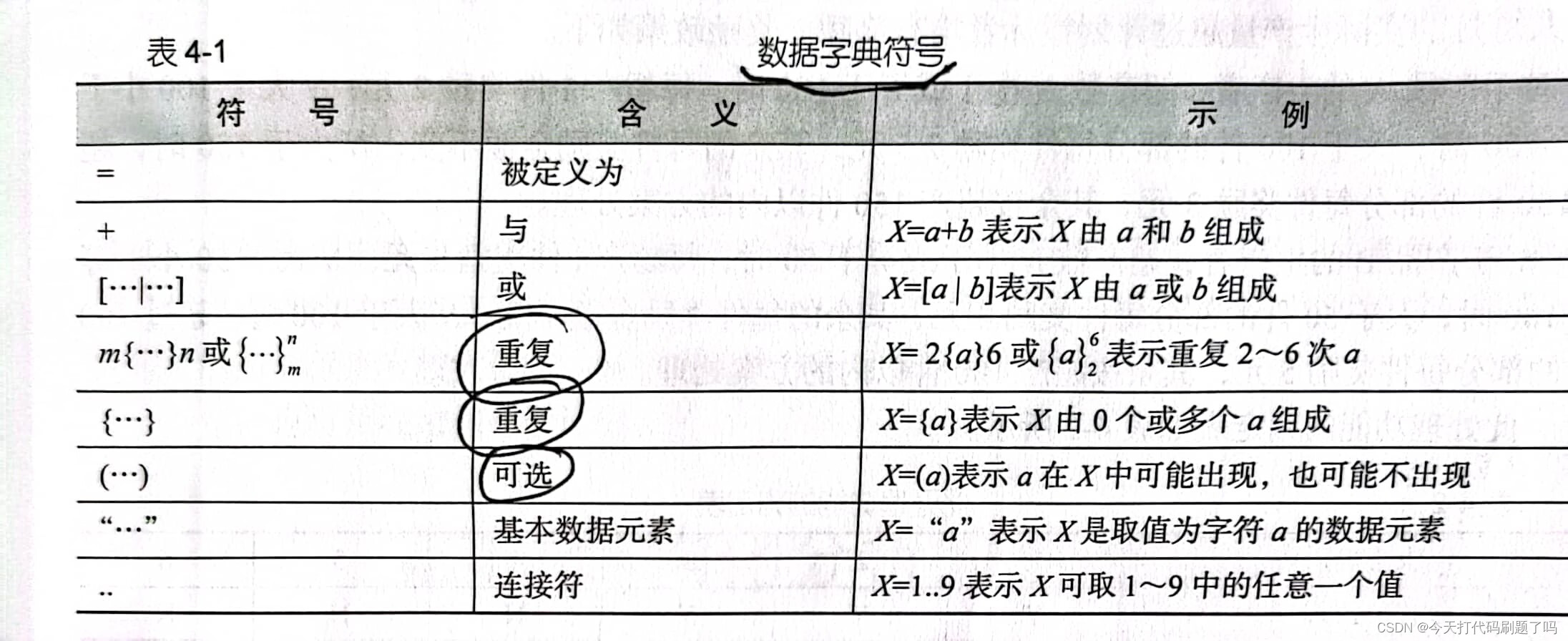
一
洁净级别确认
1. 用于生产无菌药品的洁净室和洁净空气设备如单向流系统(UDAF)、限制进入屏障系统(RABS)和隔离器,应根据所需环境特性进行确认。生产操作需要在适当洁净度级别的环境中进行,以降低粒子或微生物污染产品或物料的风险。洁净室确认(包括定级)应明确区别于环境监测。(欧盟GMP 附录1 4.23)
2. 洁净室分级,应在“静态”和“动态”状态下进行。
①“静态”是指所有公共设施(包括所有正常运行的 HVAC)已安装完成、主生产设备按规定安装并待机、并且无人员在场的状态。
②“动态”是指洁净室安装完成,HVAC系统全面运行,设备已安装且按生产商规定的运行模式运行,允许最多人数在现场执行或模拟日常操作的状态。
③ 在分级期间应确定“自净”周期(指导值为小于20分钟)。(欧盟GMP 附录1 4.29)
3. 洁净室和洁净空气设备应按照制定的程序进行定期再确认。再确认程序应至少包括微生物和悬浮粒子浓度测定、终端过滤器完整性测试、风量测试、压差测试。A 级区还应进行空气流速测试。A级和B级区的再确认最长时间间隔为6个月。C级和D级区的再确认最长时间间隔为12个月。在纠正设备或设施偏差后,或设备、设施或工艺的变更后,还应进行再确认。((欧盟GMP 附录1 4.32)
洁净室验证核心设备

激光尘埃粒子计数器

浮游菌采样器

高效过滤器检漏系统

风量罩

气流流型检测仪
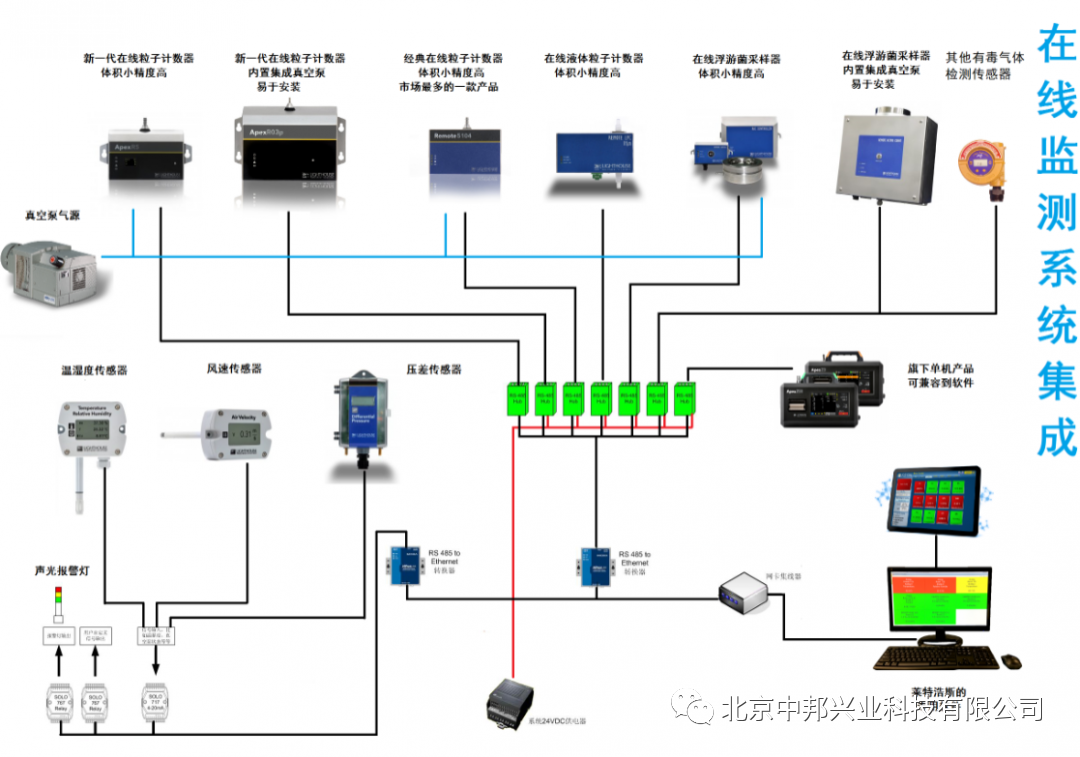
洁净室在线监测系统
【北京中邦兴业验证仪器及验证服务解决方案】
二
洁净环境监测相关法规指南
环境监测(Environmental Monitoring,EM):
场地的环境监测与工艺监测计划构成整个污染控制策略(CCS)的一部分,用于监测旨在最大程度降低微生物和微粒污染风险的控制措施。应注意,监测系统的每个要素(活性微粒,非活性微粒和APS)的可靠性在单独来看时是有限的,不应单独视为无菌的指标。当综合考虑时,这些结果有助于确认所监测系统的设计、验证和操作的可靠性。
应制订环境监测计划并记录环境监测结果。 环境监测计划的目的是:
i. 根据工艺风险评估和法规要求,设计监测计划以保证洁净室和洁净空气设备持续提供适当空气洁净度的环境。
ii. 监测方式应能有效地检测偏离环境限度的情况,触发调查并评估对产品质量影响。
01. 法规指南
1.1 国内药监
中国GMP 通则 第二章 质量管理
第十二条 质量控制的基本要求:
(二)应当有批准的操作规程,用于原辅料、包装材料、中间产品、待包装产品和成品的取样、检查、检验以及产品的稳定性考察,必要时进行环境监测,以确保符合本规范的要求;
第二百条 应当进行中间控制和必要的环境监测,并予以记录。
第二百二十一条 质量控制实验室的文件应当符合第八章的原则,并符合下列要求:
(一)质量控制实验室应当至少有下列详细文件:
5.必要的环境监测操作规程、记录和报告;
(三)宜采用便于趋势分析的方法保存某些数据(如检验数据、环境监测数据、制药用水的微生物监测数据);
中国GMP 附录1:无菌药品
第九条 无菌药品生产所需的洁净区可分为以下4个级别:
A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。应当有数据证明单向流的状态并经过验证。在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:
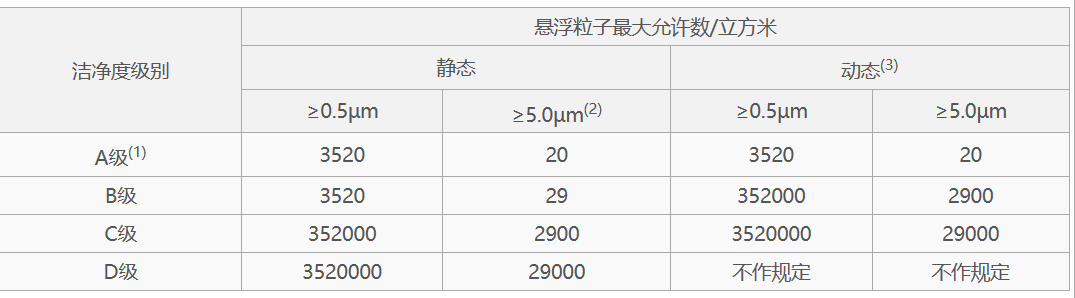
注:
(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。A级洁净区空气悬浮粒子的级别为ISO 4.8,以≥5.0μm的悬浮粒子为限度标准。B级洁净区(静态)的空气悬浮粒子的级别为ISO 5,同时包括表中两种粒径的悬浮粒子。对于C级洁净区(静态和动态)而言,空气悬浮粒子的级别分别为ISO 7和ISO 8。对于D级洁净区(静态)空气悬浮粒子的级别为ISO 8。测试方法可参照ISO14644-1。
(2)在确认级别时,应当使用采样管较短的便携式尘埃粒子计数器,避免≥5.0μm悬浮粒子在远程采样系统的长采样管中沉降。在单向流系统中,应当采用等动力学的取样头。
(3)动态测试可在常规操作、培养基模拟灌装过程中进行,证明达到动态的洁净度级别,但培养基模拟灌装试验要求在“最差状况”下进行动态测试。
第十条 应当按以下要求对洁净区的悬浮粒子进行动态监测:
(一)根据洁净度级别和空气净化系统确认的结果及风险评估,确定取样点的位置并进行日常动态监控。
(二)在关键操作的全过程中,包括设备组装操作,应当对A级洁净区进行悬浮粒子监测。生产过程中的污染(如活生物、放射危害)可能损坏尘埃粒子计数器时,应当在设备调试操作和模拟操作期间进行测试。A级洁净区监测的频率及取样量,应能及时发现所有人为干预、偶发事件及任何系统的损坏。灌装或分装时,由于产品本身产生粒子或液滴,允许灌装点≥5.0μm的悬浮粒子出现不符合标准的情况。
(三)在B级洁净区可采用与A级洁净区相似的监测系统。可根据B级洁净区对相邻A级洁净区的影响程度,调整采样频率和采样量。
(四)悬浮粒子的监测系统应当考虑采样管的长度和弯管的半径对测试结果的影响。
(五)日常监测的采样量可与洁净度级别和空气净化系统确认时的空气采样量不同。
(六)在A级洁净区和B级洁净区,连续或有规律地出现少量≥5.0 µm的悬浮粒子时,应当进行调查。
(七)生产操作全部结束、操作人员撤出生产现场并经15~20分钟(指导值)自净后,洁净区的悬浮粒子应当达到表中的“静态”标准。
(八)应当按照质量风险管理的原则对C级洁净区和D级洁净区(必要时)进行动态监测。监控要求以及警戒限度和纠偏限度可根据操作的性质确定,但自净时间应当达到规定要求。
(九)应当根据产品及操作的性质制定温度、相对湿度等参数,这些参数不应对规定的洁净度造成不良影响。
第十一条 应当对微生物进行动态监测,评估无菌生产的微生物状况。监测方法有沉降菌法、定量空气浮游菌采样法和表面取样法(如棉签擦拭法和接触碟法)等。动态取样应当避免对洁净区造成不良影响。成品批记录的审核应当包括环境监测的结果。
对表面和操作人员的监测,应当在关键操作完成后进行。在正常的生产操作监测外,可在系统验证、清洁或消毒等操作完成后增加微生物监测。
洁净区微生物监测的动态标准(1)如下:

注:
(1)表中各数值均为平均值。
(2)单个沉降碟的暴露时间可以少于4小时,同一位置可使用多个沉降碟连续进行监测并累积计数。
第十二条 应当制定适当的悬浮粒子和微生物监测警戒限度和纠偏限度。操作规程中应当详细说明结果超标时需采取的纠偏措施。
中国药典2020 四部 9203 药品微生物实验室质量管理指导原则
设施和环境条件>环境监测
微生物实验室应按相关国家标准制定完整的洁净室(区)和隔离系统的验证和环境监测标准操作规程,环境监测项目和监测频率及对超标结果的处理应有书面程序。监测项目应涵盖到位,包括对空气悬浮粒子、浮游菌、沉降菌、表面微生物及物理参数(温度、相对湿度、换气次数、气流速度、压差、噪声等)的有效控制和监测。环境监测按药品洁净实验室微生物监测和控制指导原则(指导原则9205)进行。
中国药典2020 四部 9205 药品洁净实验室微生物监测和控制指导原则
药品洁净实验室是指用于药品无菌或微生物检验用的洁净区域、隔离系统及其受控环境。药品洁净实验室的洁净级别按空气悬浮粒子大小和数量的不同参考现行“药品生产质量管理规范”分为A、B、C、D4个级别。为维持药品洁净实验室操作环境的稳定性、确保检测结果的准确性,应对药品洁净实验室进行微生物监测和控制,使受控环境维持可接受的微生物污染风险水平。
1.2 FDA
FDA CFR 211 制剂成品的CGMP
Sec. 211.42 设计与建造特点
(c) 操作应在明确规定且大小适宜的区域内进行。在以下程序的过程中,对于有必要防止污染或混淆的操作,应具备独立或指定的区域或其它类似的控制系统:
(10) 无菌工艺,视情况包括:
(iv) 环境监测系统;
Sec. 211.113 微生物污染的控制
(b) 应制订并遵循有关防止无菌药品微生物污染的适当的书面操作规程。此类操作规程应包括所有无菌和灭菌工艺的验证。
FDA 联邦法规:21 CFR 1271
第1271.195节 环境控制和监测
(a)环境控制。当环境条件有合理可能导致HCT/Ps或设备的污染或交叉污染,或导致HCT/Ps意外暴露于传染病原时,必须充分控制环境条件并为操作提供适当的条件。在适用情况下,必须提供以下控制活动或系统:
(1)温度和湿度的控制;
(2)通风和空气过滤;
(3)房间和设备的清洁和消毒以确保无菌工艺操作;
(4)用于控制无菌工艺操作必要条件的设备的维护。
(b)检查。必须定期检查每个环境控制系统,以核实系统(包括必要的设备)是否合适并且是否运行正常。必要时,必须采取适当的纠正措施。
(c)环境监测。当环境条件有合理可能导致HCT/Ps或设备的污染或交叉污染,或导致HCT/Ps意外暴露于传染病原时,必须监测环境条件。在适用情况下,必须提供对微生物的环境监测。
(d)记录。必须用文件记录维护环境控制和监测活动,并维护记录。
FDA指南-无菌制剂生产质量管理规范
Ⅹ. 实验室控制
A. 环境监测
1. 一般书面程序
在无菌操作中,最重要的实验室控制之一是环境监测方案。此方案提供关于无菌工艺环境质量(例如当给定批次正在生产时)的有意义的信息以及辅助清洁区的环境趋势。环境监测应快速鉴别可能的污染途径,在发生产品污染前实施修正
1.3 EU
EU GMP Part I 通则
1.9 质量控制是GMP 的一部分,涉及取样、质量标准、检验,同样也涉及组织机构、文件和放行规程,以保证确实执行了必要的相关检验,并且确保物料或产品被判定符合要求之前不被放行使用或销售。质量控制的基本要求是:
i. 有充足的设施设备、经过培训的人员及经过批准的操作规程可以用于原辅料、包装材料、中间产品、待包装产品与成品取样和检验,以及GMP 要求的环境监测;
2.9 生产负责人和质量控制负责人(或根据实际情况可能是质量保证负责人或质量部门负责人)通常有一些共同承担或共同履行的质量相关职责,特别是对质量管理体系的设计、有效实施、监管和维护。基于各国的规定不同,这些职责可能包括:
ii.生产环境的监测与控制;
4.29 有些活动应当有相应的书面方针、操作规程、方案与报告以及所采取措施或所得结论的相关记录,例如:
环境监测;
6.7 实验室文件管理应当符合第4章给出的原则。实验室文件的重要部分是关于质量控制的内容,质量控制部门应当有下列文件:
i. 质量标准;
ii. 描述取样、检验、记录(包括检验用的工作簿和/或实验室笔记本)、做记录、做确认的规程;
iii. 仪器的标定/确认,设备维护的规程与记录;
iv. 结果超标和超趋势调查的规程;
v. 检验报告和/或分析报告;
vi. 必要的环境监测数据(空气、水、其它设施);
vii. 必要的检验方法的验证记录。
EU GMP 附录1:无菌药品生产
9.1 场地的环境监测和工艺监测计划构成整个CCS的一部分,用于监测旨在最大程度降低微生物和微粒污染风险的控制措施。应注意,监测系统的每个要素(活性微粒,非活性微粒和APS)的可靠性在单独来看时是有限的,不应单独视为无菌的指标。当综合考虑时,这些结果有助于确认所监测系统的设计、验证和操作的可靠性。
9.2 本计划通常包括以下内容:
i.环境监测 - 总微粒。
ii.环境和人员监测 - 活性微粒。
iii.温度、相对湿度和其它具体特性。
iv.APS(仅用于无菌生产的产品)。
9.3 应将来自这些系统的信息用于常规批次认证/放行以及工艺回顾或调查期间的定期评估。这适用于最终灭菌和无菌工艺,然而,影响的关键程度可能因产品和工艺类型的不同而不同。