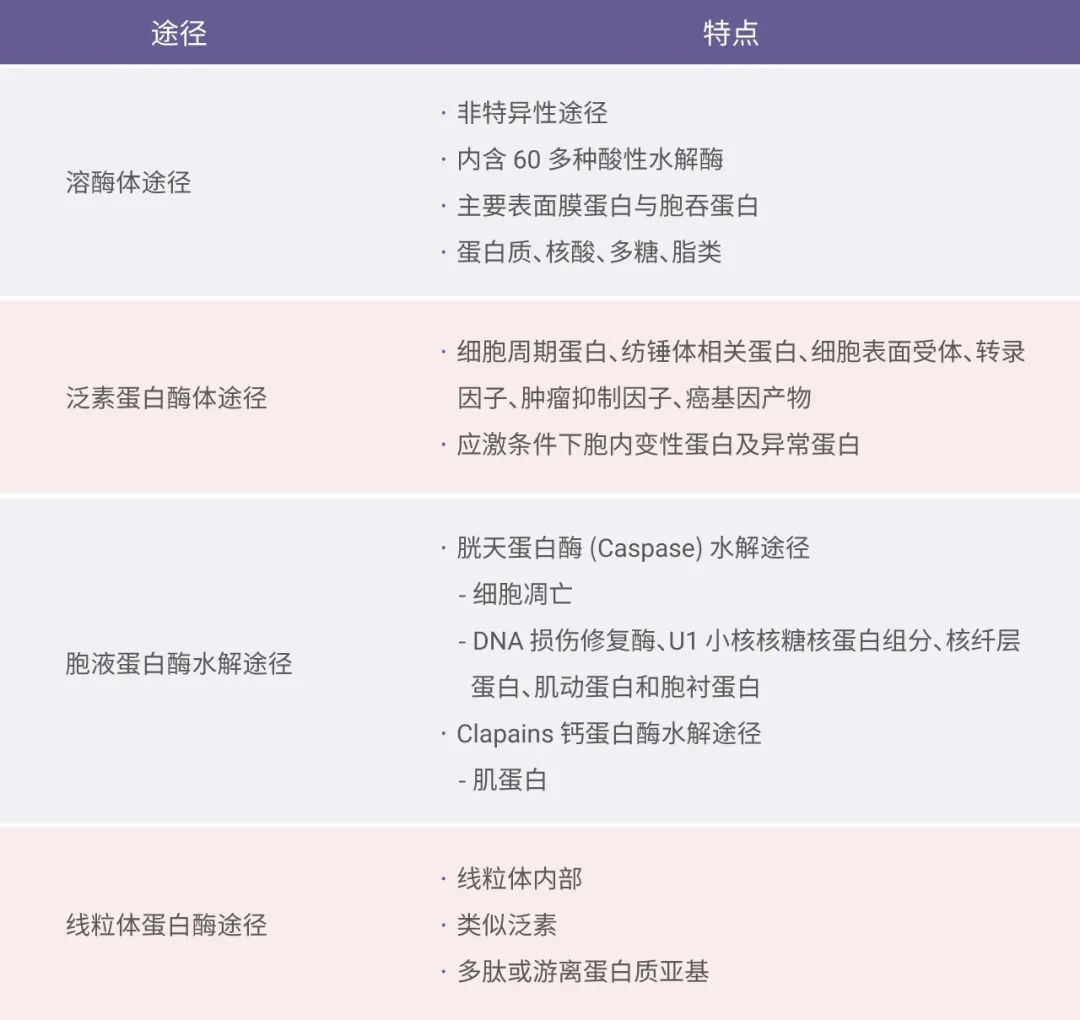
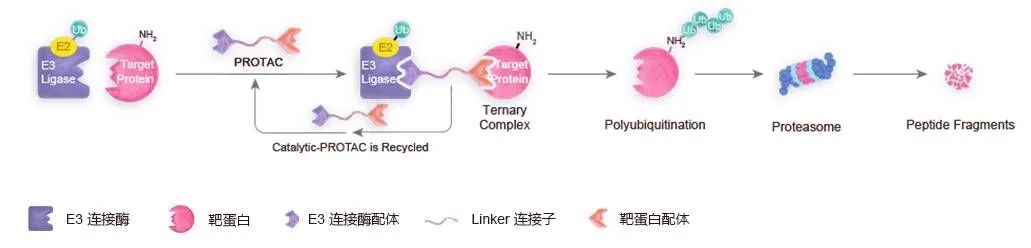
真核生物的蛋白降解途径主要分为溶酶体途径、泛素蛋白酶体途径、胞液蛋白酶水解途径和线粒体蛋白酶途径等四种 (图1)。其中,PROTAC 所依赖的蛋白酶体途径主要针对细胞周期蛋白、转录因子、细胞表面受体以及胞内变性蛋白等进行降解。
目前,PROTAC 已有靶向 ER、AR、BTK 以及 IRAK 的分子上市,不难看出,它们都是肿瘤相关蛋白。这些肿瘤相关蛋白,在特定的肿瘤细胞有特定的表型,或本身就是致癌蛋白,比如 Kras G12C,不用考虑在正常组织中的分布,可直接被降解。
如果是一个非特异性蛋白需要开发成高靶向性的 PROTAC 该如何呢?我们总结了三种思路:一是光控 Linker 靶向释放;二是构建 PAC 分子;三是从 E3 连接酶的特异性上设计。
非特异性蛋白靶向思路一:光控 Linker
光控 Linker 主要分成两种,一种是光敏基团遮蔽,一种是光敏基团异构。
光敏基团遮蔽:Xue 等将原 PROTAC 分子 dBET1 的靶蛋白 BRD4 配体 JQ1 用 4,5-dimethoxy-2-nitrobenzeneDMNB 屏蔽,活性降低了 100 倍以上,之后再用 365 nm 的光照将 dBET1 释放,靶蛋白 BRD4 在 1 μM 浓度下几乎完全降解 (Dmax = 93%)。
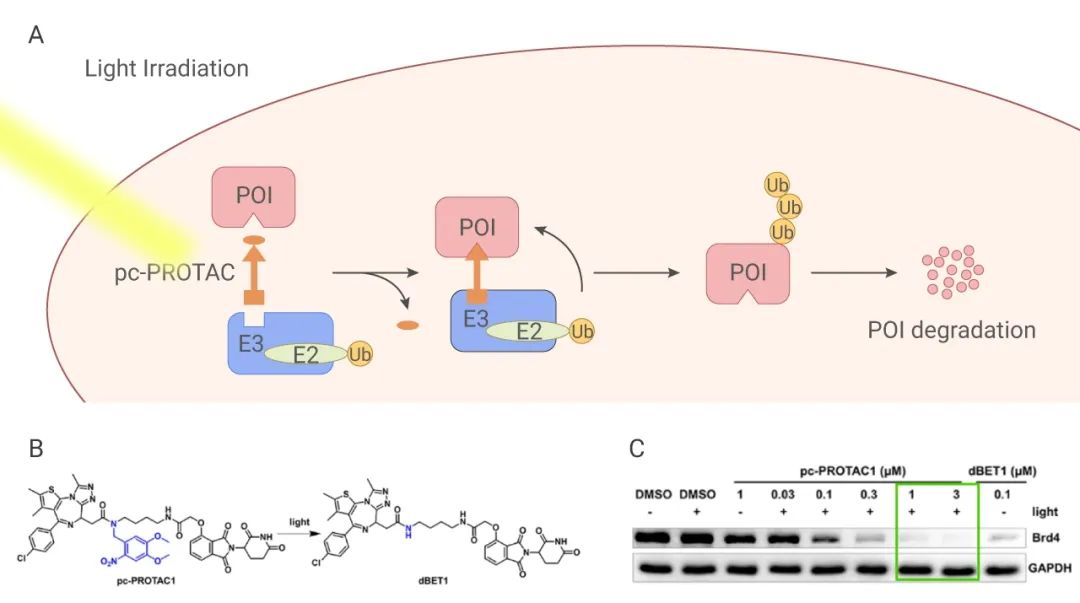
光敏基团异构:Pfaff 等利用偶氮苯异构体顺反式距离相差 3-4Â 正好与 PROTAC linker 活性与非活性差异区间类似的特点,将原 PROTAC 分子 ARV-771 的 linker 用改造后包含顺式偶氮苯的结构。顺式偶氮苯可以在 415 nm 的光照下变为反式结构,恢复 ARV-771 活性链长。
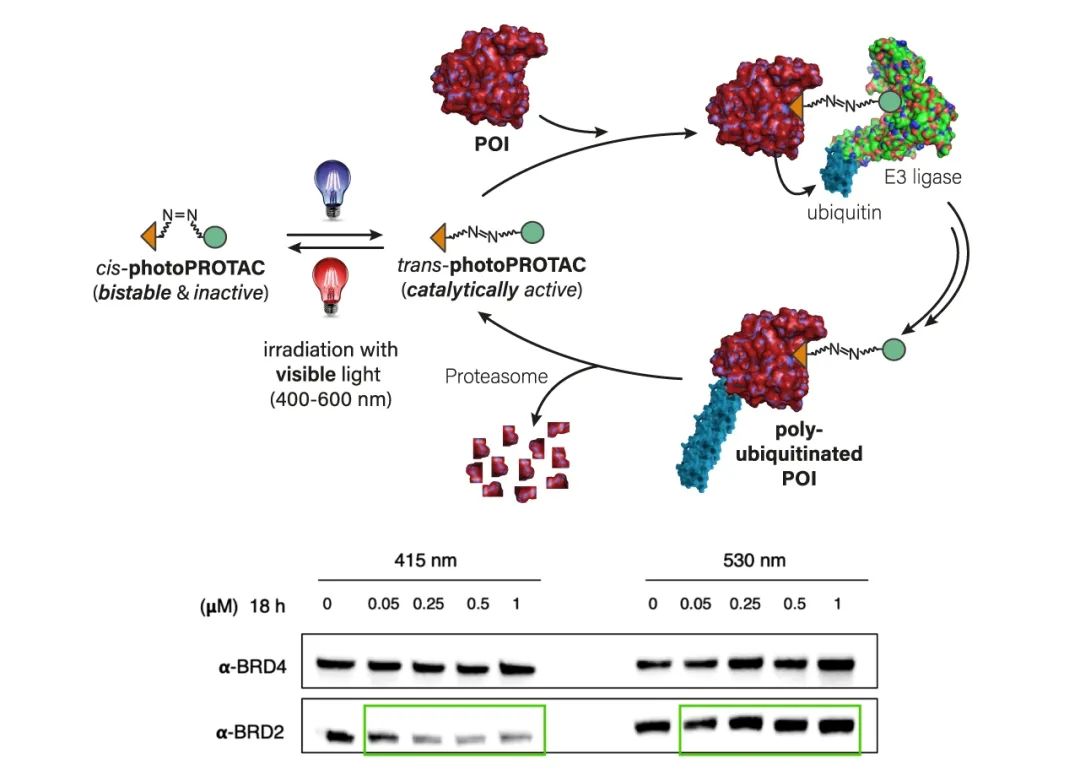
非特异性蛋白靶向思路二:PAC 分子
这是一种采用了抗体偶联药物 (ADC) 技术的分子,这种将 PROTAC 与 ADC 结合的技术也被称为抗体 PROTAC 复合物 (PAC)。
Maneiro 等在曲妥珠单抗上通过一段连接子片段连上上文的 BRD4 降解剂 ARV-771,连接后的分子仅在 HER2 阳性乳腺癌细胞系中降解 BRD4,而避开了 HER2 阴性细胞。

非特异性蛋白靶向思路三:特殊 E3 连接酶
传统的 E3 连接酶选择是 CRBN、VHL 和 IAP 等配体,其中 VHL 可以被用于受体酪氨酸激酶 (RTK) 中,可作为降解膜蛋白的一种选择。对 E3 配体的考量,除了配体本身对 PROTAC 物理性质的影响外,还可以利用特殊的 E3 配体达到组织靶向性,比如 IAP 作为凋亡抑制蛋白,在癌细胞中高表达,可以基于此开发相应的 PROTAC 分子,该类分子也叫 SNIPER。
泛素样 PHD 和环指结构域 1 (UHRF1) 在乳腺癌等各种癌症中均过度表达,是环指 E3 泛素连接酶亚家族的成员,它通过与 H3K9me3 形成复合物发挥作用。Senisterra 等筛选 44000 个化合物库中破坏 UHRF1-H3K9me3 相互作用的小分子,最后通过优化发现了 Kd 值为 2.4 μM 的 NV03。遗憾的是,目前还没有基于 UHRF1 的针对乳腺癌的 PROTAC 分子被开发。

总结:
PROTAC 分子虽然可以模块化地构建靶蛋白降解分子,但是靶点选择性的问题让它对一些非特殊蛋白束手无策。好在,可以结合光控基团和 PAC 的技术,“锦上添花”般优化已有分子的靶向性。但最终 PROTAC 选择性问题的解决还是需要从根本上去改造它的结构。
万丈高楼平地起,构建 PROTAC 分子,合适的模块是必需的。MCE 是全球前沿的科研化学品和生物活性化合物供应商,可以为科学家提供 PROTAC 相关模块化产品,目前我们已有 PROTAC、SNIPER、PROTAC-Linker Conjugate for PAC 以及它们的构成模块等各种产品在线。同时,我们还提供 PROTAC 产品的一体化合成服务。
PROTAC 分子设计要素:
| PROTAC |
| dBET6 是一种高效的,选择性的,细胞透过的基于 PROTAC 技术的 BET 降解剂,IC50 值为 14 nM,具有抗肿瘤活性。 |
| PROTAC K-Ras Degrader-1 是一种基于 PROTAC 技术的有效的 K-Ras 降解剂,在 SW1573 中对 K-Ras 降解率 ≥ 70%。 |
| SNIPER |
| SNIPER (BRD)-1 由 IAP 拮抗剂 LCL-161 衍生物和 BET 抑制剂 (+)-JQ-1,通过 linker 连接组成,诱导 BRD4 降解。SNIPER (BRD)-1 同时抑制 cIAP1,cIAP2 和 XIAP,IC50 分别为 6.8 nM,17 nM 和 49 nM。 |
| SNIPER (ABL)-020 由 Dasatinib (ABL 抑制剂) 通过 linker 与 Bestatin (cIAP1 配体) 组合而成,可有效降解 BCR-ABL 蛋白。 |
| Protac-linker conjugate for PAC |
| PROTAC BRD4 Degrader-5-CO-PEG3-N3 是一种用于 PAC 的 PROTAC-linker 偶联物,包含 BRD4 降解剂 GNE-987 和 3 个 PEG 的 linker。 |
| PAC 由 ADC linker 和 PROTAC 分子组成,PAC 与抗体偶联。与 PROTAC (不偶联 Ab) 相比,PAC 偶联抗体之后更加显著降低雌激素受体-α (ERα) 水平。 |
| PROTAC BRD4 degrader for PAC-1 是一种用于 PAC 的 PROTAC-linker 偶联物,包含嵌合体 BET 降解剂 GNE-987 和含二硫化物的 linker。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献
1. Qi SM, Dong J, Xu ZY, Cheng XD, Zhang WD, Qin JJ. PROTAC: An Effective Targeted Protein Degradation Strategy for Cancer Therapy. Front Pharmacol. 2021 May 7;12:692574.
2. Wang Y, Le WD. Autophagy and Ubiquitin-Proteasome System. Adv Exp Med Biol. 2019;1206:527-550.
3. Ding Y, Fei Y, Lu B. Emerging New Concepts of Degrader Technologies. Trends Pharmacol Sci. 2020 Jul;41(7):464-474.
4. Xue G, Wang K, Zhou D, Zhong H, Pan Z. Light-Induced Protein Degradation with Photocaged PROTACs. J Am Chem Soc. 2019 Nov 20;141(46):18370-18374.
5. Pfaff P, Samarasinghe KTG, Crews CM, Carreira EM. Reversible Spatiotemporal Control of Induced Protein Degradation by Bistable PhotoPROTACs. ACS Cent Sci. 2019 Oct 23;5(10):1682-1690.
6. Maneiro MA, Forte N, Shchepinova MM, Kounde CS, Chudasama V, Baker JR, Tate EW. Antibody-PROTAC Conjugates Enable HER2-Dependent Targeted Protein Degradation of BRD4. ACS Chem Biol. 2020 Jun 19;15(6):1306-1312.
7. Burslem GM, Smith BE, Lai AC, Jaime-Figueroa S, McQuaid DC, Bondeson DP, Toure M, Dong H, Qian Y, Wang J, Crew AP, Hines J, Crews CM. The Advantages of Targeted Protein Degradation Over Inhibition: An RTK Case Study. Cell Chem Biol. 2018 Jan 18;25(1):67-77.e3.
8. Ohoka N, Ujikawa O, Shimokawa K, Sameshima T, Shibata N, Hattori T, Nara H, Cho N, Naito M. Different Degradation Mechanisms of Inhibitor of Apoptosis Proteins (IAPs) by the Specific and Nongenetic IAP-Dependent Protein Eraser (SNIPER). Chem Pharm Bull (Tokyo). 2019 Mar 1;67(3):203-209.
9. Senisterra G, Zhu HY, Luo X, Zhang H, Xun G, Lu C, Xiao W, Hajian T, Loppnau P, Chau I, Li F, Allali-Hassani A, Atadja P, Oyang C, Li E, Brown PJ, Arrowsmith CH, Zhao K, Yu Z, Vedadi M. Discovery of Small-Molecule Antagonists of the H3K9me3 Binding to UHRF1 Tandem Tudor Domain. SLAS Discov. 2018 Oct;23(9):930-940.
10. Morreale FE, Walden H. Types of Ubiquitin Ligases. Cell. 2016 Mar 24;165(1):248-248.e1.