转录因子 (Transcription Factors, TFs)是指能够以序列特异性方式结合DNA并且调节转录的蛋白质。TF与特异性DNA序列结合调节转录,同时会和其它功能蛋白结合调控下游基因的转录和翻译过程,也会和增强子等其它顺式作用元件结合,使整个调控过程更加完善。
在基因组学和表观遗传学研究中,转录因子结合位点(TFBS)的发掘一直是研究热点。2016年,O'Malley RC等人在Cell上发表了使用DAP-seq技术,快速绘制转录因子调控靶向DNA区域的顺反组和表观组图谱的文章。2017年,Bartlett A等人在Nature Protocols上发表了DAP-seq的实验方法。
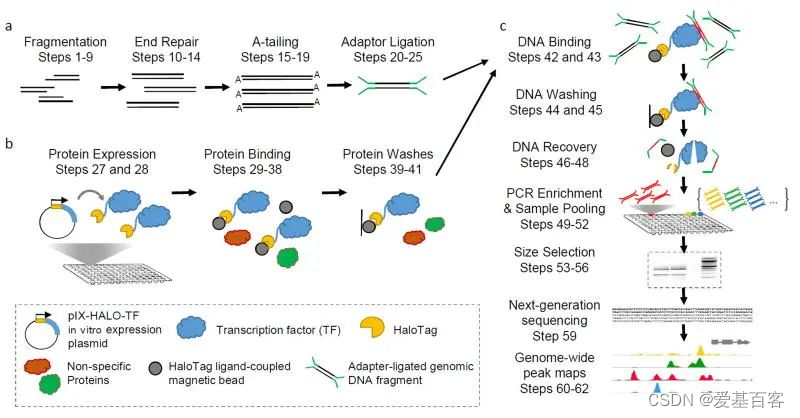
DAP-seq实验流程
DAP-seq(DNA affinity purification sequencing (DAP-seq))是通过体外蛋白表达技术,表达出带有标签的转录因子,和基因组DNA文库在体外进行结合,然后分离出所有与转录因子结合的DNA,再使用高通量测序,找到转录因子的结合位点。
往期我们已经介绍过很多植物中DAP-seq的案例,今天我们来看一篇真菌的DAP-seq案例。
-
研究材料:丝状真菌Neurospora crassa
-
研究方法:RNA-seq,DAP-seq(爱基百客均可提供)
01 研究背景
丝状真菌Neurospora crassa,通过分泌一系列植物细胞壁降解酶、重塑代谢以适应分泌酶的生产,以及使植物生物质成分的运输和细胞内利用,非常高效地分解植物生物质。尽管已经鉴定了参与植物生物质利用的一些酶和转录调控因子,但目前尚不清楚丝状真菌如何感知和整合植物细胞壁中编码的营养信息,以实现对复杂碳源的最佳利用。
02 技术路线
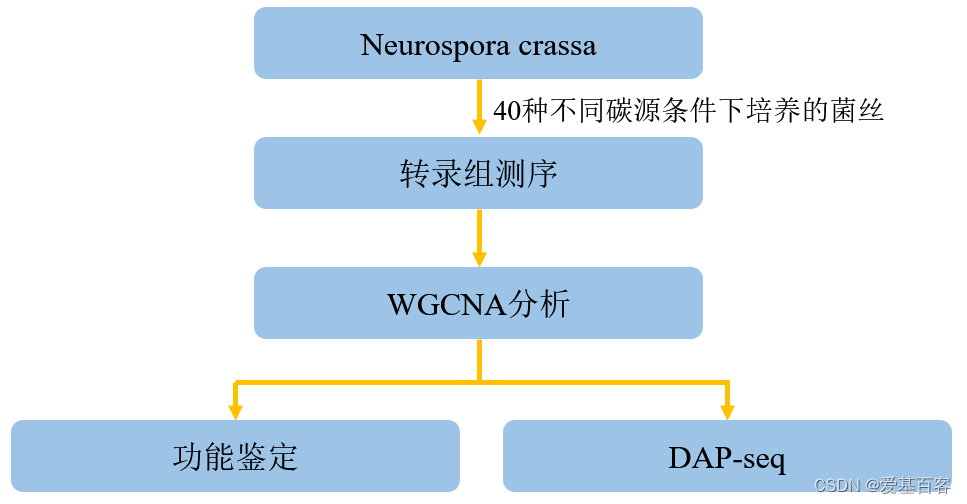
03 研究结果
1. 不同碳源对N. crassa的碳代谢有明显的调控作用
研究人员为了改善对真菌利用植物生物质过程中调控网络整合的理解,对Neurospora crassa在40种不同碳源条件下的基因表达模式进行了评估。为了减少不同碳源对基因表达的影响,他们进行了转换实验,将野生型(WT)N. crassa细胞(FGSC2489)在蔗糖作为唯一碳源的条件下预培养(16小时),然后转移到含有实验碳源的培养基中(4小时),然后提取RNA。研究人员编制了N. crassa基因组中113个编码预测植物细胞壁降解酶(PCWDEs)的基因列表,并评估了这些基因在不同碳源条件下的表达(图1A)。
为了评估协调PCWDE表达的调控途径之间的串扰,研究者对转录数据集进行了加权基因共表达网络分析(WGCNA),并鉴定出28个共表达基因模块(图1B),这些模块显示出特定功能分类的富集。大部分PCWDE基因位于三个模块内。模块 1(红色):与纤维素和半纤维素利用相关的基因。模块 2(黄色):与果胶解构相关的基因。模块 3(蓝色):戊糖分解代谢和木聚糖利用基因。模块 4(午夜蓝):编码 ER 和蛋白质加工蛋白的基因。
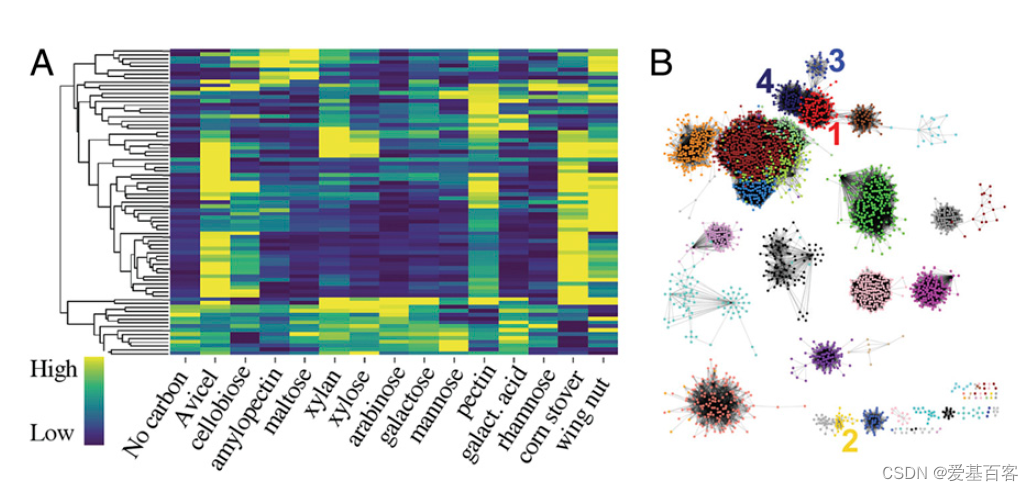
图1. Neurospora crassa跨碳源转录组的层次聚类和WGCNA
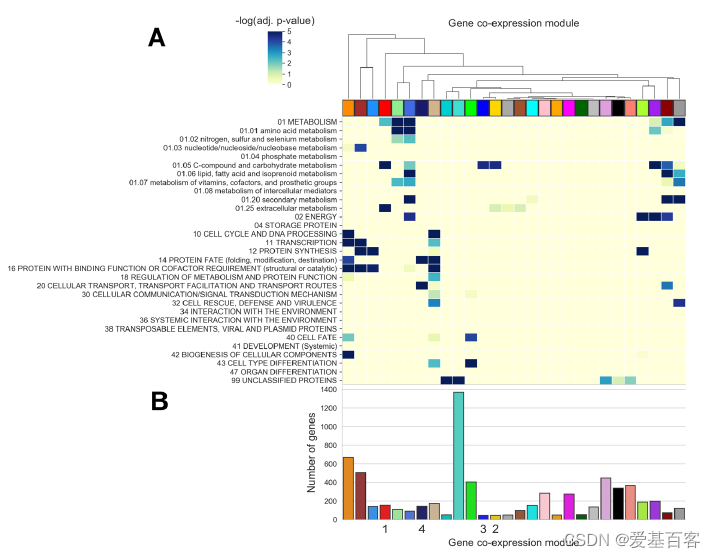
加权基因共表达网络分析热图和模块信息
2. 定义PCWDE转录网络
研究者先前的研究发现了一些保守的转录因子,它们是纤维素酶和一些半纤维素酶基因(CLR-1/ CLR-2)、木聚糖酶和木糖利用基因(XLR-1)、果胶降解基因(PDR-1)和淀粉分解代谢基因(COL-26)的正调节因子。研究人员假设,通过使用层次聚类方法寻找与编码PCWDEs的特定类别基因具有相似表达谱的转录因子,可以识别参与植物细胞壁降解的其他调节因子。系统分析了336种具有预测DNA结合域的蛋白的表达谱,确定了在不同植物生物量成分上特异性诱导的 34 种附加转录因子。其中,NCU04295和NCU05414两个转录因子的缺失突变体在PCWDE表达中表现出一致且明显的作用。
ΔNCU04295突变体显示,与果胶丰富的柑橘果皮上的WT细胞相比,在果胶丰富的柑橘果皮上生长时,果胶利用所需基因的表达水平降低(图2A、B)。与WT相比,ΔNCU04295中表达水平下降最大的基因包括果胶裂解酶基因ply-1和ply-2 (NCU06326和NCU08176)、半乳糖醛酸转运基因gat-1 (NCU00988)、外聚半乳糖醛酸酶基因gh28-2 (NCU06961)以及编码半乳糖醛酸分解代谢酶的gaaA、gaaB和gaaC的同源基因(分别为NCU09533、NCU07064和NCU09532)(图2B)。NCU04295的预测蛋白序列与GaaR相似(约50%的氨基酸同源性),GaaR在B. cinerea和A . niger的半乳糖醛酸代谢中起作用,因此,研究人员将其命名为NCU04295 pdr-2,即果胶降解调节剂-2。
与其预测的功能一致,Δpdr-2突变体在以果胶或半乳糖醛酸为唯一碳源的培养基中表现出严重的生长缺陷,果胶裂解酶和内聚半乳糖醛酸酶活性显著降低(图2 C和D)。先前在N. crassa中发现的第二种果胶降解调节剂pdr-1也表现出严重的果胶生长缺陷。然而,与Δpdr-1细胞不同,Δpdr-2细胞以l-鼠李糖作为唯一碳源生长,这表明pdr-1和pdr-2在调节果胶降解中的作用不同。携带pdr-1和pdr-2缺失的菌株模拟了Δpdr-1或Δpdr-2突变体的表型(图2 C和D),但没有导致果胶作为唯一碳源的生长完全终止。
NCU05414在芒草生物量上高表达,与暴露于1%芒草的WT细胞相比,ΔNCU05414突变体显示编码几种阿拉伯糖酶(NCU09924、NCU9775)、两种β-木糖酶(NCU00709、NCU09923)、l -阿拉伯糖转运蛋白lat-1 (NCU02188)和l -阿拉伯糖醇脱氢酶-1 (NCU00643)的基因表达减少(图2E),这表明ΔNCU05414突变体在利用阿拉伯糖、阿拉伯糖和半乳糖方面存在缺陷。正如预测的那样,ΔNCU05414菌株在2%的阿拉伯糖、阿拉伯糖和半乳糖上的生长显著降低,但能够代谢半纤维素和果胶底物(图2F)。当NCU05414置于强组成启动子gpd-1 (oxNCU05414)的调控下时,细胞对阿拉伯糖的生长相对于WT增加, ard-1的表达增加(图2G),进一步支持NCU05414对阿拉伯糖代谢基因的正向调控。NCU05414预测的蛋白与T. reesei和Magnaporthe oryzae中的Ara1蛋白具有显著的相似性,分别在阿拉伯糖代谢和阿拉伯糖和半乳糖分解代谢中发挥作用,因此研究人员将其命名为NCU05414 ara-1。
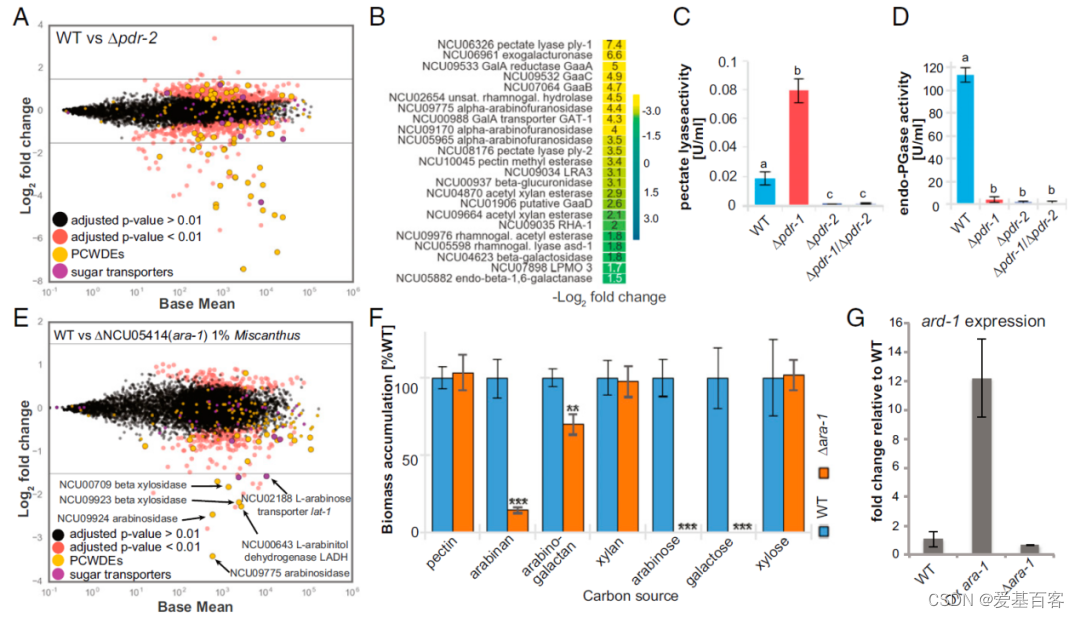
图2. 转录因子pdr-2调控果胶降解,转录因子ara-1调控阿拉伯糖利用
许多涉及果胶和半纤维素等异质底物降解的 PCWDE受到多种转录因子的控制。研究人员通过鉴定编码PCWDE的基因,构建了对植物生物量解构重要的转录因子CLR-1、CLR-2、XLR-1、PDR-1、PDR-2和ALA -1的调控子,这些基因在Δclr-1、Δclr-2、Δxlr-1、Δpdr-2和Δara-1突变体与WT细胞之间至少下调21.5(2.8)倍;这些突变体中上调的基因与饥饿反应中上调的基因相似,这表明这些转录因子发挥了积极的作用。研究人员还纳入了在相同条件下获得的数据,这些数据来自之前对COL-26和PDR-1的研究。CLR-1、CLR-2、XLR-1、PDR-1、PDR-2、ALA -1和COL-26的调控显示出广泛的重叠(图3)。此外,通过染色质免疫沉淀测序(ChIP-seq), ce1-1启动子被证明与XLR-1和CLR-2直接结合。
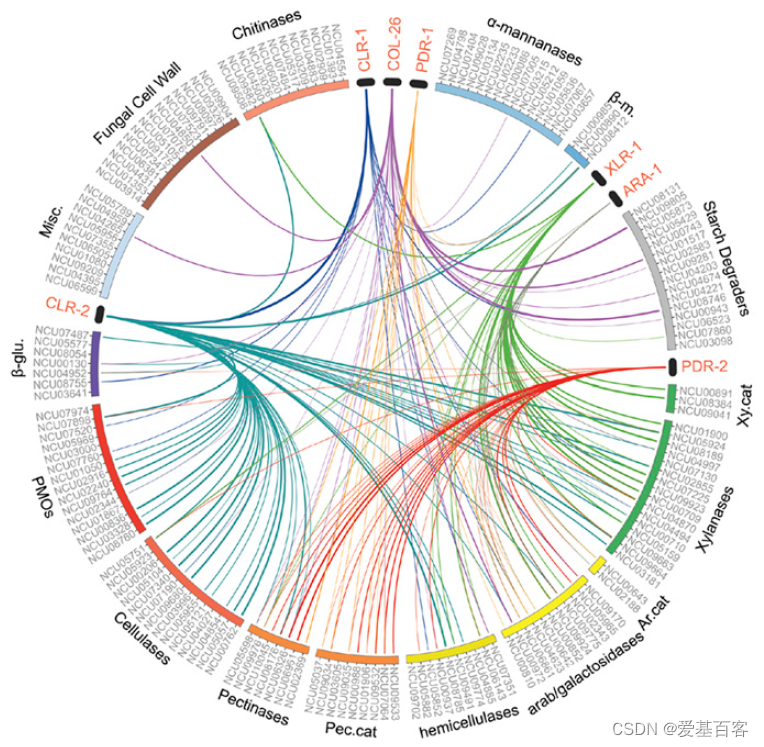
图3.N. crassa主要PCWDE调控因子的重叠调控
3. 利用DAP-Seq技术鉴定N. crassa转录因子的直接靶点
为了确定参与植物生物量解构的转录因子的直接调控,研究人员使用了DAP-seq。为了确保DAP-seq是一种有效的方法来识别植物细胞壁解构转录因子的直接结合位点,研究人员对 CLR-1 和 XLR-1 的 ChIP-seq 和 DAP-seq 数据进行比较,结果显示这两个数据集有很强的重叠。
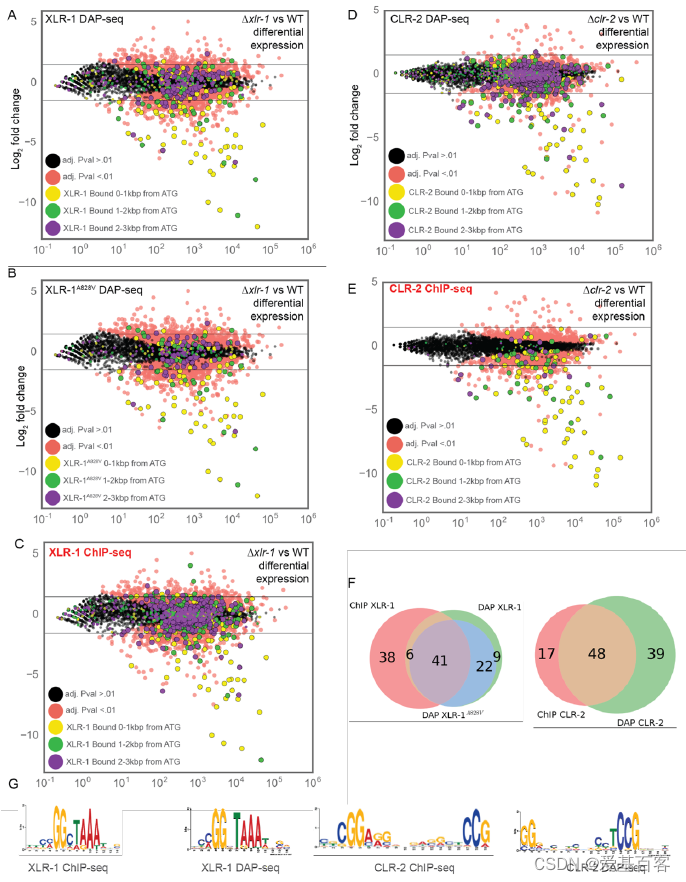
图S4.利用已公布的XLR-1和CLR-2的ChIP-seq数据进行DAP-seq验证
在T. reesei中,一个具有组成性活性的xyr1等位基因(与N. crassa xlr-1同源)在c端预测的α-螺旋上含有一个氨基酸取代(丙氨酸到缬氨酸)。在N. crassa xlr-1中构建同源突变(A828V)导致菌株表现出诱导剂依赖性表达和半纤维素酶的产生。为了检验该突变是否影响XLR-1的结合亲和力,研究人员还对XLR-1A828V突变体进行了DAP-seq。XLR-1A828V突变体的结合靶点与XLR-1的结合靶点大量重叠,表明A828V突变体对XLR-1 DNA结合亲和力的影响很小甚至可以说没有影响。
4. DAP-Seq提示CRE-1介导的碳分解代谢抑制的多层次系统
CRE-1是碳分解代谢物抑制的主要调控因子,在存在首选碳源时,参与利用非首选碳源的基因的表达受到抑制。与 CRE-1 结合的未表征糖转运蛋白sut-28 (NCU05897;注释为聚焦渗透酶的)是黑鼠李糖l -鼠李糖转运体RhtA的预测同源物。sut-28突变体在l -鼠李糖上的生长减少,并且在较小程度上在聚半乳糖醛酸上生长减少(图4A),并且消除了Δ sut-28细胞中l -鼠李糖的摄取(图4B)。与Δpdr-1突变体类似,Δsut-28细胞未能激活鼠李糖分解代谢基因l -鼠李糖酸脱水酶(NCU09034)的表达(图4C)。与WT相比,当暴露于l -鼠李糖或l -鼠李糖和葡萄糖时,Δcre-1细胞中sut-28的表达更高,Δcre-1细胞在暴露于果胶和葡萄糖时,与WT相比,l -鼠李糖的摄取增加(Fig. 4D)。这些数据支持CRE-1 DAP-seq数据,表明CRE-1负性调节sut-28的表达。
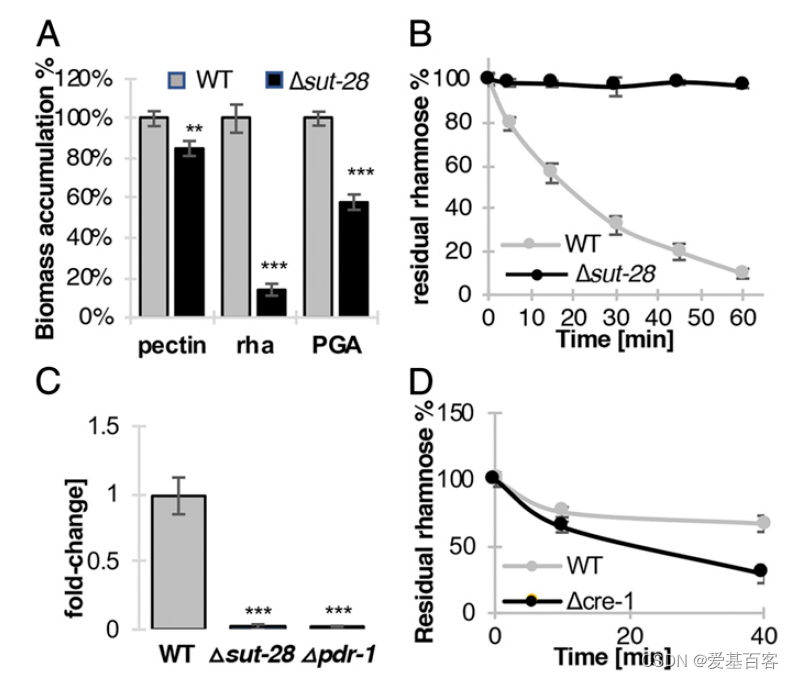
图4.WT和Δcre-1菌株中sut-28的表达和鼠李糖转运活性
研究人员的数据表明,CRE-1 介导的碳分解代谢物抑制通过糖转运蛋白、转录因子、糖分解代谢和 PCWDE 基因发挥作用,从而调节植物细胞壁降解。CRE-1 通过抑制糖转运蛋白、转录因子和参与植物生物质成分利用的基因的表达来调节 PCWDE 调节子的表达。转运到细胞中的糖可能在纤维素分解、半纤维素分解和果胶分解基因表达所必需的转录因子的激活中发挥直接或间接的作用(图5)。
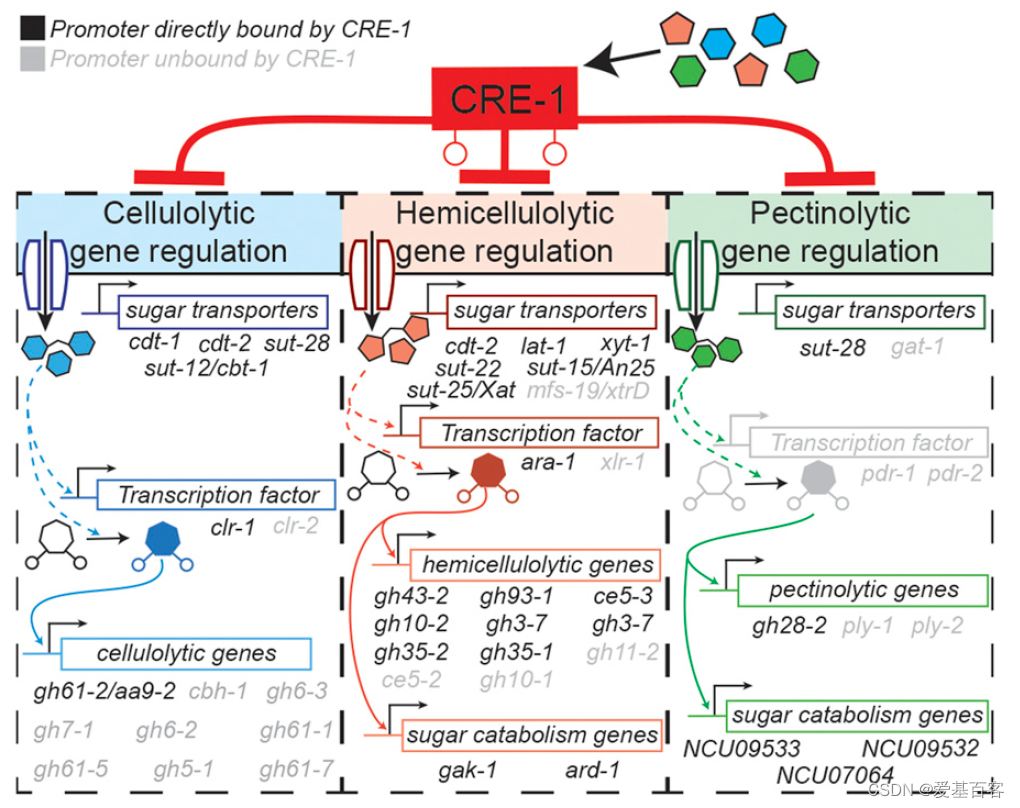
图5.CRE -1介导的碳分解代谢抑制通过糖转运蛋白、转录因子、糖分解代谢和PCWDE基因调控植物细胞壁降解
5. VIB-1基因的DAP-Seq揭示了其在碳代谢调控中的全局作用
VIB-1是一种Zn2Cys6转录因子,首次因其在N. crassa中介导自体/非自体识别和异核体不相容性中的作用而被鉴定。使用DAP-seq,研究人员在1742个基因的ATG起始位点上游1.5 kb内确定了VIB-1结合位点。RNA-seq数据集被用来过滤DAP-seq数据,总共鉴定出238个VIB-1的直接靶基因。
对这些直接靶点的基因表达数据进行分层聚类分析表明,在一个聚类中包含了Δvib-1突变体在三种以上条件下下调的大部分基因。研究者认为这些基因是VIB-1的核心调控基因(图6A)。核心调控基因1.5 kb启动子区域内VIB-1峰的一致结合基序显示了三个关键碱基的保守性:T, A和C(图6B)。综合分析确认只有clr-2和pdr-2基因编码的转录因子是VIB-1的直接靶点(图6C)。编码PCWDEs的其他基因在Δvib-1突变体中被下调,但其启动子中没有VIB-1结合位点,这可以通过clr-2或pdr-2的表达减少来解释(图6C),这与Δvib-1突变体中纤维素和果胶底物的严重生长缺陷一致。
DAP-seq数据表明VIB-1通过clr-2促进纤维素酶基因的表达。然而,ChIP-seq鉴定vib-1是纤维素酶调节因子CLR-1的靶标。CLR-1也与启动子结合,是clr-2表达所必需的。缺陷培养结果表明,CLR-1和VIB-1对clr-2的调节存在相互作用,并且CLR-1 和 VIB-1 都是纤维素酶基因完全激活所必需的。
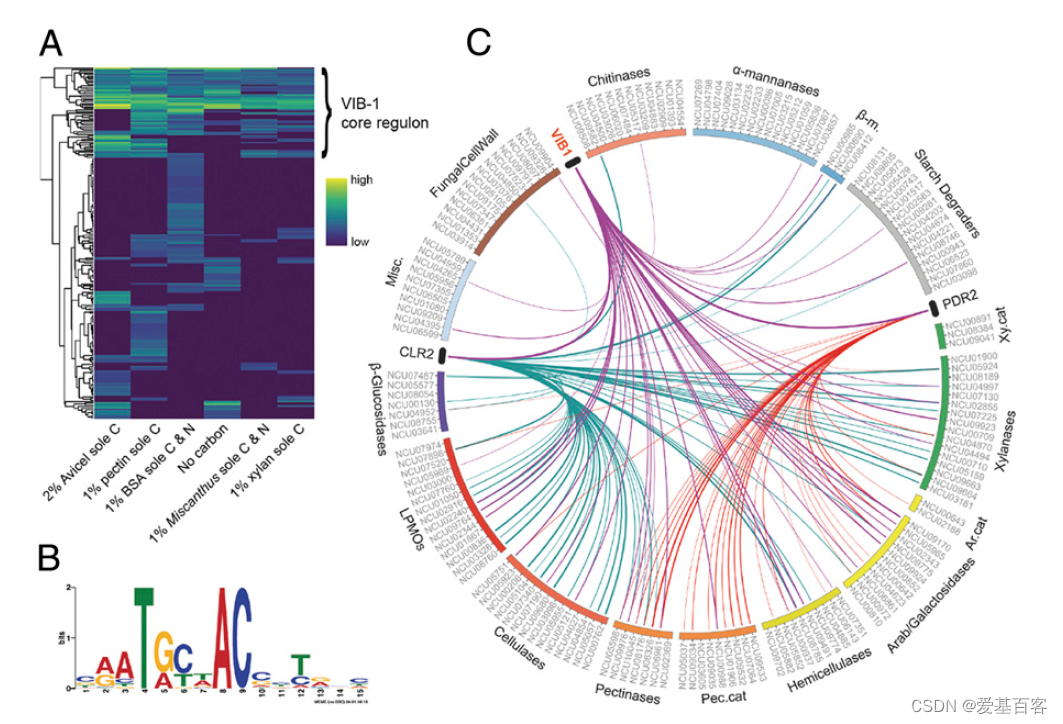
图6.VIB-1调节子
04 研究总结
本文进行了Neurospora crassa在40种不同碳源上的转录组分析以提供真菌如何感知简单到复杂碳水化合物的数据。通过这些数据,研究人员鉴定了Neurospora crassa中的调控因子,并表征了其中一个(PDR-2)与果胶利用相关,另一个与果胶/半纤维素利用相关(ARA-1)。同时,通过体外DNA亲和纯化测序(DAP-seq),研究人员确定了参与调节编码植物细胞壁降解酶的基因的转录因子的直接靶标。阐明了转录因子 VIB-1 在编码植物细胞壁降解酶和营养物清除的基因的调节中的作用,并揭示了碳分解代谢物阻遏物 CRE-1 在调节主要促进子表达中的主要作用转运基因。这些数据有助于更全面地了解转录因子与其靶基因之间的串扰,这些转录因子参与调节全球水平的养分传感和植物生物量利用
爱基百客部分DAP-seq项目经验