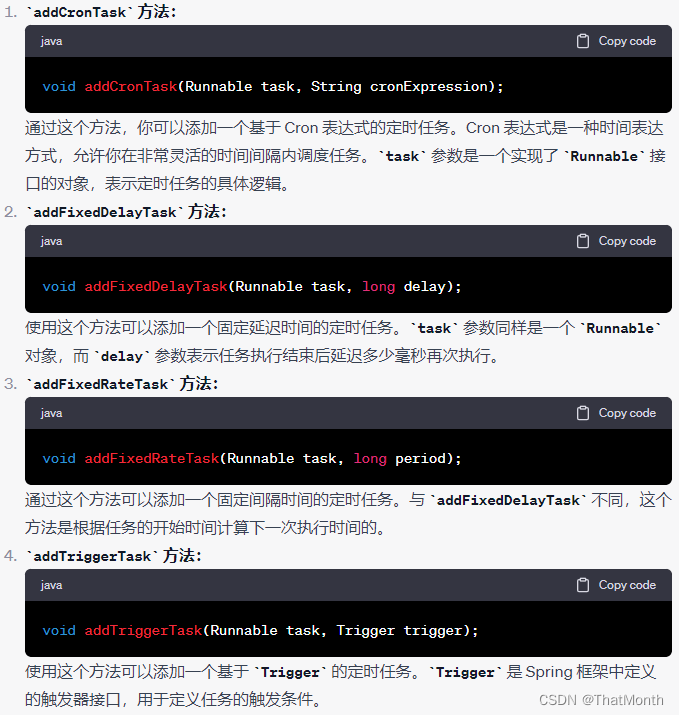
今天给同学们分享一篇生信文章“A glycolysis-related two-gene risk model that can effectively predict the prognosis of patients with rectal cancer”,这篇文章发表在Hum Genomics期刊上,影响因子为4.5。

结果解读:
COAD和READ之间的糖酵解相关预后基因比较
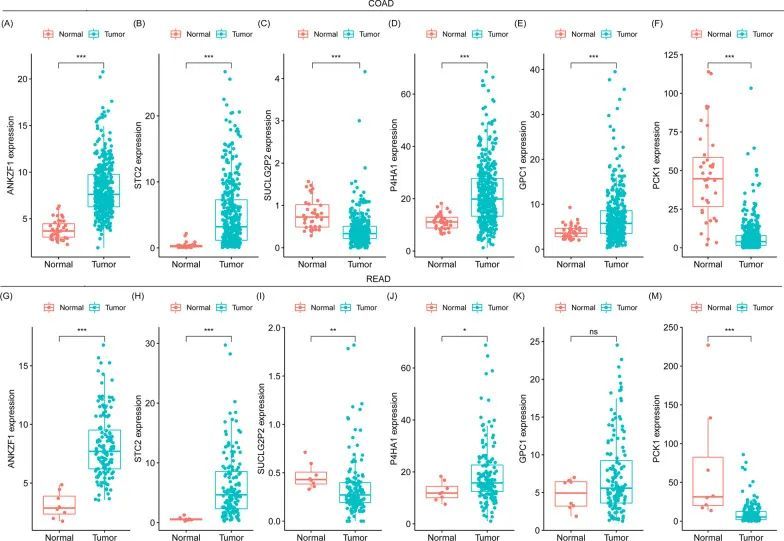
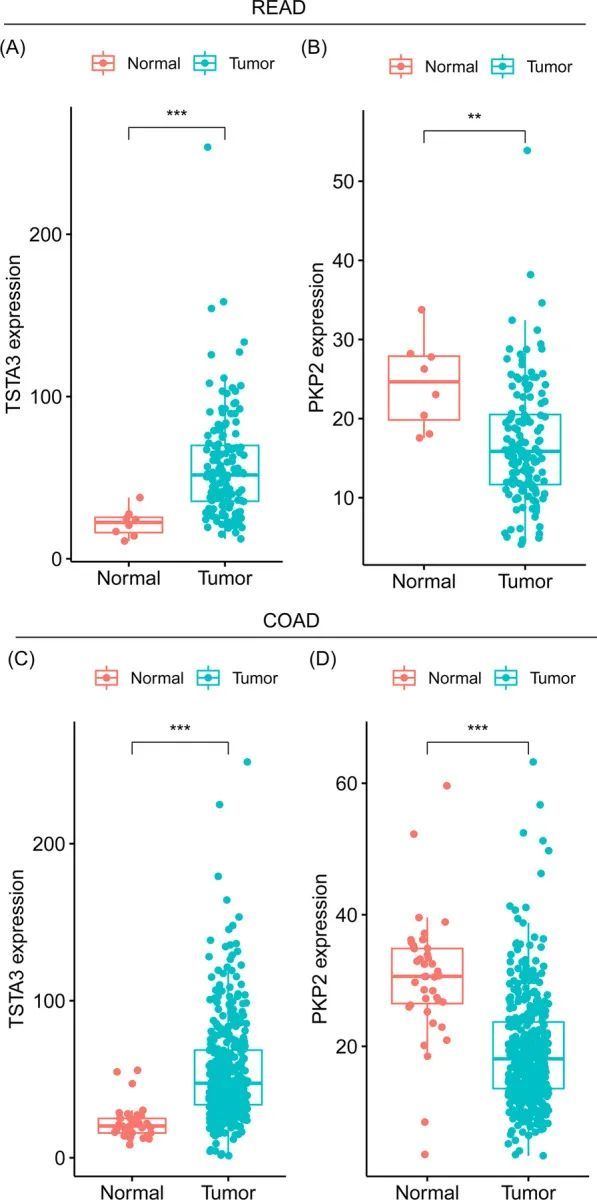
上述基因集中共包含316个基因,用于进一步分析。随后,分别以p值<0.05和|log2FC|>0作为截断标准,在READ中确定了199个与糖酵解相关的差异表达基因(DEGs),在COAD中确定了254个与糖酵解相关的差异表达基因(DEGs)。为了进一步探索COAD和READ中的预后基因,通过单变量Cox回归分析了与糖酵解相关的DEGs。在COAD中发现了9个基因(STC1、ANKZF1、STC2、SDHB、SUCLG2P2、P4HA1、PPFIA4、GPC1和PCK1),在READ中发现了4个基因(TSTA3、IDH3A、PKP2和ACO2),它们与总生存期(OS)显著相关(p值<0.05) 。在COAD和READ中,没有同样的基因与OS显著相关。随后,分别在COAD和READ中进行多变量Cox回归分析。在COAD中,证实了ANKZF1、STC2、SUCLG2P2、P4HA1、GPC1和PCK1等6个基因是独立的预后因子。在READ中,证实了TSTA3和PKP2这两个基因是独立的预后因子。作者比较了癌组织和相邻正常组织中上述基因的表达水平,发现ANKZF1、STC2和P4HA1明显上调,而SUCLG2P2和PCK1在COAD和READ中都下调,这些基因是COAD的独立预后基因(图1)。虽然GPC1在COAD中显著上调,但在READ中没有上调(图1)。在READ的独立预后基因中,作者发现TSTA3明显上调,而PKP2在COAD和READ中都下调(图2)。综上所述,这些结果表明COAD和READ之间存在不同的与糖酵解相关的预后基因。
糖酵解相关的COAD预后模型不适用于READ
首先,作者基于结直肠癌(COAD)的独立预后基因建立了一个风险评分模型,分别用于评估COAD和直肠癌(READ)患者的生存情况。风险评分模型的公式如下:风险评分 = ANKZF1的表达 ×(0.543)+ STC2的表达 ×(0.257)+ SUCLG2P2的表达 ×(-2.124)+ P4HA1的表达 ×(0.359)+ GPC1的表达 ×(0.326)+ PCK1的表达 ×(-0.256)。
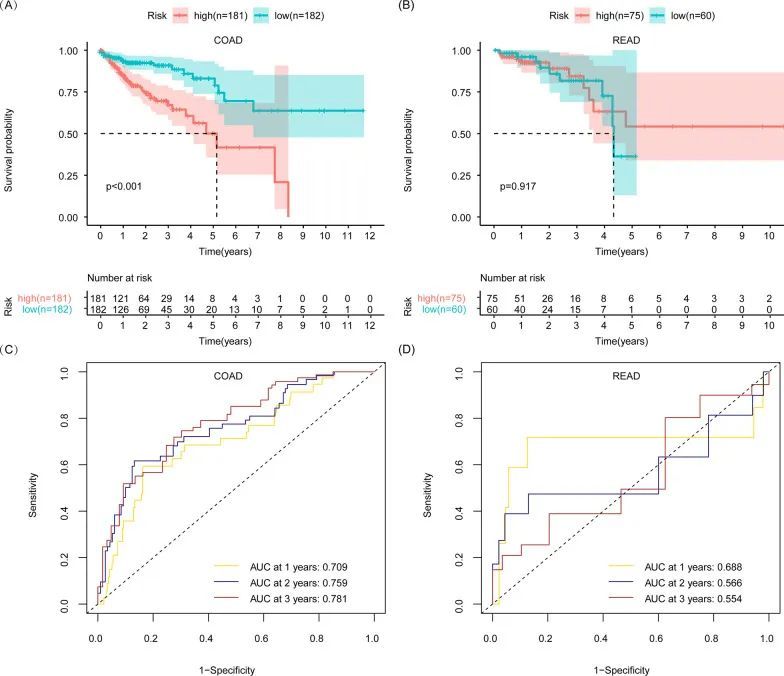
COAD患者根据整个COAD患者的中位风险评分被分为高风险组和低风险组。作者发现,风险评分高的COAD患者的生存期较短,相比之下,风险评分低的患者生存期较长(图3A)。进一步绘制了ROC曲线来评估该预测模型的可靠性。该预测模型的AUC随时间稳步累积,并在3年时达到0.781,表明该模型在预测COAD患者生存方面具有较高的敏感性和特异性(图3C)。作者想知道COAD的风险评分模型是否能够区分READ患者的预后。根据COAD的风险模型公式计算了READ患者的风险评分。根据整个COAD患者的中位风险评分,READ患者也被分为高风险组和低风险组。作者发现,COAD的糖酵解相关预后模型无法区分READ患者的预后,根据Kaplan-Meier生存分析(图3C)。此外,ROC曲线在READ中的3年AUC为0.554(图3D),低于COAD的AUC。此外,根据COAD预后模型,将READ患者分为高风险组和低风险组,根据整个READ患者的中位风险评分进行划分。高风险组和低风险组的生存曲线在READ中交叉,p值>0.05。这些结果表明,COAD的糖酵解相关预后模型不适用于READ。
与糖酵解相关的READ预后模型适用于READ
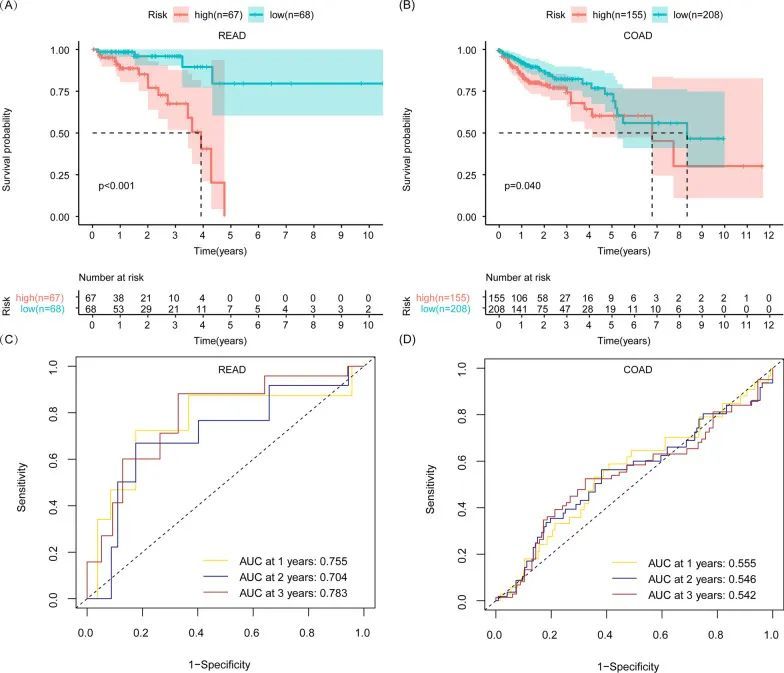
随后,作者基于READ的独立预后基因建立了风险评分模型,分别评估了READ和COAD患者的生存情况。风险评分模型的公式如下:风险评分 = TSTA3的表达 × (0.752) + PKP2的表达 × (− 0.725)。根据整个READ患者的中位数风险评分,将READ患者分为高风险组和低风险组。作者发现,风险评分高的READ患者的生存期较短(图4A)。绘制了ROC曲线来评估该预后模型的可靠性。该预测模型的AUC随时间稳步累积,并在3年时达到0.783,表明该模型在预测READ患者的生存情况方面具有较高的敏感性和特异性(图4C)。作者想知道READ的风险评分模型是否能区分COAD患者的预后。根据READ的风险模型公式计算了COAD患者的风险评分。同样,根据整个READ患者的中位数风险评分,将COAD患者分为高风险组和低风险组。作者发现,尽管COAD(图4B)中的p值小于0.05,但高风险组和低风险组的生存曲线交叉。此外,COAD(图4D)在3年时的AUC为0.542,低于READ的AUC。此外,根据READ预后模型,将COAD患者分为高风险组和低风险组,根据整个COAD患者的中位风险评分。高风险组和低风险组的生存曲线在COAD中仍然交叉,p值大于0.05。这些结果表明,READ风险评分模型对于READ比对于COAD更为适用。
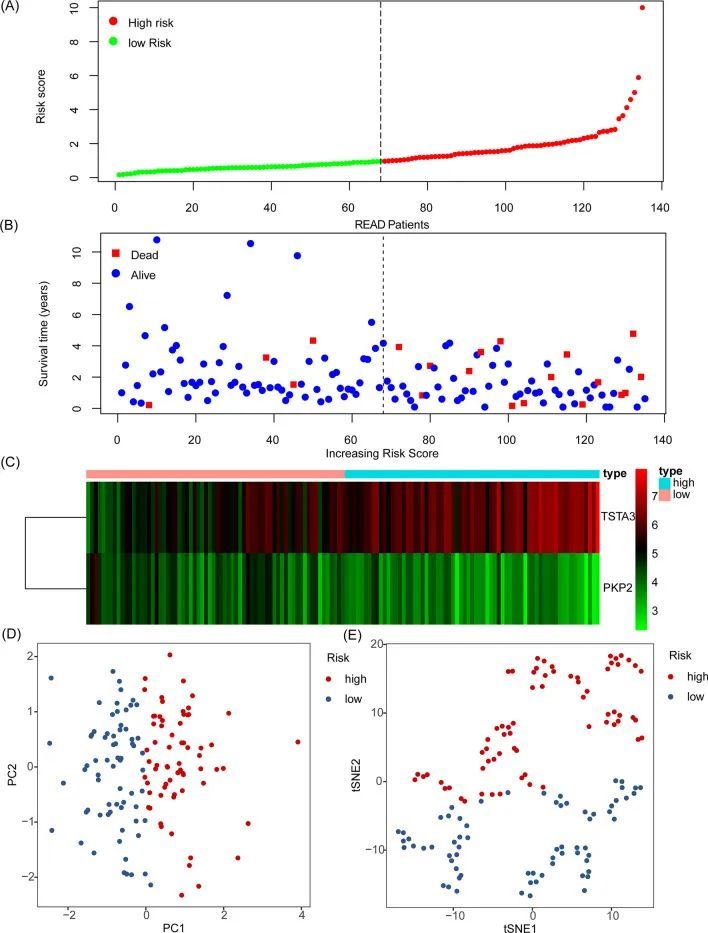
为了提供READ中风险评分、生存状态和基因表达的可视化。图5A-C显示了每个READ患者的两个基因的风险评分、生存状态和基因表达。PCA和t-SNE分析证实了两个亚组中的READ患者在离散方向上的分布(图5D-E)。
对READ患者的糖酵解相关READ预后模型的评估
为评估该预测模型的临床实用性,进行了单变量和多变量Cox比例风险回归分析,将这个双基因风险模型与常见的临床病理特征进行比较。单变量分析显示年龄、TNM分期和风险评分与直肠癌患者的生存相关(图6A)。这三个因素在随后的多变量Cox分析中进一步被证明是独立的预后指标(图6B),表明这个双基因风险模型可以作为预测直肠癌患者预后的有希望的工具。Kaplan-Meier曲线表明年龄较大、N分期较高、转移状态、TNM分期较高和风险评分较高的患者预后较差。相反,性别和T分期对直肠癌患者的预后没有影响(图6C-H)。
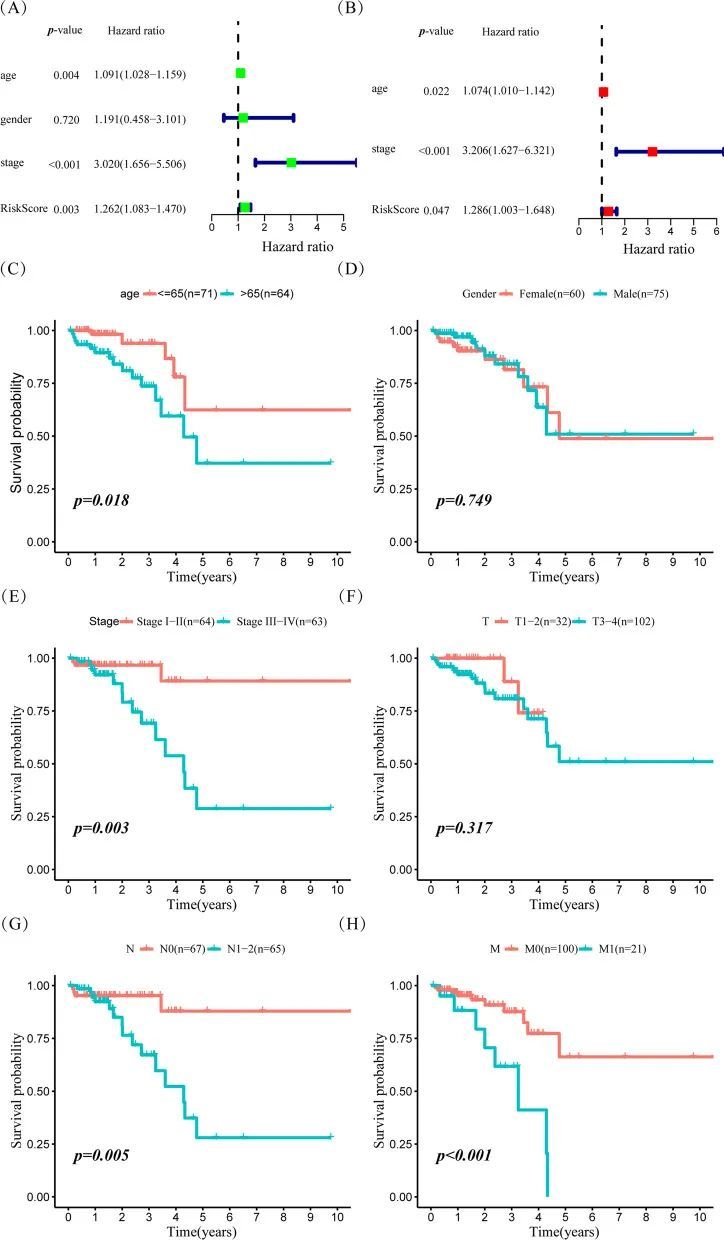
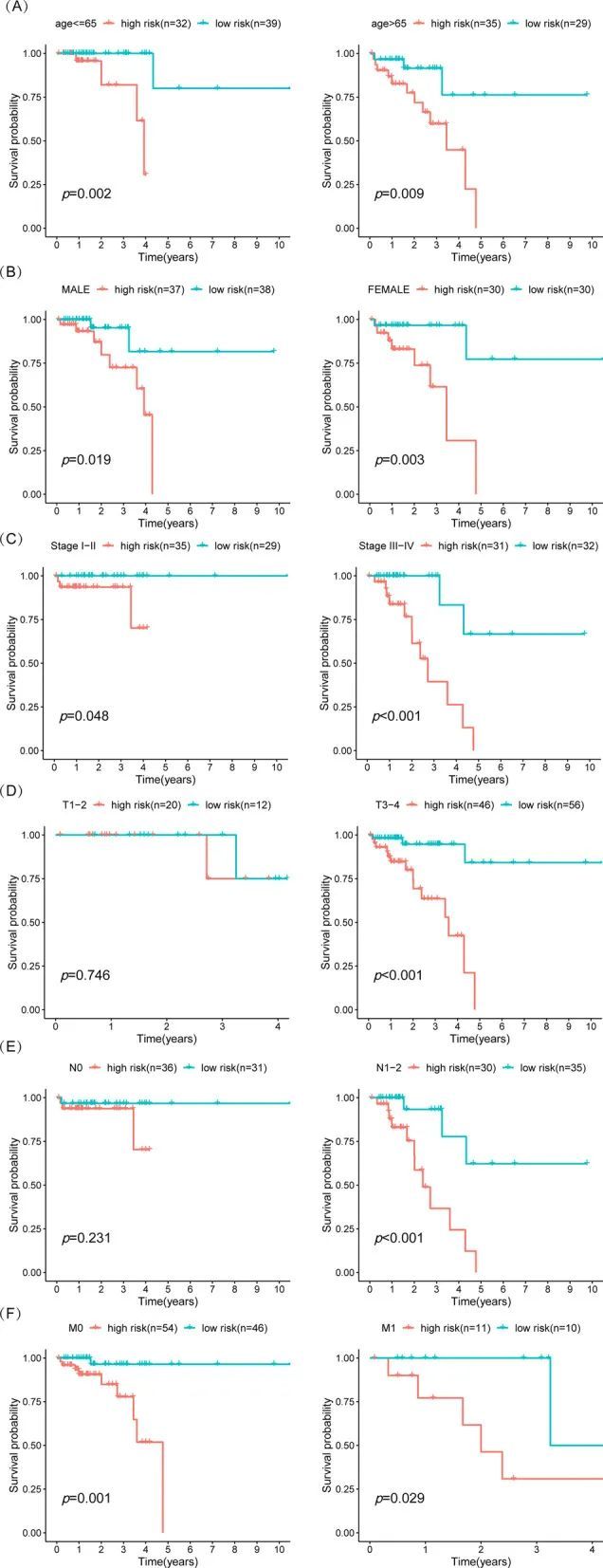
为了进一步验证这个双基因模型在预测直肠癌预后方面的有效性,根据年龄(≤ 65岁 vs > 65岁)、性别(女性 vs 男性)、T分期(T1–2 vs T3–4)、N分期(N0 vs N1–2)、M分期(M0 vs M1)和AJCC TNM分期(I–II期 vs III–IV期),将患者分为不同的亚组。然后根据中位风险评分将其分为高风险评分组和低风险评分组。有趣的是,这个双基因风险模型在不同的年龄、性别、M分期和AJCC分期亚组中仍然显示出强大的有效性(图7A–F)。然而,在N0分期和T1–2分期亚组中,高风险评分并没有提示不良预后(图7A–F),这表明风险评分模型可能在直肠癌晚期阶段更具有效的预后标志物。
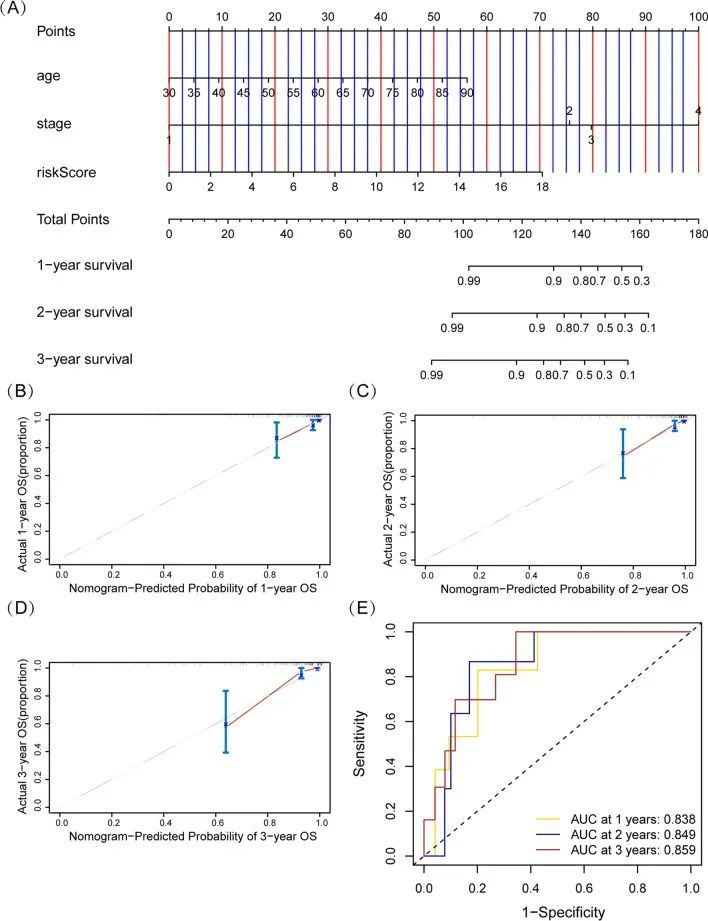
构建并评估一个包含两基因风险评分模型和临床特征的图表
为了为肛门直肠癌患者提供一种临床可用且实用的工具来估计其生存时间,作者建立了一个结合风险评分和临床病理特征(年龄和TNM分期)的评分卡(图8A)。校准图表显示,与理想模型(45°线)相比,评分卡拟合良好,如图8B-D所示。评分卡的C指数为0.852,表明该评分卡具有出色的稳定性。ROC曲线显示,评分卡在1年、2年和3年的AUC分别为0.838、0.849和0.859,优于单独使用临床因素或风险评分模型的结果(图8E)。
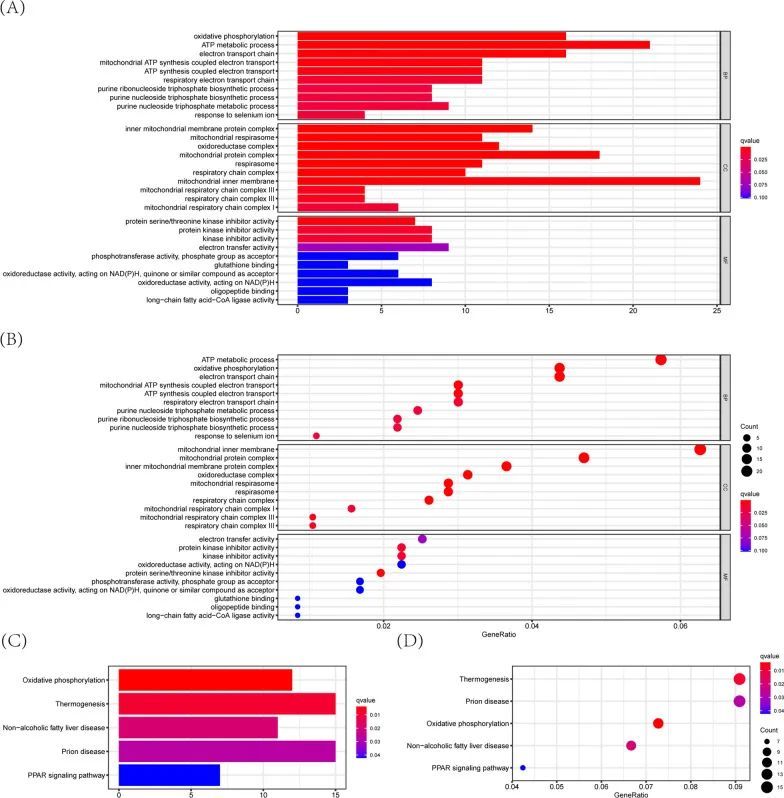
直肠癌患者中高风险组与低风险组之间的功能分析
为了阐明在高风险组和低风险组中可能发挥潜在作用的不同生物功能或途径,使用两组之间的差异表达基因(|log2FC| ≥ 0.6,FDR < 0.05)进行GO富集和KEGG分析。正如预期的那样,差异表达基因在几个与糖酵解相关的分子功能或途径中富集,例如氧化磷酸化(p值<0.05)(图9A-D)。这些结果表明,根据糖酵解相关的READ预后模型,高风险组和低风险组之间的糖酵解相关的分子功能或途径确实存在差异。
总结
作者的研究首次比较了COAD和READ之间的糖酵解相关基因特征,发现COAD和RED之间存在不同的糖酵分解相关预后基因,并表明COAD的糖酵分析相关预后模型不适合READ。作者的研究确定了两个新的与直肠癌症患者预后相关的甘氨酸相关基因(PKP2和TSTA3),并进一步建立了基于两个新甘氨酸有关基因的风险模型,以有效预测直肠癌症患者的预后。作者的研究深入了解了糖酵解在癌症发展中的潜在作用,需要进一步研究。