不可成药的三大类靶点
传统的药物靶点绝大部分是具有适合的结合位点和明确的活性位点的蛋白质。药物分子往往通过“占位驱动”的药理学作用模式发挥作用。这种方法虽然可行,但并不能适用于所有的靶蛋白,尤其是在蛋白本身缺乏相应的结合口袋、蛋白的内源性底物高亲和力、蛋白存在于细胞内部药物分子无法抵达、蛋白的致病机制不依靠蛋白间相互作用或催化活性等情况下。
随着对癌症进展的分子基础和多种驱动因素的深入理解,科学家开始寻找能够高效抑制生长因子受体、酶类或其他靶点的药物。
如图 1 所示,许多的癌症靶点都有破坏其功能的药物,通常被认为是“可成药”的药物靶点 (红色标注)。磷酸酶、转录因子和 RAS 家族成员是“不可成药”的三大类靶点 (绿色标注)。
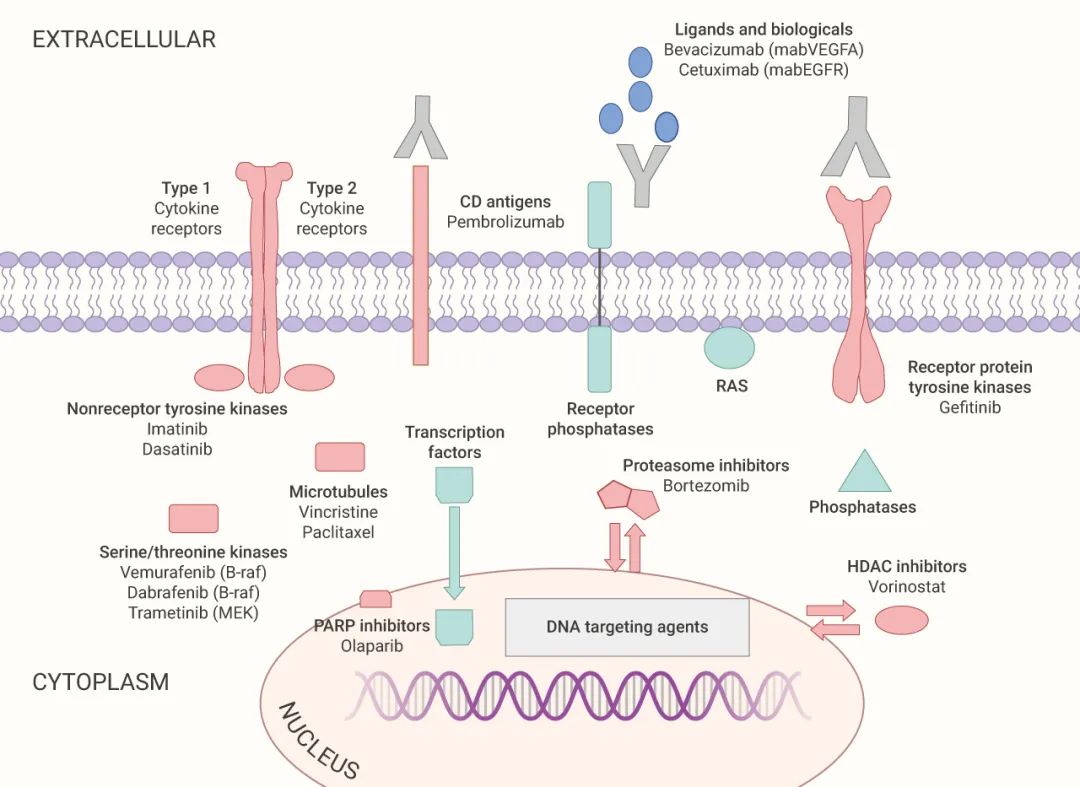
图 1. 当代癌症药物分子靶点的示意图[1]
RAS 家族成员
RAS 是人类癌症中最常发生突变的癌基因;RAS 存在三种不同的亚型 (KRAS、HRAS 和 NRAS) 中,它们具有高度的序列同源性。RAS 蛋白具有固有的 GTPase 活性,在非活性 (GDP 结合) 和活性 (GTP 结合) 形式之间循环。当与 GTP 结合时,它被“打开”并激活细胞内信号通路,突变的 RAS 被持续性激活并持续“开启”,从而增强下游信号并导致肿瘤发生。
下面简单总结了针对 RAS 突变肿瘤抑制剂主要包括:抑制 RAS 上游蛋白、RAS 蛋白以及 RAS 下游蛋白三个层面的抑制剂。
■ 抑制 RAS 上游蛋白
受体酪氨酸激酶的激活,如 EGFR 家族成员,可促进 RAS 中 GDP 与 GTP 的交换,从而激活 RAS。那么,抑制 EGFR 可以减少这种激活。突变 RAS 蛋白以 GTP 结合状态积累。抑制 SOS 或 SHP2 会降低 GDP-GTP 交换率,并减少 GTP 结合的 RAS 数量。
■ 直接靶向 RAS 蛋白
在10年前,直接针对 RAS 抑制剂还非常难以捉摸,随着科学家的不断努力,KRAS 抑制剂 Sotorasib 获 FDA 批准上市, 用于治疗 KRAS G12C 突变的局部晚期或转移性非小细胞肺癌成年患者。此外还有 KRAS-G12C 结合的共价等位基因特异性抑制剂等正在临床实验阶段。
■ 靶向 RAS 下游蛋白
GTP 结合的 RAS 通过与效应蛋白(如 RAF 和 p110)的 RAS 结合域结合来激活下游信号,从而分别激活 MAPK 和 PI3K 信号通路。MAPK 和 PI3K 信号通路的每个激酶层面都可以被抑制的。
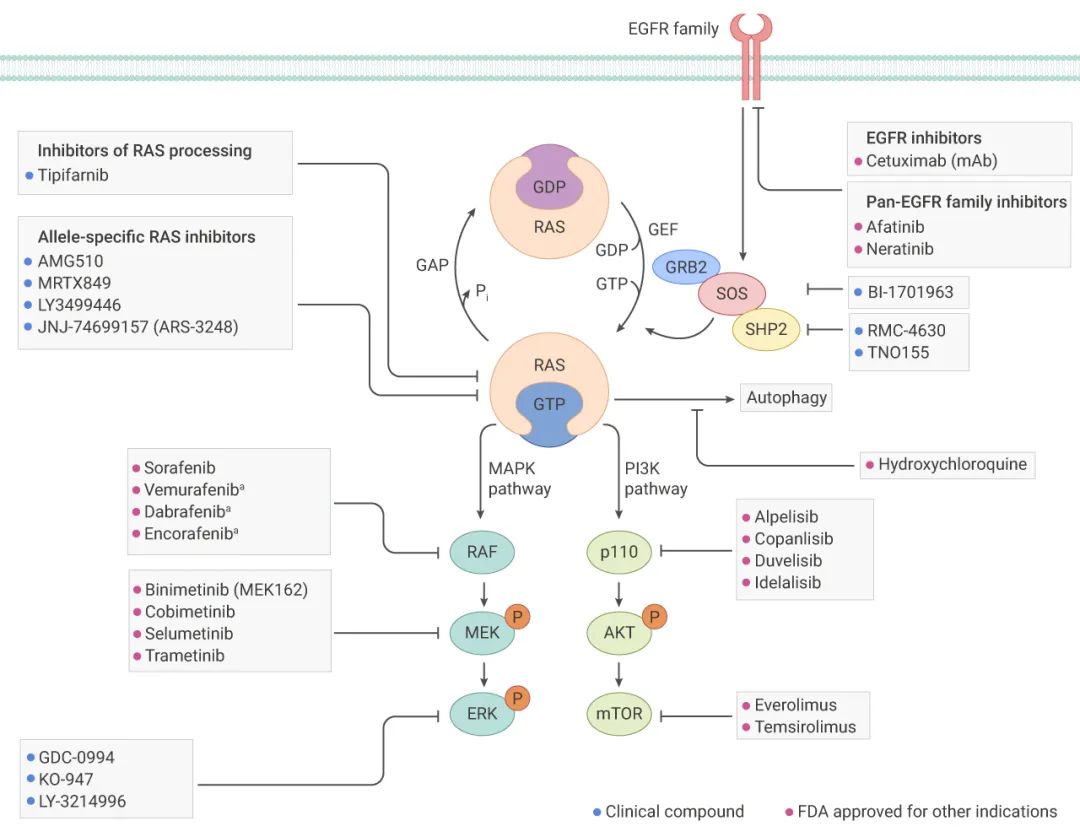
图 3. RAS 突变肿瘤抑制剂的研究进展[4]
转录因子
转录因子在癌症、自身免疫、糖尿病和心血管疾病等疾病中扮演着十分重要的生物学角色。然而,由于严重的结构紊乱和缺乏明确的小分子结合腔,转录因子在传统上被认为是“不可治疗”的靶点。
在许多癌症进程中,转录因子可以通过多种作用机制发生突变或失调,包括:染色体易位、基因扩增或缺失、点突变和表达改变等。突变或失调的转录因子可以介导异常的靶基因表达,是一类独特的药物靶点。
目前已经证明了多种靶向转录因子活性的方法,主要包括
■ 抑制转录因子-辅因子的蛋白质-蛋白质相互作用;
■ 抑制转录因子和 DNA 结合;
■ 通过改变泛素化水平和随后的蛋白酶体降解或通过抑制转录因子表达调节因子,以调节转录因子活性水平。
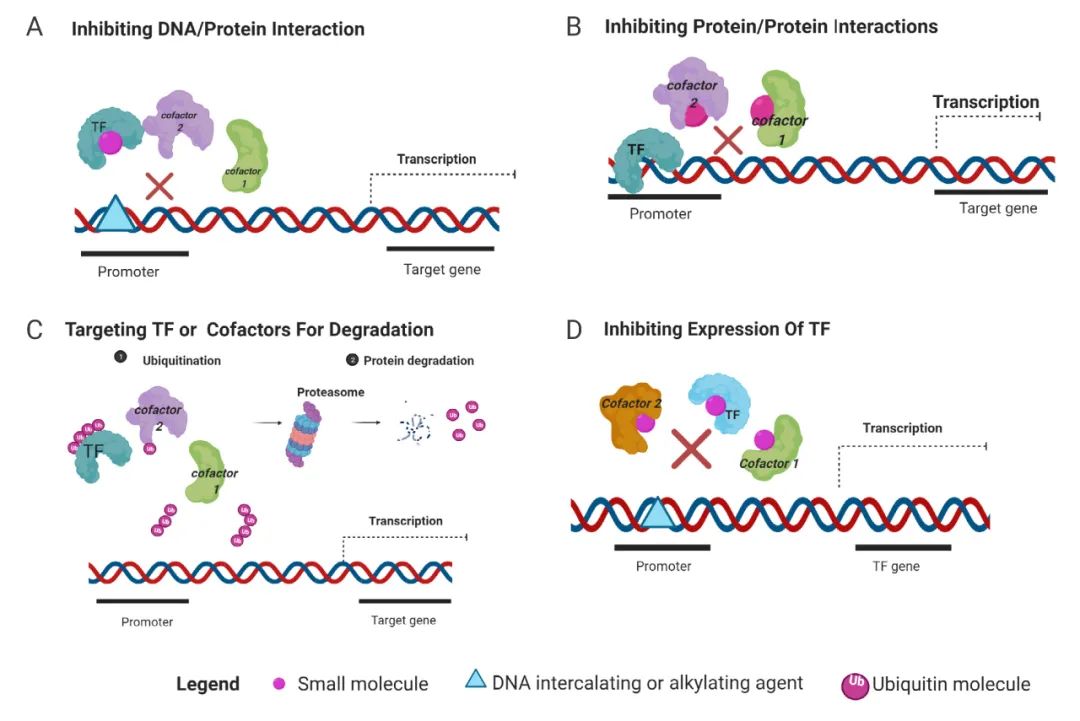
图 4. 靶向转录因子的作用机制[6]
A. 特异性小分子阻断转录因子/DNA 相互作用。B. 小分子抑制转录因子/蛋白质相互作用。C. 靶向转录因子或辅因子并通过泛素化进行降解。D. 通过抑制转录调节剂来控制转录因子的表达。
磷酸酶
磷酸酶是将目标蛋白上磷酸基团去掉的酶类。它被证明与癌症、糖尿病、肥胖症、神经退行性疾病等多种疾病密切相关。根据氨基酸底物不同,磷酸酶可以分为如下三种:
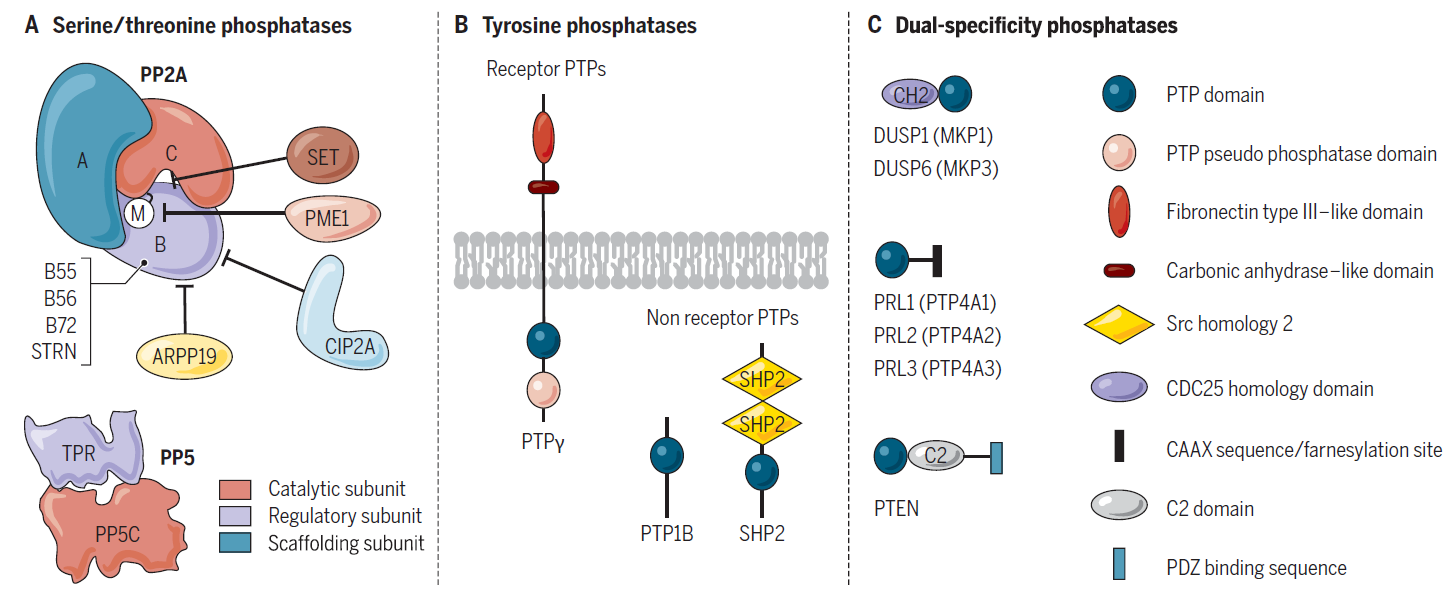
图 5. 磷酸酶家族[8]
A. 丝氨酸/苏氨酸磷酸酶,B. 酪氨酸磷酸酶(PTPs),C. 或能够使丝氨酸/苏氨酸残基和酪氨酸残基(DUSP/MKP和PRL磷酸酶) 去磷酸化的双特异性磷酸酶(DUPs)
与它相对应的蛋白激酶已经是非常成熟的药物靶点。然而,安全有效的磷酸酶抑制剂仍然难以寻觅。因此,磷酸酶在传统上被认为是“不可治疗”的靶点。
最近,这一领域发生了突破性进展。不同于大多数药物与它们靶点的活性位点相结合,这些磷酸酶抑制剂的作用方式是与活性位点之外的别构位点相结合。别构抑制可能是打破磷酸酶“不可成药”性的成功策略。
如图 6 所示,SHP2 抑制剂 SHP099、RMC-4630 和 SHP244 结合致癌性 SHP2 磷酸酶的 SH2 结构域和激酶结构域,并将酶锁定在非活性构象中。BCI-215 作为 DUSP1 和 DUSP6 的变构抑制剂,可结合在磷酸酶催化位点附近,阻碍底物结合所需的变构变化。PP2A 的间接活化剂 FTY720 和 CC11 与二聚体 PP2A 抑制剂蛋白质 SET 结合并释放 SET 单体以允许 PP2A 催化亚单位的催化活性。
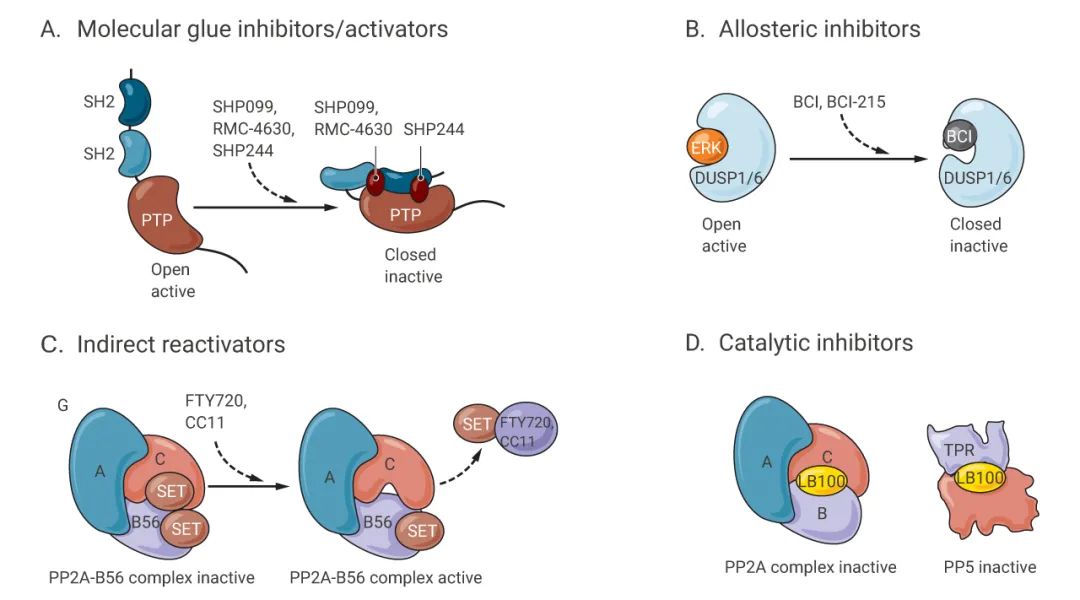
图 6. 磷酸酶靶向治疗的作用模式[8]
总结
在过去的十年中,分子癌症靶点得到了显著的验证,这些靶点以前被认为是具有挑战性的,甚至是不可克服的。其中,最显著的是“不可成药”的三大类靶点:磷酸酶、转录因子和 RAS 家族成员。
随着科学技术的不断进步,新型的小分子抑制剂 (激动剂) 和生物制剂的开发和应用极大地促进了抗肿瘤的新药研发。展望未来,我们相信:靶向“不可成药”靶点,攻克癌症指日可待。

产品推荐


<滑动查看下一张图片>
参考文献
1. Lazo JS, Sharlow ER. Drugging Undruggable Molecular Cancer Targets. Annu Rev Pharmacol Toxicol. 2016;56:23-40.
2. Blair HA. Sotorasib: First Approval. Drugs. 2021 Sep;81(13):1573-1579. doi: 10.1007/s40265-021-01574-2.
3. Cox AD, Fesik SW, Kimmelman AC, Luo J, Der CJ. Drugging the undruggable RAS: Mission possible? Nat Rev Drug Discov. 2014 Nov;13(11):828-51.
4. Moore AR, Rosenberg SC, McCormick F, Malek S. RAS-targeted therapies: is the undruggable drugged? Nat Rev Drug Discov. 2020 Aug;19(8):533-552.
5. Henley MJ, Koehler AN. Advances in targeting 'undruggable' transcription factors with small molecules. Nat Rev Drug Discov. 2021 Sep;20(9):669-688.
6. Walters HA, Temesvari LA. Target acquired: transcriptional regulators as drug targets for protozoan parasites. Int J Parasitol. 2021 Jul;51(8):599-611.
7. Bushweller JH. Targeting transcription factors in cancer - from undruggable to reality. Nat Rev Cancer. 2019 Nov;19(11):611-624.
8. Vainonen JP, Momeny M, Westermarck J. Druggable cancer phosphatases. Sci Transl Med. 2021 Apr 7;13(588):eabe2967.