今天给同学们分享一篇生信文章“m6A Regulators Is Differently Expressed and Correlated With Immune Response of Esophageal Cancer”,这篇文章发表在Dis Markers期刊上,影响因子为3.464。

结果解读:
食道癌中差异表达基因(DEGs)的鉴定和功能注释
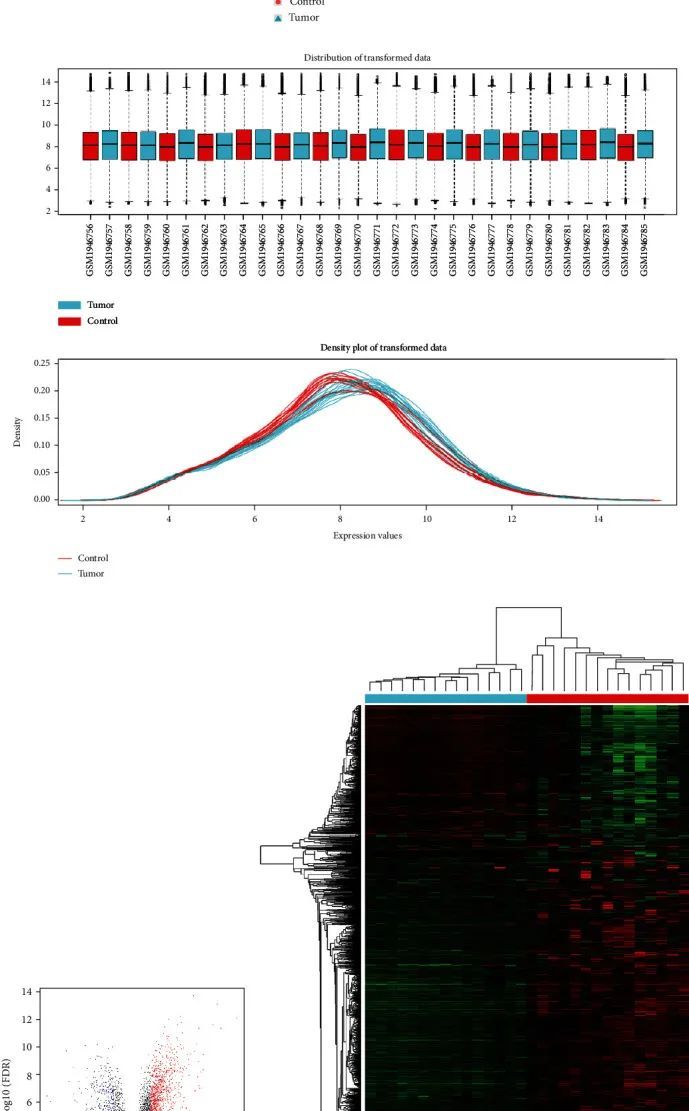
作者进行了整体分析,并绘制了箱线图、数据密度图和主成分分析(PCA)图(图1(a))。箱线图显示样本经过了归一化和标准化处理。两组不同样本明显分布在不同区域,表明样本可信。作者共鉴定出1651个差异表达基因(DEGs),其中包括1174个上调基因和477个下调基因。DEGs的火山图和热图如图1所示。
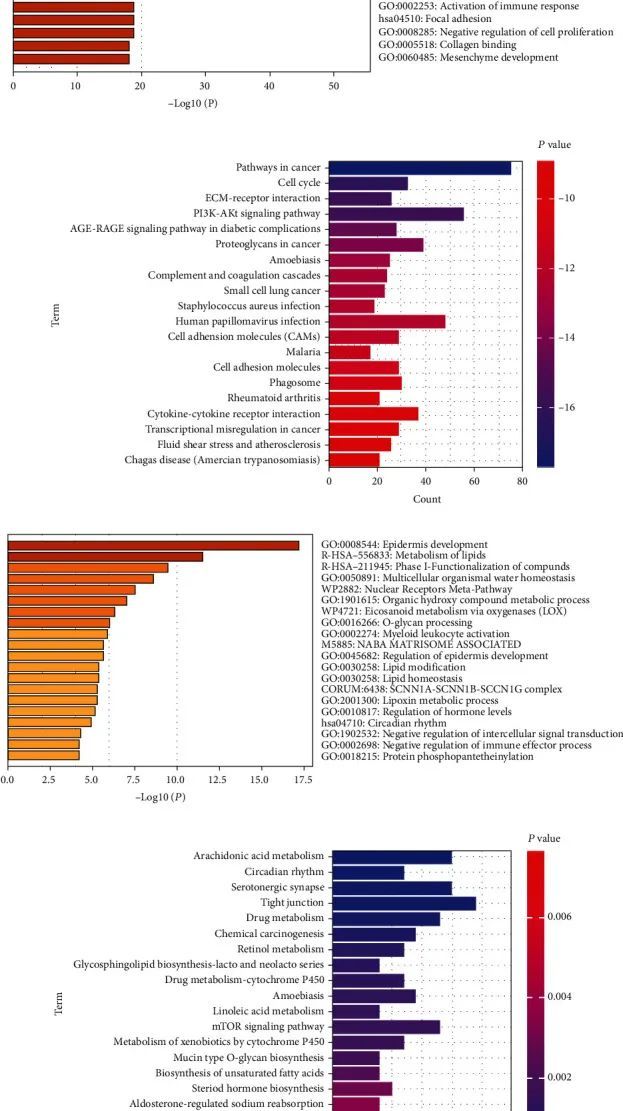
然后,作者对鉴定出的差异表达基因进行了功能注释。在总共1174个上调基因中,GO分析显示富集在细胞外基质(ECM)组织、细胞粘附的调节、细胞迁移的正调节、细胞分裂、免疫反应的激活、组织形态发生等方面(图2(a))。对于这1174个上调基因的KEGG分析显示富集在焦点粘附、细胞周期、ECM受体粘附以及PI3K-Akt信号通路等方面(图2(b))。在总共477个下调基因中,GO分析显示富集在表皮发育、脂质代谢、化合物的第一阶段功能化等方面(图2(c))。对于这477个下调基因的KEGG分析显示富集在花生四烯酸代谢、5-羟色胺能突触、药物代谢、化学致癌等方面(图2(d))。
WGCNA构建和关键模块的识别与中心基因的选择
作者使用R中的“WGCNA”软件包来识别关键模块。样本聚类显示肿瘤样本和正常样本明显分为两组。样本聚类中没有异常值(图3(a)和3(b))。参数如下:软阈值为β = 20(图3(c))。使用WGCNA软件包识别出了五个模块,包括黑色模块、蓝色模块、棕色模块、绿色模块、粉色模块和灰色模块(图3(d))。根据每个模块的特征向量,作者计算了这些模块与表型之间的相关性(图3(e))。
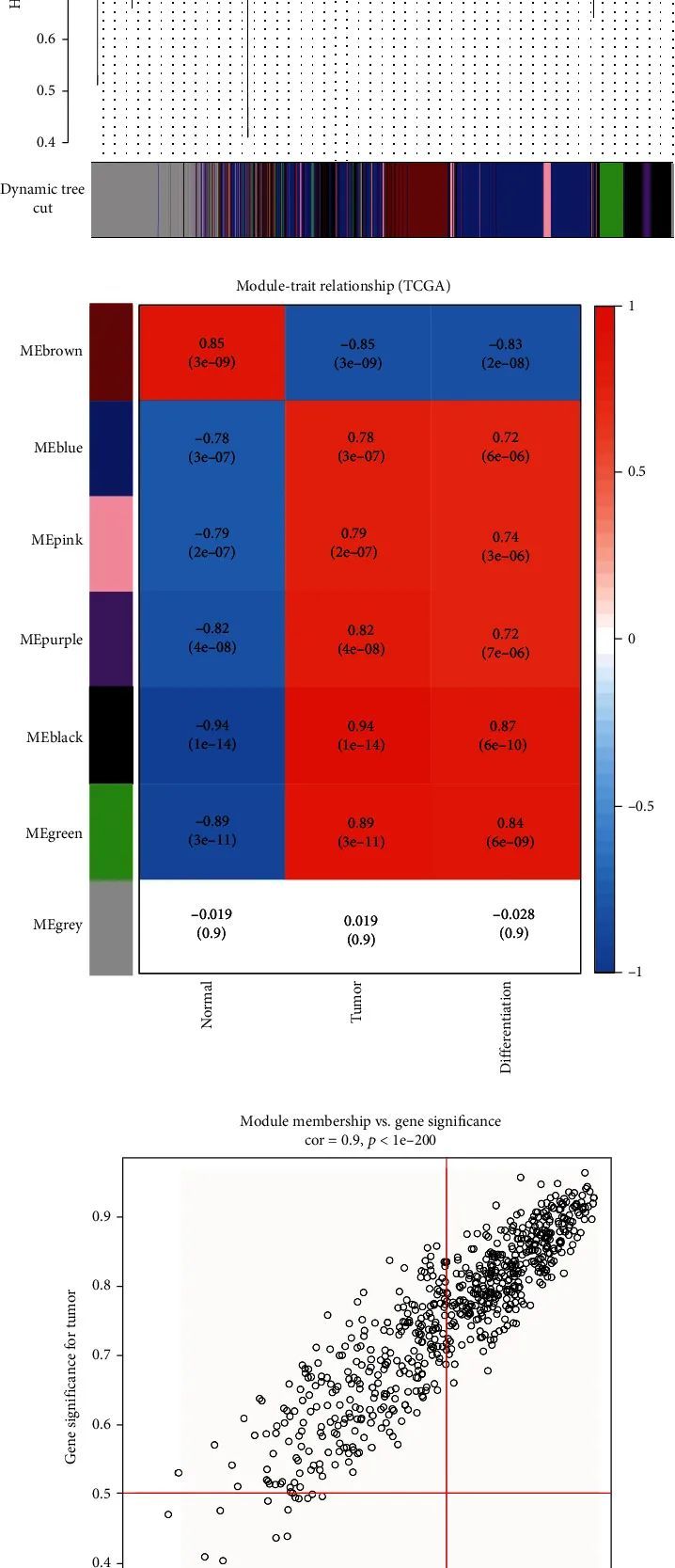
黑色模块和绿色模块与肿瘤和分化程度有很高的相关性。根据每个样本中每个基因的表达水平,作者计算了基因与表型之间的相关性,以衡量基因的重要性(GS)。GS值越大,具有更多的生物学意义,而GS = 0表示该基因与表型无关。黑色模块与肿瘤呈正相关(P = 1e − 14,相关性 = 0.94),绿色模块与肿瘤呈正相关(P = 3e − 11,相关性 = 0.89)(图3(f)和3(g))。有趣的是,黑色模块与分化呈正相关(P = 6e − 10,相关性 = 0.87),绿色模块与肿瘤呈正相关(P = 6e − 09,相关性 = 0.84)(图3(h)和3(i))。此外,根据WGCNA网络中重要基因模块的中心基因选择标准,作者从黑色模块筛选出606个基因,从绿色模块筛选出228个基因。
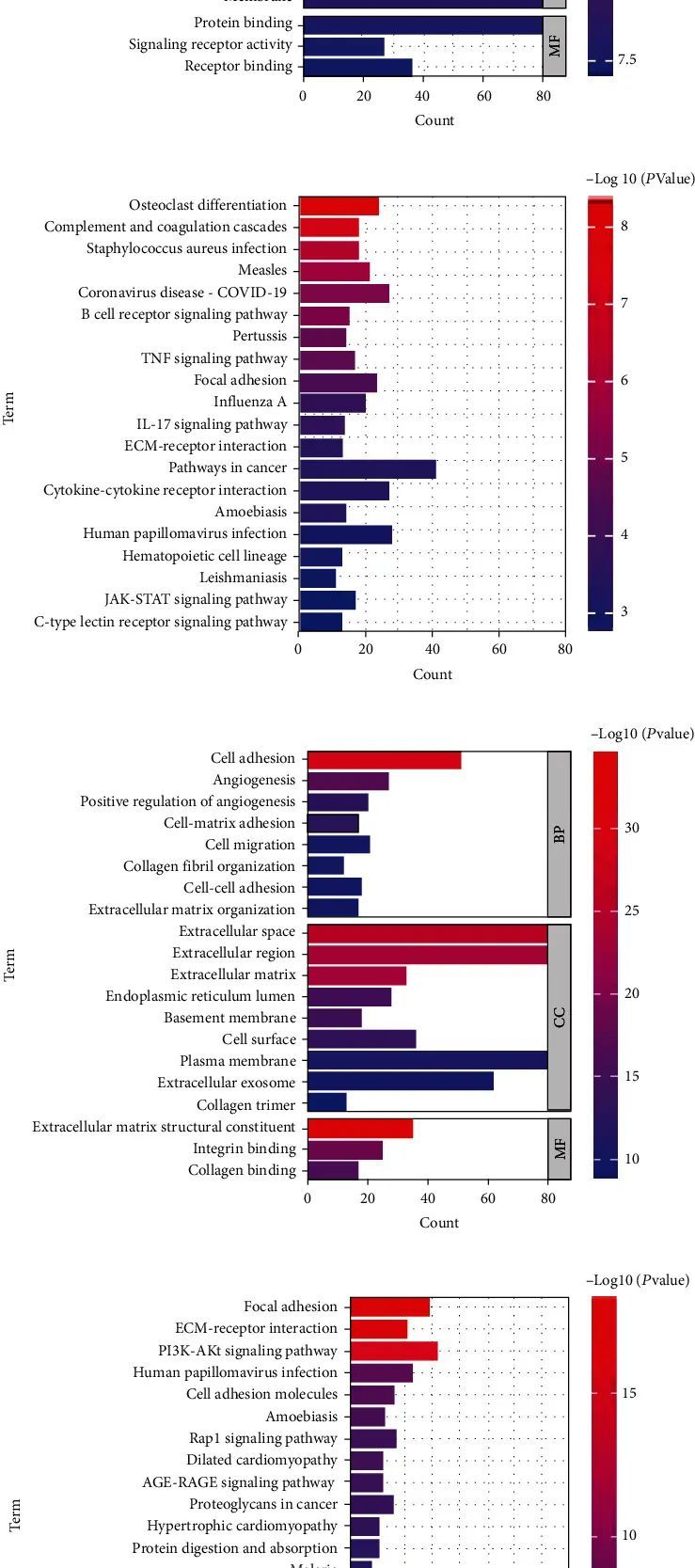
因此,作者选择了黑色和绿色模块进行进一步分析。黑色模块的GO分析显示,生物过程与细胞膜、对病毒的反应、炎症反应、先天免疫反应等相关(图4(a))。绿色模块的KEGG分析显示,通路与补体和凝血级联、B细胞受体信号通路、IL-17信号通路、细胞因子-细胞因子受体相互作用等相关(图4(b))。绿色模块的GO分析显示,生物过程与细胞外基质结构成分、细胞黏附、血管生成、血管生成的正调控、细胞迁移等相关(图4(c))。绿色模块的KEGG分析显示,通路与焦点粘附、细胞外基质-受体相互作用、PI3K-Akt信号通路等相关(图4(d))。
中心基因的差异分析和预测分析
作者使用TCGA数据库中食管鳞状细胞癌的RNA测序数据来分析中心基因的生存预后。从WGCNA中获得了来自黑色模块的606个中心基因和来自绿色模块的228个中心基因。然后,作者将从WGCNA的重要模块中获得的基因与正常组织和肿瘤组织之间的差异基因进行交叉,最终获得了来自黑色模块的388个中心基因和150个中心基因。这些基因不仅是正常组织和肿瘤组织之间的差异表达基因,还是与癌症表型相关的重要基因(图5(e))。对正常组织和癌组织中差异表达的中心基因进行了预后分析。图5(a)-5(d)显示了绘制的生存曲线。结果表明,包括ANGPT2、VCAN、MS4A4A和FOS在内的四个基因具有显著的预后效果。ANGPT2、FOS和MS4A4A水平高与食管癌预后不良相关,而VCAN水平高与食管癌预后良好相关。
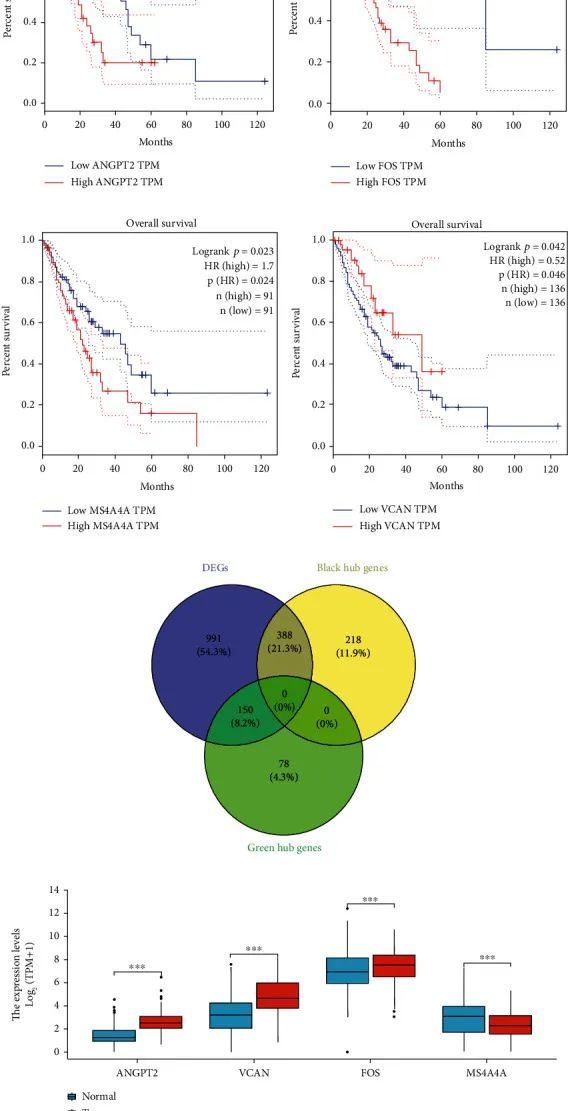
作者从公共数据库(GTEx和TCGA)中选择了食管癌患者(包括653例正常食管癌组织、13例邻近组织和182例食管癌组织)。接下来,作者分析了这四个重要基因(VCAN、ANGPT2、MS4A4A和FOS)在食管癌和正常食管组织中的表达情况。作者发现,与正常人食管组织相比,ANGPT2、VCAN和FOS在食管癌组织中显著上调,而MS4A4A在食管癌中显著下调(图5(f))。因此,这四个基因可能在肿瘤发生中起重要作用。
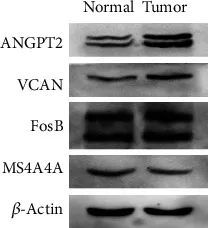
进行了Western blot实验,评估了肿瘤组织和正常组织中血管生成素-2(ANGPT2)、FosB、MS4A4A和Versican(VCAN)的表达情况。结果显示,肿瘤组织中ANGPT2、VCAN和FosB的表达水平高于正常组织(图6)。肿瘤组织中MS4A4A的表达水平低于正常组织。这些结果与肿瘤组织和正常组织之间的关键基因(ANGPT2、VCAN、MS4A4A和FOS)差异分析一致。
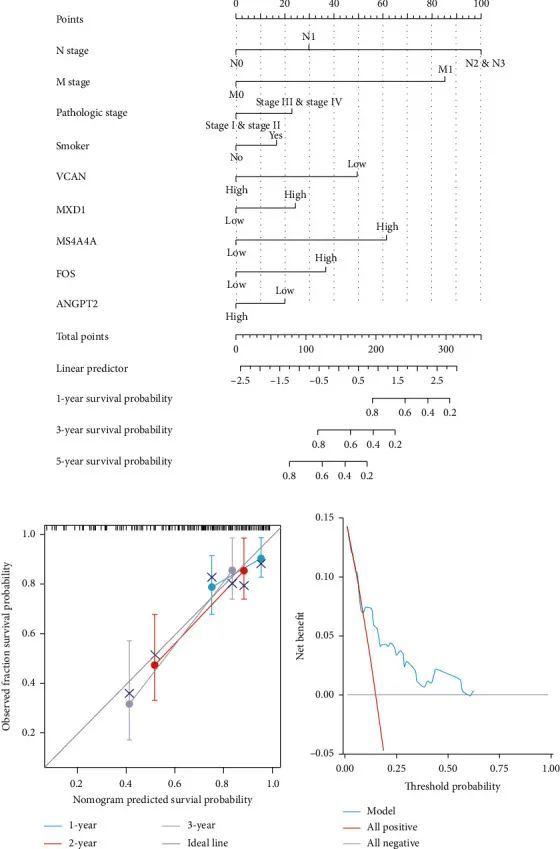
食管癌的预后模型构建
作者在食管癌中构建了一个多因素Cox分析模型作为预后模型。结果显示,M分期、N分期、VCAN和MS4A4A是多因素Cox分析中的显著预测因子。基于多因素Cox分析的结果,作者构建了一张图表,并评估了该图表的预测效能。一致性指数(C-index)为0.750(0.695-0.805),表明该模型的预测效能较为准确(图7(a))。预测模型在校准分析中拟合良好(图7(b))。决策曲线分析图显示该预测模型能够预测食管癌患者的死亡事件(图7(c))。
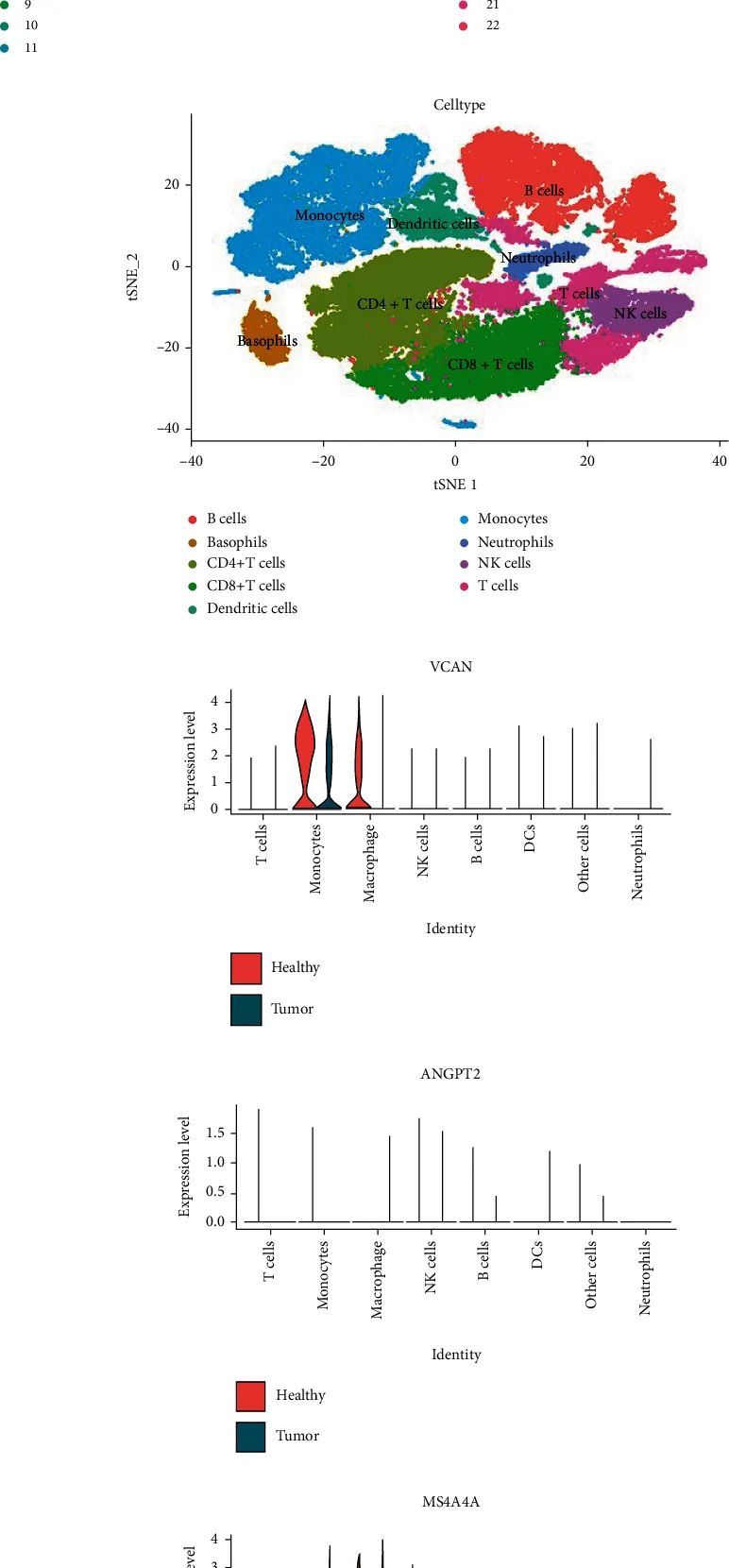
肿瘤组织和相邻组织的单细胞分析
在从WGCNA获得中枢基因后,作者进行了单细胞分析,以发现食管癌中中枢基因的机制。首先,作者对所有样本的单细胞数据进行了归一化和汇总(图8(a)–8(c))。然后,作者合并了肿瘤和邻近组织样本,进行了无监督聚类,以识别出不同的细胞群体。不同样本的细胞聚类图显示,在健康样本中有更多的NK细胞和B细胞浸润,但在肿瘤样本中有更多的CD4 T细胞浸润(图8(d))。根据免疫细胞中相关的典型标记基因,作者对不同的免疫细胞亚群进行了分类。作者区分出了七种细胞亚群,包括T细胞、B细胞、NK细胞、单核细胞、巨噬细胞、树突状细胞和中性粒细胞(图8(e))。作者主要鉴定了几种主要类型的免疫细胞,如T细胞(CD3D、CD3E和CD3G)、B细胞(CD79A、CD79B和CD19)、NK细胞(KLRD1、NKG7和GNLY)、单核细胞(CD68、LYZ、C1QA、C1QB和TREM2)、巨噬细胞(CD68、LYZ、VCAN、FCN1和THBS1)、树突状细胞(CD1C、HLA-DQB2、CD74和HLA-DQA1)和中性粒细胞(FCGR3B、MNDA和ADGRG3)。然后,作者计算了这些炎症细胞亚群中四个中心基因(ANGPT2、VCAN、MS4A4A和FOS)的表达。图8(f)-8(i)显示了肿瘤样本和相邻组织样本中细胞亚群中中心基因的差异表达。VCAN在相邻组织样本的巨噬细胞中高度表达(P值-adj = 2.02E-77)。在单核细胞中,VCAN在相邻组织样本中的表达高于肿瘤样本(P值-adj = 9.99E-84)(图8(f));ANGPT2在肿瘤样本或相邻组织样本的免疫细胞中并未高度表达(图8(g));MS4A4A在肿瘤样本的单核细胞中高度表达(P值-adj = 1.02E-14)。在巨噬细胞中,MS4A4A在相邻组织样本中的表达比肿瘤样本更高(P值 = 0.007)(图8(h))。FOS在各种细胞亚群中高度表达。FOS在相邻组织样本的巨噬细胞(P值-adj = 3.98E-23)和B细胞(P值-adj = 2.56E-162)中的表达比肿瘤样本更高(图8(i))。此外,可以看到肿瘤组织中中性粒细胞、DC细胞、单核细胞、巨噬细胞和T细胞的比例上调,而B细胞和NK细胞的比例下降(图8(j))。图8(k)显示了免疫细胞亚群的标记基因。
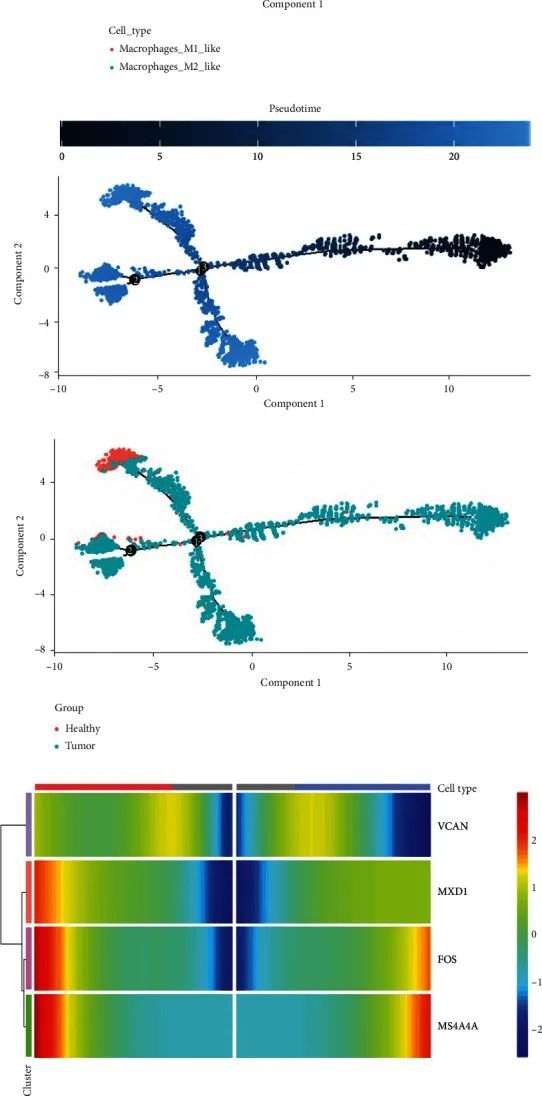
此外,作者分析了特定炎症细胞的亚群,如巨噬细胞、单核细胞和树突状细胞,以确定中心基因的功能。
基于标记基因,可以将巨噬细胞鉴定为巨噬细胞_M1_like(CD14、CCL3和CD86)和巨噬细胞_M2_like(CD163、FCGR3A和C1QC)(图9(a)和9(b))。在肿瘤组织中,巨噬细胞_M1_like的表达高于巨噬细胞_M2_like。在相邻组织中,巨噬细胞_M1_like的表达与巨噬细胞_M2_like几乎相同(图9(c))。通过Monocle2伪时间轨迹分析,作者展示了食管癌中巨噬细胞分化的不同阶段(图9(d))。每个亚群在巨噬细胞分化过程中的表现如图9(e)所示,伪时间分化如图9(f)所示,健康组织细胞主要分布在6 th 和7 th 阶段,可以看出在肿瘤组织中,健康组织巨噬细胞中的巨噬细胞_M2_like大规模分化为巨噬细胞_M1_like细胞(图9(g))。在肿瘤组织细胞中,作者分析了巨噬细胞分化不同阶段的中心基因的表达。FOS和MS4A4A的表达水平在巨噬细胞分化过程中发生了显著变化。FOS和MS4A4A的表达在巨噬细胞分化过程中逐渐增加(图9(h)和8(i))。作者进一步分析了FOS对巨噬细胞的调控功能。根据FOS基因的表达情况,将巨噬细胞分为阳性组(FOS + 巨噬细胞)和阴性组(FOS − 巨噬细胞)。作者分析了FOS + 巨噬细胞和FOS − 巨噬细胞之间的基因表达差异(图9(j))。与FOS − 巨噬细胞相比,FOS + 巨噬细胞高表达FOS、JUN、JUNB、FOSB、KLF6等基因。作者进一步分析了FOS + 巨噬细胞上调基因的GO功能富集。上调基因主要集中在对脂多糖的应答、正调控细胞因子产生和对细菌源分子的应答途径(图9(k))。因此,FOS的高表达与巨噬细胞产生的细胞因子增加和炎症反应有关,这也可能更类似于M2巨噬细胞的功能。FOS + 巨噬细胞更有可能促进炎症和肿瘤生长。
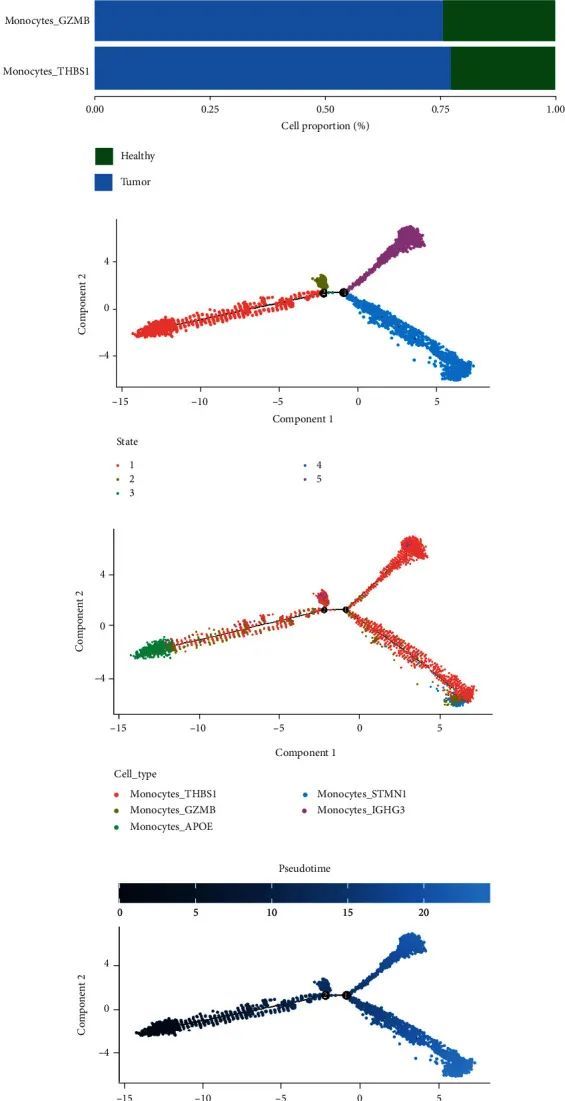
作者提取了单核细胞亚群,并进一步将其鉴定为单核细胞_THBS1(S100A8,THBS1)、单核细胞GZMB(S100A8GZMB)、单细胞APOE(S100A8,APOE)、单细胞核STMN1(S100A8.STMN1)和单核细胞IGHG3(S100A8/IGHG3)(图10(a)和10(b))。从细胞比例可以看出,Monocytes_IGHG3仅存在于癌症组织中,Monoctes_APOE也丰富于肿瘤组织中,而Monocytes_STMN1更多地分布于健康组织中(图10(c))。Monocle2的伪时间轨迹分析显示,单核细胞有5个分化阶段(图10(d)),每个亚群在单核细胞分化过程中的表现如图10(e)所示。根据伪时间进行微分的结果如图10(f)所示。在单核细胞分化过程中,作者关注的基因的表达变化如图10(g)和10(h)所示。随着细胞分化的进行,MS4A4A基因的表达逐渐增加
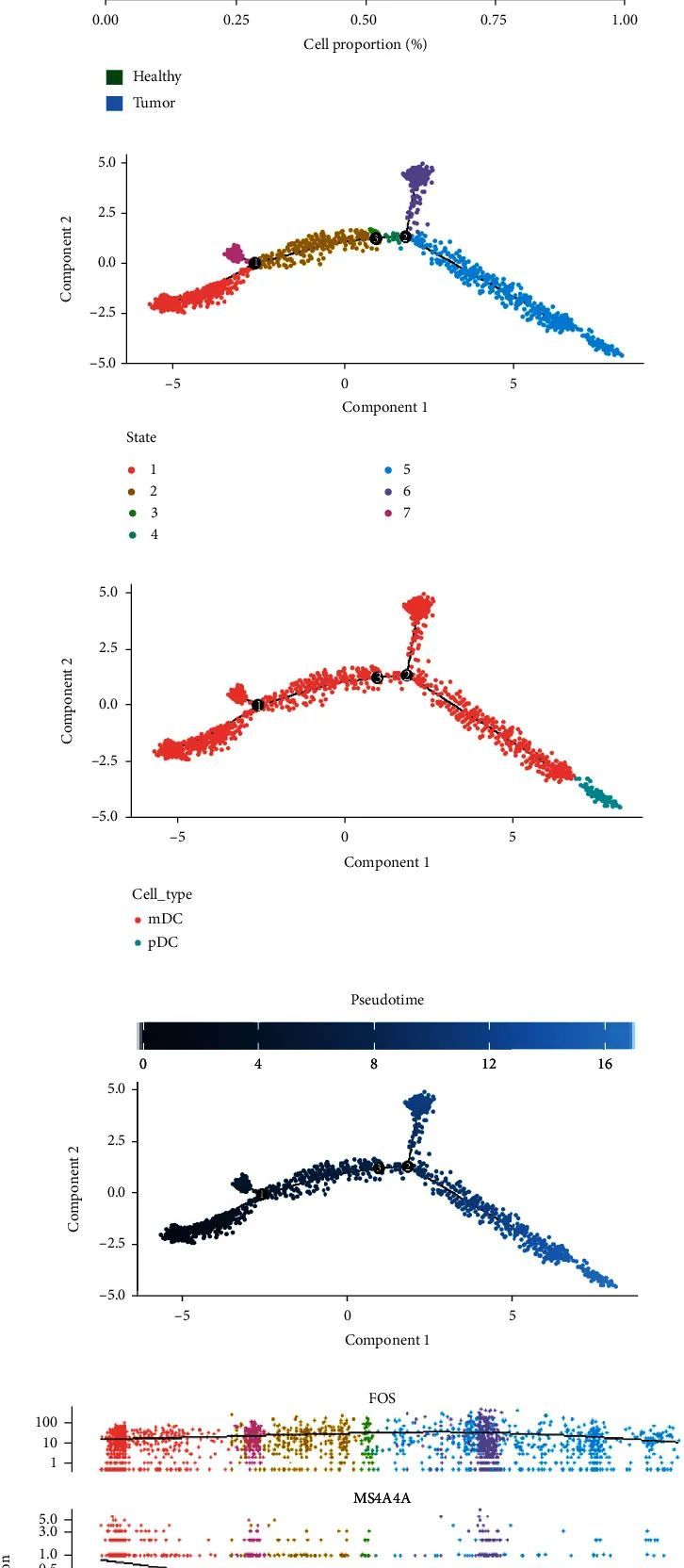
关于DC,作者提取了DC细胞亚群,并根据标记基因进一步鉴定了DC细胞子集为mDC(LYZ)和pDC(LILRA4)(图11(a)和11(b))。从细胞比例可以看出,mDC和pDC在肿瘤组织中的分布更多,这表明树突状细胞在肿瘤免疫中更活跃(图11(c))。Monocle2假时间轨迹分析显示,DC细胞分化有7个分化阶段(图11(d))。mDC和pDC在分化过程中的表现如图11(e)所示,基于假时间的分化如图11的(f)所示。随着细胞分化,作者关注的mDC到pDC细胞中基因的表达变化如图11(g)和111(h)。MS4A4A基因表达在分化的第二阶段随着分化的进行而迅速下降。
总结
总之,作者使用包括WGCNA和单细胞分析在内的综合生物信息学分析来发现食管癌症的预后生物标志物。在食管癌症中共鉴定出1651个DEG,包括1174个上调基因和477个下调基因。在WGCNA中,鉴定出182个基因。在总共182个中枢基因中,包括ANGPT2、VCAN、MS4A4A和FOS在内的四个中枢基因对食管癌症具有显著的预后价值。