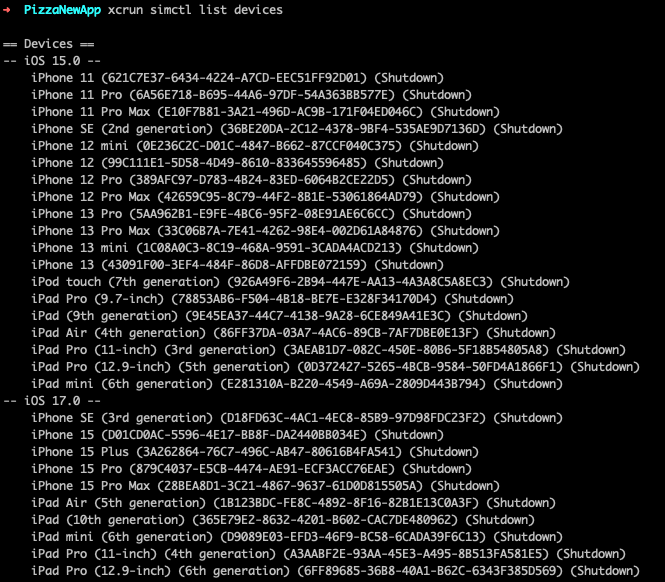
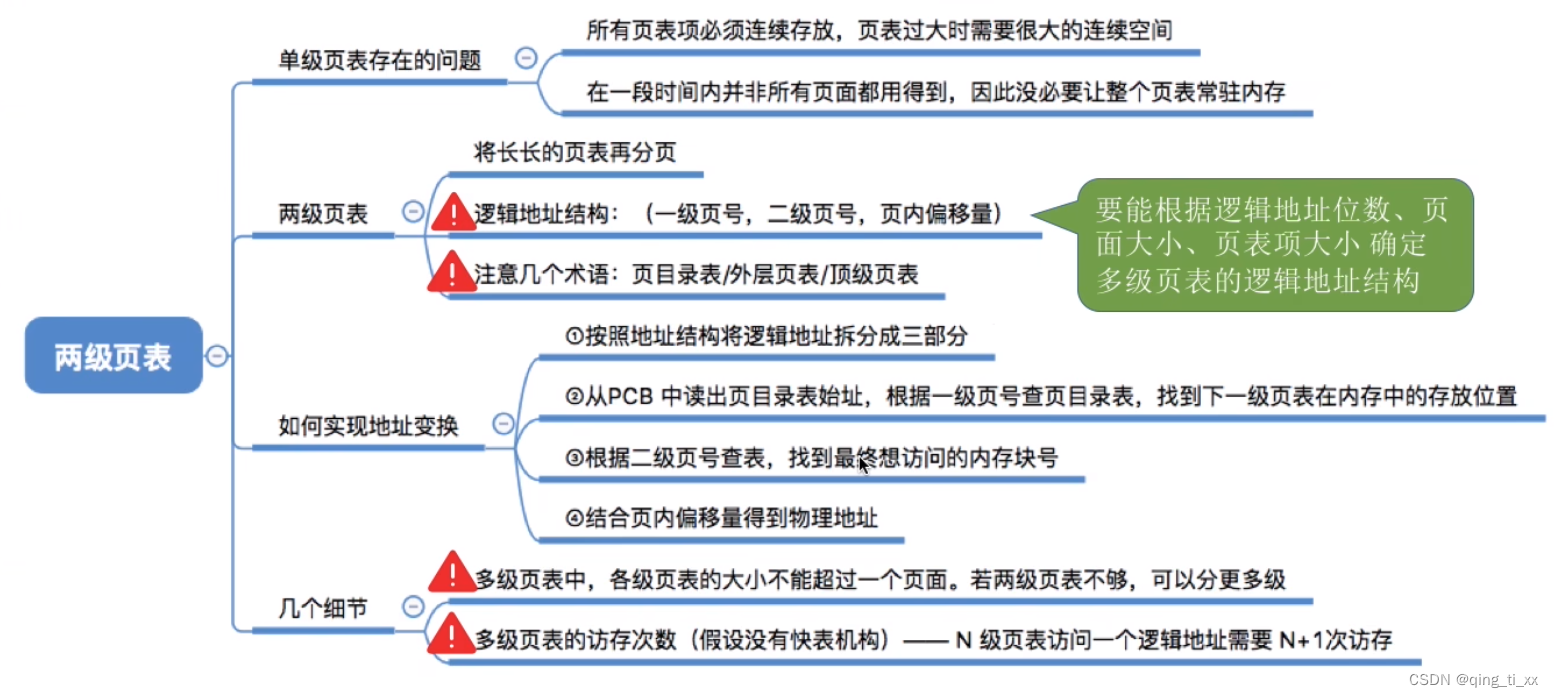
今天给同学们分享一篇肿瘤NAM+分型+单细胞的生信文章“Comprehensive analysis of nicotinamide metabolism-related signature for predicting prognosis and immunotherapy response in breast cancer”,这篇文章于2023年3月8日发表在Front Immunol期刊上,影响因子为8.786。

乳腺癌症是女性中最常见的恶性肿瘤。烟酰胺(NAM)代谢调节多发性肿瘤的发展。在此,作者试图开发NAM代谢相关信号(NMRS),以预测BC患者的生存率、肿瘤微环境(TME)和治疗效果。
1. NMRGs 的基因组和转录组景观
基于两个NAM代谢相关基因集,作者鉴定了42个NMRG。在遗传变异分析中,944个样本中有105个(11.12%)显示突变,其中错义突变最常见(图1A)。前三名突变NMRG是AOX1,PARP14和PARP9。此外,作者分析了NMRG中CNV的频率,并观察到拷贝数的扩增和丢失都很频繁(图1B)。差异分析结果表明,与TCGA数据库中相邻的正常样本相比,有13个上调基因和21个下调基因(P < 0.05)(图1C)。
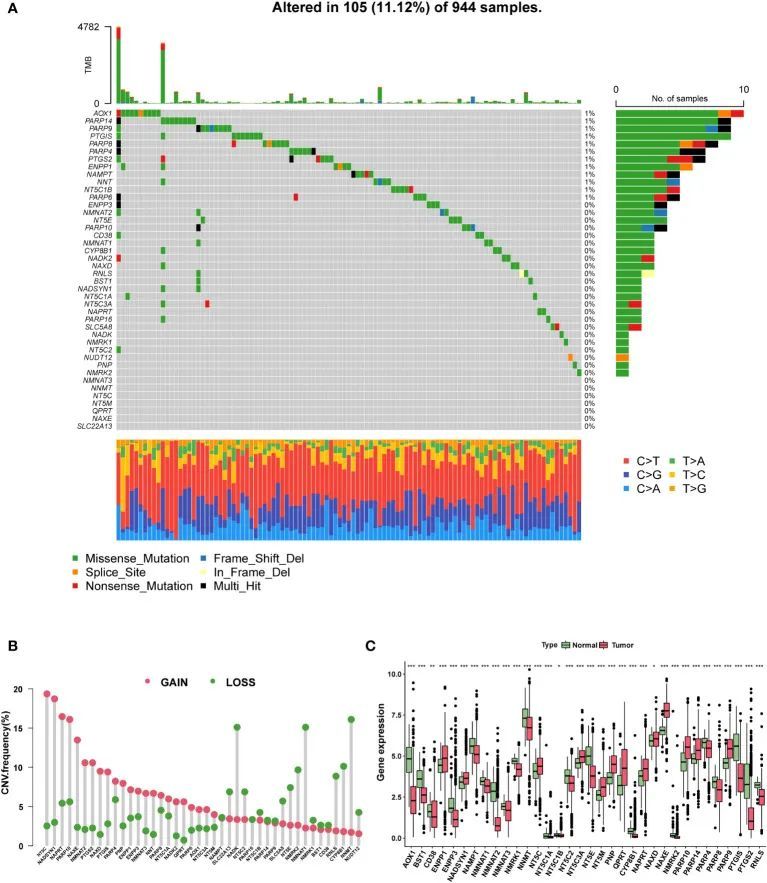
图1 NMRGs的基因组和转录组景观
2. 基于NMRGs的共识聚类分析
基于NMRGs的表达水平进行一致聚类以鉴定NAM代谢相关聚类。根据累积分布函数,k=3表现出优异的聚类弹性,具有相对较强的聚类内相关性和较低的聚类间相关性(图2A–C)。因此,患者被分为三个集群:168名患者被分在集群a中,575名患者在集群B中,275名患者在聚类C中。作者观察到集群C中的患者总体生存期延长(图2D,P=0.021)。考虑到不同集群之间转录组水平和生存结果的显著差异,作者推测了DEG的存在。根据筛选标准,作者收集了1322个DEG,然后对这些DEG进行了功能富集分析。GO分析富集了三类DEG:生物过程(BP)、细胞成分(CC)和分子功能(MFs)。BPs主要富集于阿米巴型细胞迁移、细胞基质粘附和血管生成的调节。CC主要富集于细胞-基质连接、局灶性粘连和细胞-细胞连接。此外,显著富集的MFs是细胞外基质结构成分、整合素结合和生长因子结合(图2E)。KEGG富集分析的结果显示,DEG主要富集于局灶粘附、MAPK信号通路和肌动蛋白细胞骨架的调节(图2F)。这些发现表明DEG参与信号通路调节和肿瘤生长。
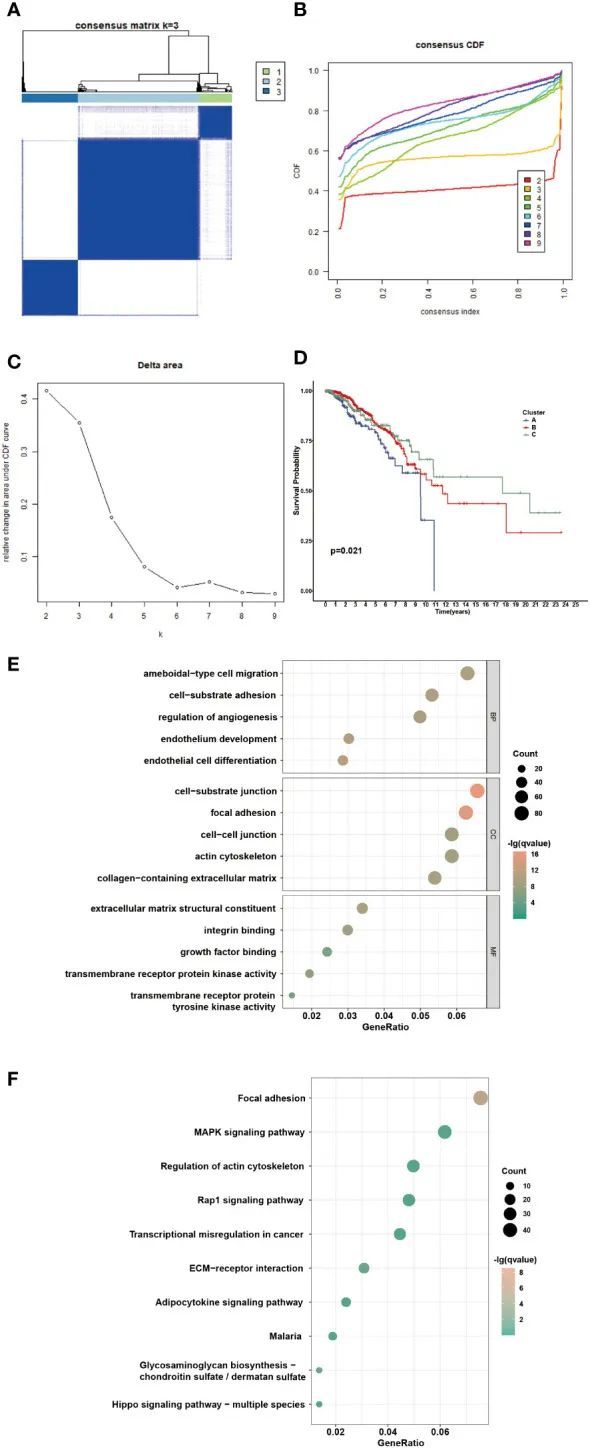
图2 鉴定BC患者中潜在的NAM代谢相关集群
3. NAM代谢相关预后特征的开发和验证
通过单变量 Cox 分析,作者确定了与 BC 患者生存显着相关的基因。Lasso 回归表明,当 λ = -3.5 时,交叉验证效果最佳,相关基因被纳入多变量 Cox 分析(图 3A、B)。最后,创建了一个 NAM 代谢相关的 6个基因特征来预测预后。TCGA-BRCA 队列中的患者确定了他们的个人风险评分,并根据中值将他们分配到不同的风险组。生存曲线显示,与高危组患者相比,低危组的 OS 较好(图 3C,P < 0.001)。两个风险组的风险评分、临床结局和模型基因表达模式的分布如图3D所示。在TCGA队列中,3年、5年和10年预测生存率的AUC值分别为0.723、0.726和0.770,证明了特征的稳健预后能力(图3E)。与一些现有的BC生物标志物相比,作者的基因标记具有更好的预测性能,具有更高的AUC和c指数值(图3F-I)。使用来自ICGC数据库的BC队列,作者进行了外部验证,以进一步确认NMRS的预测能力。根据风险评分计算公式,ICGC队列中的98例患者根据中位值分为高(n = 49)和低风险(n = 49)组。KM生存曲线显示,高危组生存率明显低于低危组(图3J,P=0.031)。此外,外部测试队列中 5 年OS的 AUC 值为 0.762(图3K)。
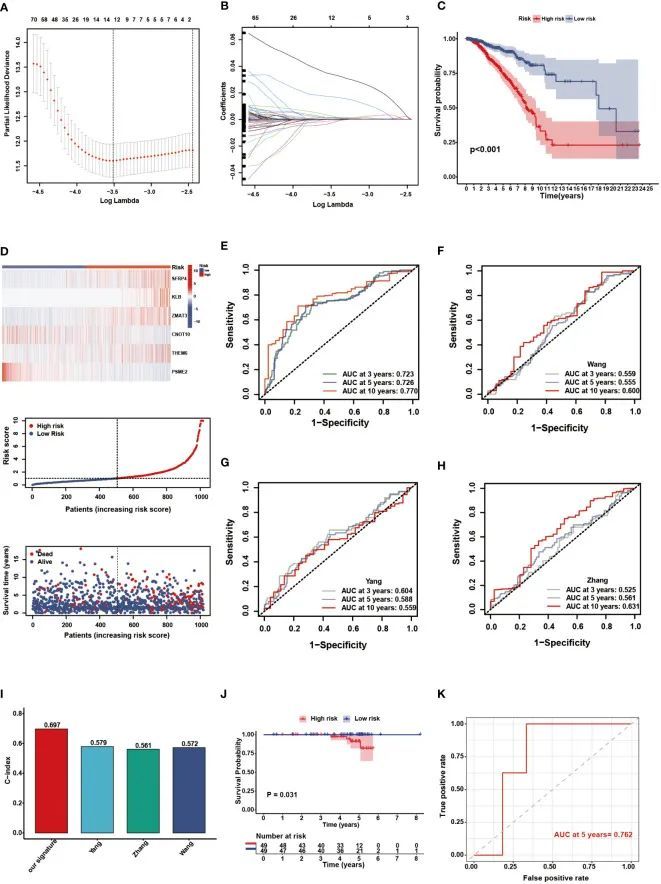
图3 NMRS的构建和验证
4. 基于NAM代谢的列线图的分层分析和建立
为了进一步验证特征在具有不同临床特征的亚组中的预后价值,作者进行了分层分析。根据年龄、病理分期、TNM分期以及ER、PR和HER-2状态,将患者分为不同的亚组并进行生存分析。图4A-H显示了每个亚组中不同风险组的分布特征。结果表明,与整个队列的观察结果一致,除M1阶段外,低风险组在所有亚组中都有更好的临床结果(图5A-P)。此外,对重要的临床病理指标和基因特征进行了单变量和多变量Cox分析。在单变量回归分析中,作者观察到年龄、分期是独立的预测因素。在使用多变量回归分析调整潜在偏倚后,发现年龄、分期和风险评分是独立的预测因素(图6B)。基于独立的预后因素,开发了一个综合列线图,对BC患者的3年、5年和10年OS概率进行定量预测(图6C)。3年、5年和10年时的AUC值分别为0.806、0.766和0.723,表明列线图可以提供准确的预测(图6D)。校准曲线显示了预测OS和实际OS之间的高度一致性(图6E)。使用DCA曲线检查列线图的临床适用性。与仅具有临床特征的模型相比,作者发现这种综合列线图可以产生更多的净效益,这可能有助于更好的临床管理(图6F)。
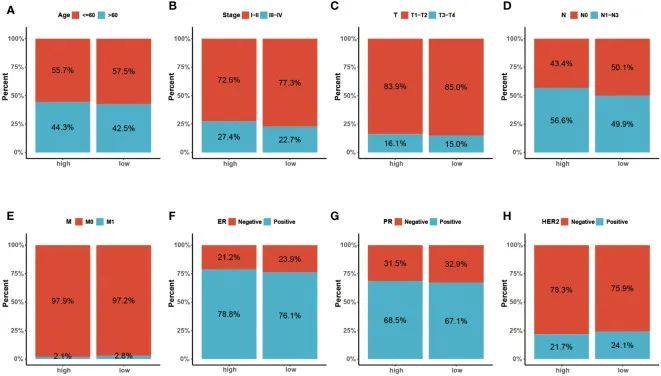
图4 不同临床病理因素在两个危险人群中的分布特征
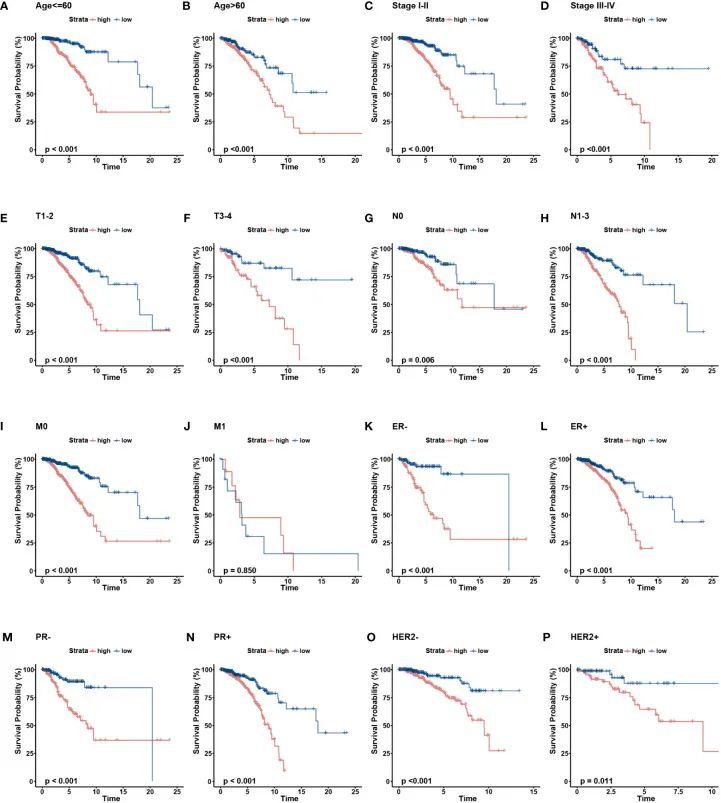
图5 两个危险组的OS-KM曲线按临床病理因素分层
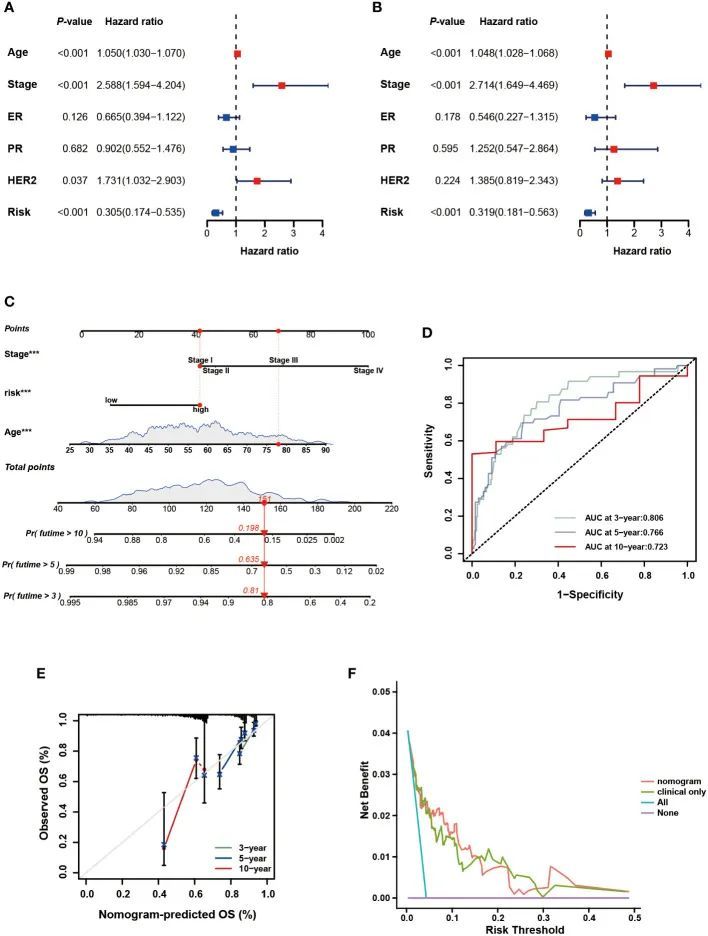
图6 列线图的开发和评估
5. 免疫景观的识别
进行DEG的GSEA以确定两个风险组的生物过程。值得注意的是,低风险组主要富集免疫相关过程,例如抗原加工和呈递,趋化因子信号通路和自然杀伤细胞介导的细胞毒性,而高风险组富集在癌症相关过程中,例如局灶粘附和ECM受体相互作用(图6A,B)。然后,采用ESTIMATE和CIBERSORT算法探索肿瘤微环境。ESTIMATE分析显示,低风险组的基质评分、估计评分较低,免疫评分较高(P < 0.05)(图6C)。根据CIBERSORT的结果,低风险组CD8 T细胞,活化记忆CD4 T细胞,滤泡辅助性T细胞,调节性T细胞,M0巨噬细胞,M1巨噬细胞,活化肥大细胞和嗜酸性粒细胞的比例显着较高(P < 0.05)(图7D)。在热图中展示了ssGSEA结果,以可视化28个免疫细胞亚群的相对丰度。作者发现,具有抗肿瘤作用的免疫浸润细胞亚群主要富集在低风险组,如活化的树突状细胞和活化的CD4/CD8 T细胞,而具有促肿瘤作用的免疫力细胞亚群则主要富集在高危组,如髓源性抑制细胞(MDSC)和未成熟的树状细胞。此外,9个频繁检查点基因,包括众所周知的BTLA、CTLA-4和PDCD1,在低风险组中显著升高(P<0.05)(图7E)。此外,在低风险组中,在癌症免疫周期的承诺步骤和免疫相关阳性信号中观察到更高的分数(P < 0.05)(图7F,G)。肿瘤细胞通过增强TMB来逃避免疫监视,而TMB则相反地作为免疫反应的预测因子。因此,作者进一步可视化了不同风险组中的突变景观,并探索了风险评分与TMB之间的相关性。图7H中,作者展示了风险组中突变频率最高的前20个基因,其中PIK3CA和TP53已被证明具有重要意义。456个样本中有391个(85.75%)在高风险组中有突变,而在低风险组中,445个样本中有388个(87.19%)有突变。此外,在低风险组中观察到的TMB明显高于高风险组(图7J)。这些发现表明,两个风险组之间的免疫景观差异很大。
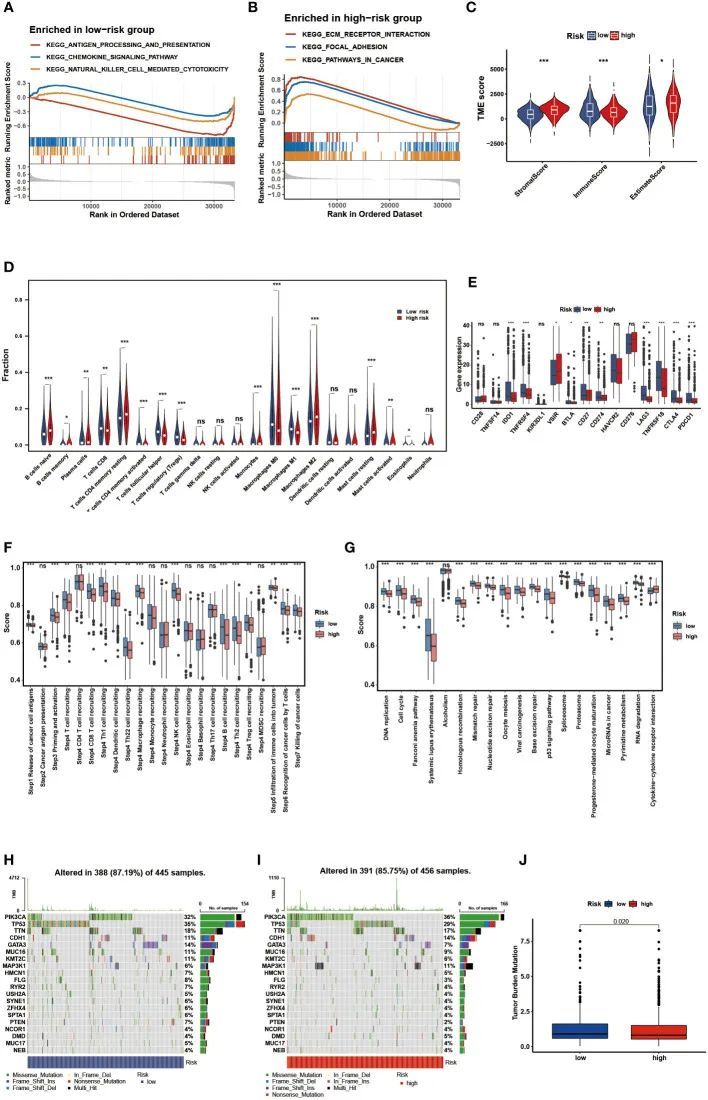
图7 识别两个风险组之间的免疫景观
6. 免疫治疗效果的预测
使用IPS、Submap算法和外部免疫疗法队列评估两个风险组的免疫疗法反应。在低风险组中,IPS显示出检查点抑制剂治疗的显著治疗益处(图8A)。Submap的结果显示了BC患者对抗CTLA4和抗PD-1免疫疗法的治疗反应(图8B)。如P值(P=0.007)和校正P值(P<0.001)所示,低风险人群对抗PD-1免疫疗法产生反应的概率更高。此外,在iMvigor210队列中,作者观察到低风险人群的客观反应率(CR/PR)和生存概率高于高风险人群(图9C、D)。外部队列的结果验证了NMRS可以识别免疫疗法敏感的个体。
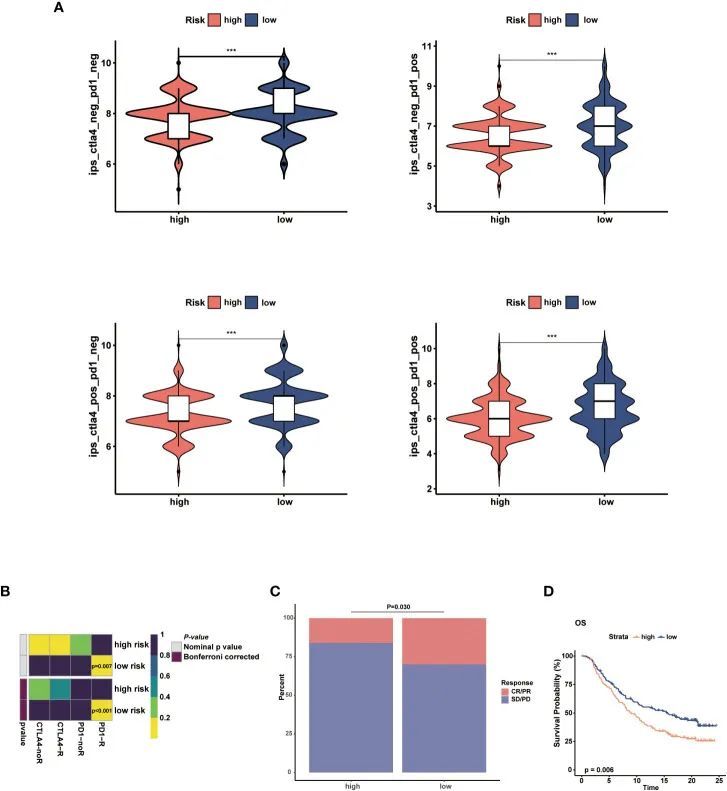
图8 预测两个风险组的免疫治疗反应
7. 药物敏感性比较
为了进一步研究NMRS在精确BC治疗中的临床效用,作者评估了常用化疗药物在不同风险组中的治疗效果。根据研究结果,低风险个体对替唑胺,西利帕尼,多柔比星,吉非替尼,他莫昔芬,5-氟罗嘧啶和吉西他滨的反应更好,而对索拉非尼,舒尼替尼和拉帕替尼的敏感性较低(图10A-J,P < 0.05)。
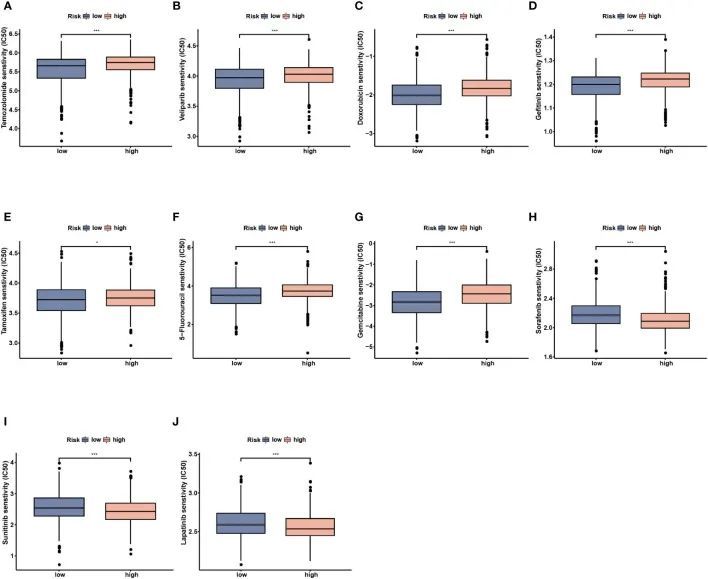
图9 低危人群与高危人群药物敏感性分析
8. 使用 scRNA-seq 分析验证基因特征
作者分析了一个 scRNA-seq 队列,以查看基因特征是否可用于区分不同的细胞亚型。使用 tSNE 分析,确定了十四个集群(图 10A)。根据细胞亚型注释的结果,这些集群可分为九种不同的细胞亚型,包括上皮细胞、胚胎干细胞、单核细胞、T细胞、成纤维细胞、组织干细胞、平滑肌细胞、软骨细胞和内皮细胞(图10B)。每个亚型中基因特征的表达水平显示在气泡图中,可以区分细胞亚型(图10C)。KLB、ZMAT3、CNOT10 和 PSME2 在大多数细胞亚型中高表达,而其他模型基因具有相对特定的表达模式。SFRP4 和 THEM6 分别在成纤维细胞和上皮细胞中高表达。这些发现证明了该基因特征对于细胞亚型区分的稳定性。
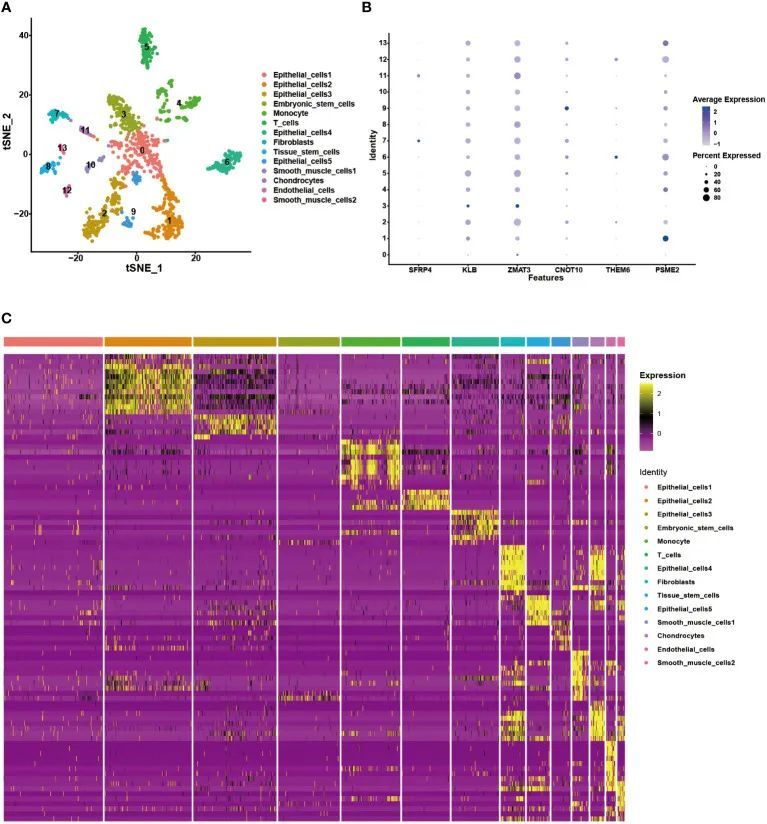
图10 scRNA-seq数据中基因特征的验证
总结
总之,作者使用生物信息学分析确定了一种新的NAM代谢相关信号,用于BC的预后预测。此外,该基因标记在预测免疫微环境和免疫治疗反应方面具有很好的潜力,这可能有助于临床管理。
![2023年中国现制咖啡市场发展概述分析:交易笔数和客单价将持续上升[图]](https://img-blog.csdnimg.cn/img_convert/b7ba53958e8fc0108a441cf732b891fb.png)




![红队专题-从零开始VC++C/S远程控制软件RAT-MFC-[4]客户端与服务端连接](https://img-blog.csdnimg.cn/fa6ebbe3fa104b0880c3065e3d1fa6a0.png)