最近的报告发现,异常的miRNA和mRNA表达以及免疫微环境的失调经常导致肝细胞癌(HCC)的进展。特别是,与免疫相关的竞争性内源性RNA(ceRNA)机制在HCC的进展中起着关键作用。然而,其潜在机制尚不清楚。
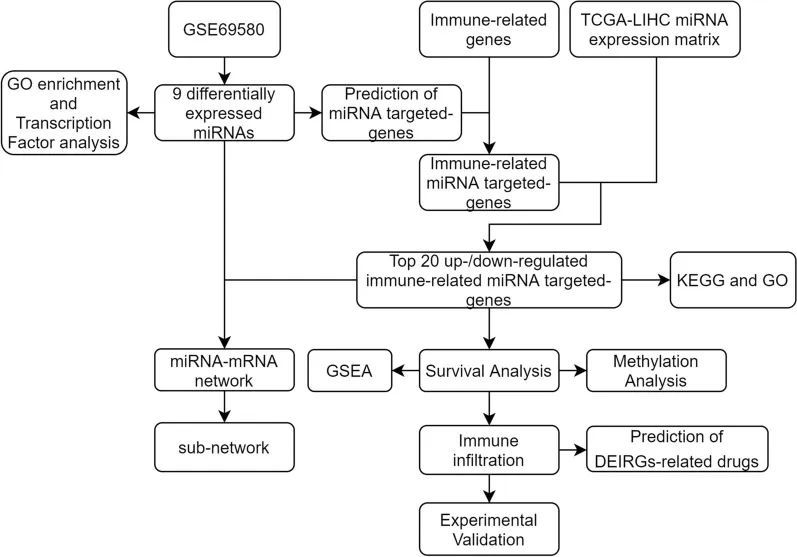
图1 整个研究的流程图
1. 肝癌中不同表达的miRNA的鉴定
miRNA微阵列数据(GSE69580)包含了五个肝细胞癌肿瘤和五个正常组织,在数据分析之前首先进行了分位数归一化处理。筛选标准如先前所述(|log2FC| > 0.5,调整后的p值 < 0.05)。作者鉴定出了七个上调和两个下调的miRNA。作者绘制了火山图和热图,展示了九种miRNA在肿瘤和正常组织之间的差异表达情况(图2A、B)。然后,作者将这九种miRNA导入FunRich(3.1.3)软件进行miRNA GO富集分析。GO生物过程术语(BP)显示大多数miRNA参与核碱基、核苷、核苷酸和核酸代谢的调节(19.7%,p < 0.001)(图2C)。关于GO细胞组分术语,大多数miRNA可能定位于细胞核(48.2%,p < 0.001)和细胞质(45%,P < 0.001)(图2D)。GO分子功能术语显示大多数miRNA与转录因子活性(8%,p < 0.001)、蛋白质丝氨酸/苏氨酸激酶(2.9%,P = 0.001)、转录调节因子活性(6.4%,P = 0.007)、泛素特异性蛋白酶活性(3.3%,P = 0.01)和鸟苷酸交换因子(1.3%,P = 0.014)相关(图2E)。对于转录因子分析,作者发现大多数miRNA与转录因子(TFs)相关。作者选择了与miRNA密切相关的前10个转录因子。如图2所示,TFs SP1、EGR1、POU2F1、SP4、MEF2A、FOXA1、SOX1、FOXO1、NKX6-1和HOXD8与差异表达的miRNAs相关联。
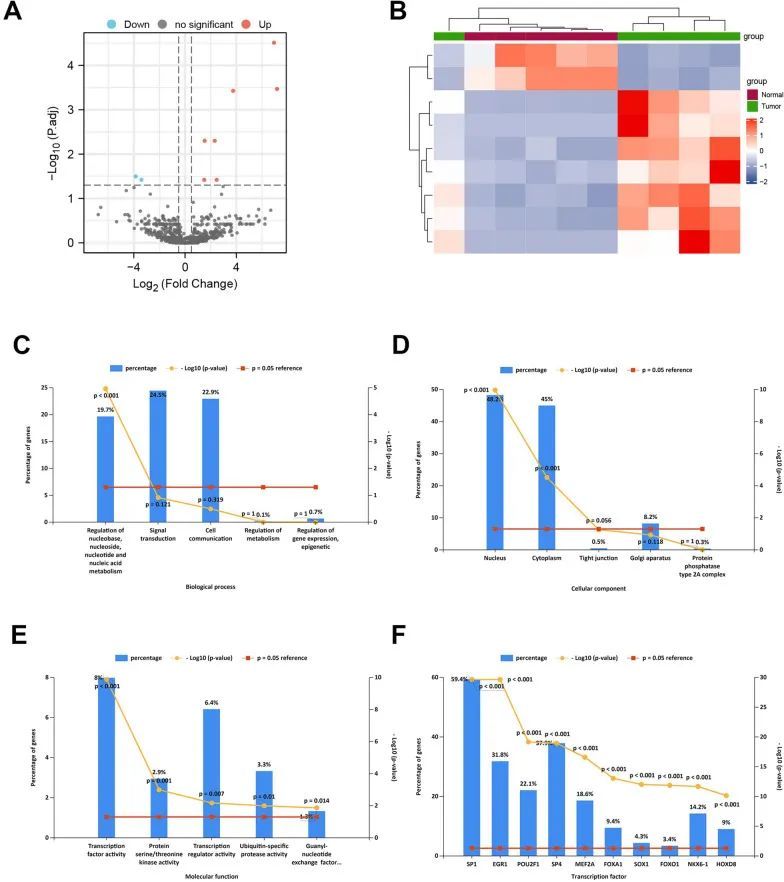
图2 HCC中差异表达miRNA的鉴定
2. 鉴定差异表达的免疫相关miRNA靶基因
作者首先将九个miRNA上传到三个数据库(miRecords、miRTarbase和Tarbase),然后汇总这三个数据库中所有经过验证的相互作用靶基因。之后,通过筛选miRNA靶向基因和从ImmPort Portal数据库下载的基因列表之间的重叠基因,得到最终的393个与免疫相关的靶mRNA基因(附加文件1:图S2)。然后,作者从TCGA数据库中提取了这393个基因的表达矩阵,并在差异基因分析之前进行了归一化处理。筛选标准为|log2FC| > 1和调整后的p值 < 0.05。作者确认在HCC肿瘤组织中有97个基因上调和37个基因下调。作者绘制了火山图和热图来展示这些基因的差异表达(图3A、B)。最终,作者通过筛选HCC肿瘤组织中上调/下调的mRNA和下调/上调的miRNA的靶基因之间的重叠基因,得到了最终的基因(图3C)。
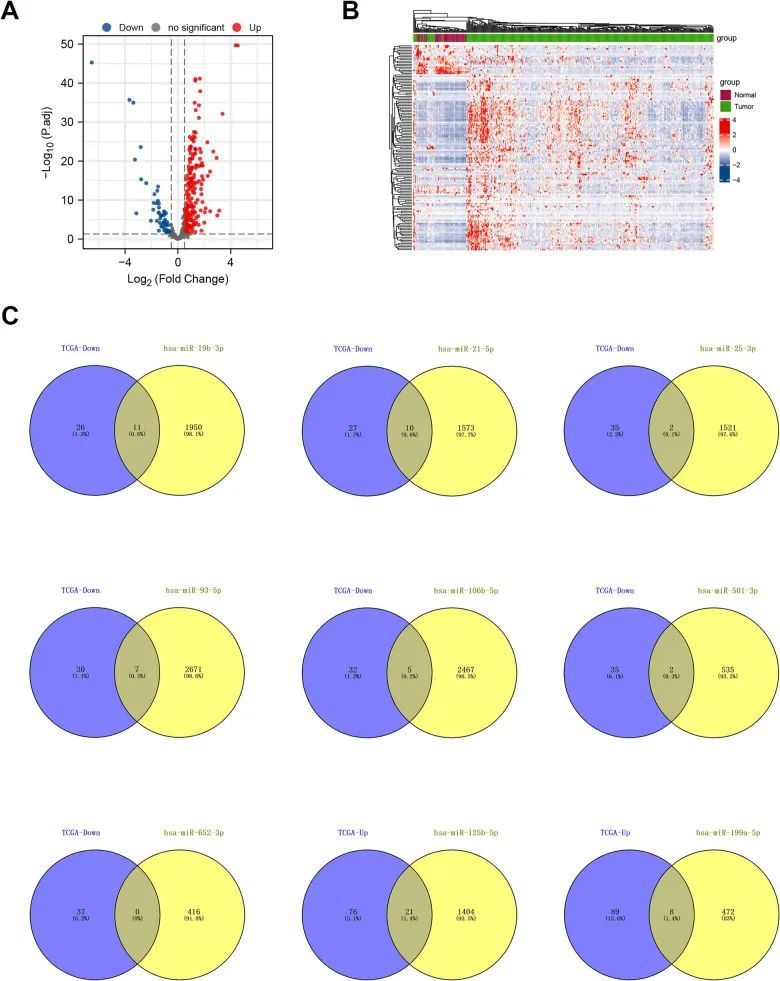
图3 鉴定差异表达的免疫相关miRNA靶基因
3. miRNA-mRNA相互作用网络的建立
从重叠基因列表中选择了前20个上调和下调的mRNA进行进一步分析,如图4A、B所示,作者构建了miRNA-mRNA网络,并利用Cytoscape软件的MCODE插件从整个网络中获取了亚网络。接下来,作者使用“ClusterProfiler” R包进行了KEGG和GO分析。结果显示,大多数基因富集在MAPK信号通路、细胞因子-细胞因子受体相互作用和PI3K-Akt信号通路等方面(图4C)。此外,大多数基因与GO:0050673(上皮细胞增殖)、GO:0031649(热产生)和GO:0043434(对肽激素的反应)等方面有关(图4D)。随后,对40个基因进行了生存分析。具有p值<0.05的基因被纳入进一步的分析。因此,确定了15个miRNA靶点。然后,作者在PubMed上检索了关于这15个miRNA靶点的研究和论文,最终获得了四个靶点(NTF3、PSMD14、SORT1和CD320),这些靶点在HCC中尚未进行深入研究,特别是免疫浸润与HCC进展之间的关系(图4E)。最后,作者建立了hsa-miR-125b-5p-PSMD14/CD320/SORT1和hsa-miR-21-5p-NTF3的ceRNA网络。

图4 miRNA-mRNA相互作用网络的建立
4. miRNA靶向基因表达与免疫浸润之间的相关性
作者进一步调查了基因和免疫细胞之间是否存在某些联系。这些相关性是从肿瘤免疫估计资源(TIMER)数据库中探索出来的,显示CD320与B细胞、CD4+ T细胞、巨噬细胞和树突状细胞的免疫浸润水平呈正相关(图5A);PSMD14与B细胞、CD8+ T细胞、CD4+ T细胞、巨噬细胞、中性粒细胞和树突状细胞浸润呈正相关(图5B);NTF3与肿瘤纯度呈负相关,并与CD4+ T细胞、巨噬细胞和中性粒细胞浸润有关(图5C);SORT1与B细胞、CD4+ T细胞、巨噬细胞、中性粒细胞和树突状细胞的免疫浸润水平呈正相关(图5D)。同时,使用TISCH数据库显示了CD320、SORT1、NTF3和PSMD14在各种免疫细胞中的平均表达热图。
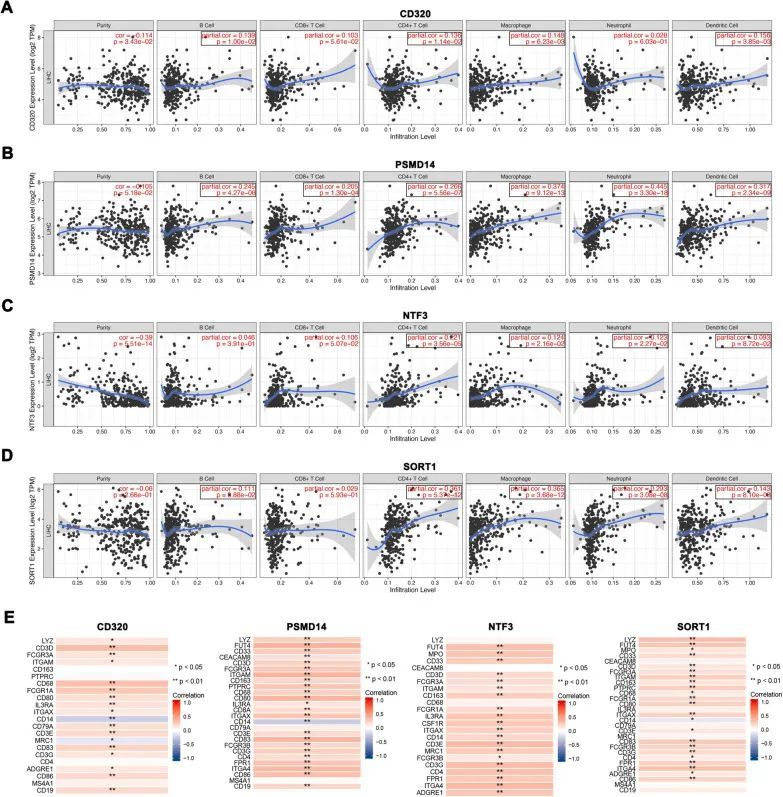
图5 miRNA靶向基因表达与免疫浸润之间的相关性
根据上述结果,作者进一步研究了这四个中心基因与相应免疫细胞的细胞标记物之间的相关性。免疫标记物数据来自细胞标记物数据库(http://bio-bigdata.hrbmu.edu.cn/CellMarker/)。相关性热图如图4E所示。
5. miRNA靶向基因表达与甲基化之间的关系
先前的研究报告指出,肿瘤纯度作为一个混杂因素会影响基因表达和DNA甲基化水平,而拷贝数则会影响基因表达水平,进而与肿瘤纯度和免疫细胞浸润水平相关。因此,作者从UALCAN数据库获取了四个基因的甲基化表达水平。作者还使用MEXPRESS数据库深入研究了HCC中基因表达和甲基化水平之间的关系。作者发现,在HCC组织中,CD320的启动子甲基化水平显著低于正常组织,而CD320的表达与其启动子甲基化水平呈负相关(图6A,E)。此外,与CD320类似,SORT1和PSMD14的启动子甲基化水平在肿瘤组织中明显低于正常组织,并且基因表达与启动子甲基化水平之间也存在负相关(图6B,C,E)。然而,NTF3的分析结果与CD320、SORT1和PSMD14的结果不同。NTF3的表达与启动子甲基化水平呈正相关(图6D,E)。这部分表明NTF3作为一个肿瘤抑制基因,而SORT1、CD320和PSMD14作为致癌基因调控HCC的进展。接下来,作者对这四个基因和相关的甲基转移酶基因(DNMT1、DNMT3A和DNMT3B)进行了相关性分析。结果显示,CD320、SORT1和PSMD14水平高的HCC肿瘤具有高水平的甲基转移酶基因(DNMT1、DNMT3A和DNMT3B),而NTF3与甲基转移酶基因之间没有显著相关性(图6F)。此外,作者分析了HCC中miRNA(hsa-miR-21-5p和hsa-miR125b-5p)与甲基转移酶基因(DNMT1、DNMT3A和DNMT3B)之间的关系。此外,hsa-miR125b-5p与DNMT1(R = -0.270,p < 0.001)、DNMT3A(R = -0.400,p < 0.001)和DNMT3B(R = -0.190,p < 0.001)之间存在显著负相关关系。这些结果共同提供了重要的见解,表明改变甲基化水平可能对这些中心基因的功能起到贡献作用。
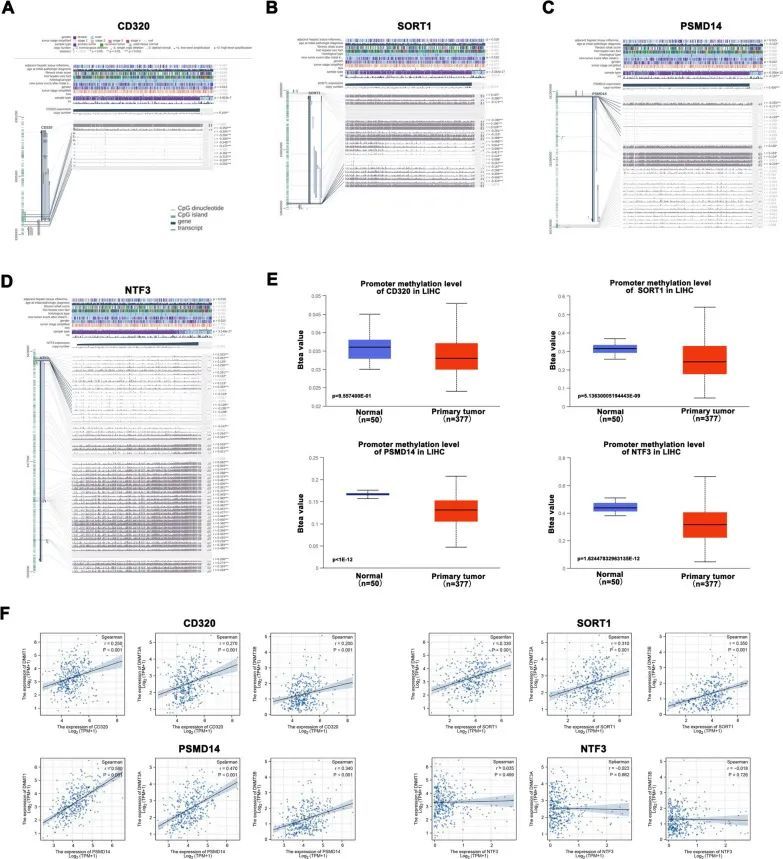
图6 miRNA靶向基因表达与甲基化之间的关系
6. 在肝细胞癌组织中,对miRNA靶基因进行基因集富集分析
为了研究这些miRNA靶向基因的下游通路,作者根据TCGA数据库中的基因表达水平将矩阵分组,进行GSEA分析。作者选择了五个具有统计学意义的分析结果。CD320与RNA聚合酶相关(NES = 1.9784905,NOM p < 0.001,FDR = 0.06683415),嘧啶代谢(NES = 1.9404032,NOM p < 0.001,FDR = 0.063131504),嘌呤代谢(NES = 1.8211129,NOM p < 0.001,FDR = 0.15423618),碱基切除修复(NES = 1.7193841,NOM p < 0.001,FDR = 0.13022694)和蛋白酶体(NES = 2.0096643,NOM p = 0.001953125,FDR = 0.10067051)相关(图7A)。PSMD14与卵母细胞减数分裂(NES = 1.9725554,NOM p < 0.001,FDR = 0.114430845),细胞周期(NES = 1.9679518,NOM p < 0.001,FDE = 0.057919133),加压素调节的水重吸收(NES = 1.9385664,NOM p < 0.001,FDR = 0.05596375),泛素介导的蛋白质降解(NES = 1.9356284,NOM p < 0.001,FDR = 0.04440799)和自噬调节(NES = 1.9276263,NOM p < 0.001,FDR = 0.045232568)相关(图7B)。NTF3与钙信号通路(NES = 2.3056374,NOM p < 0.001,FDR = 0.00468132),细胞因子-细胞因子受体相互作用(NES = 2.2316432,NOM p < 0.001,FDR = 0.003475299),趋化因子信号通路(NES = 2.116517,NOM p < 0.001,FDR = 0.003489959),TGF-β信号通路(NES = 2.1123161,NOM p < 0.001,FDR = 0.003384397)和MAPK信号通路(NES = 2.0579696,NOM p < 0.001,FDR = 0.004097538)(图7C)。SORT1与mTOR信号通路(NES = 1.9278517,NOM p < 0.001,FDR = 0.021522397),癌症通路(NES = 1.9270834,NOM p < 0.001,FDR = 0.018652743),VEGF信号通路(NES = 1.916239,NOM p < 0.001,FDR = 0.017952878),溶酶体(NES = 1.9507663,NOM p < 0.001,FDR = 0.026280008)和神经营养因子信号通路(NES = 1.9135792,NOM p < 0.001,FDR = 0.017722571)相关(图7D)。

图7 肝细胞癌组织中miRNA靶向基因的基因集富集分析
7. 生存分析和预后模型
为了研究四个关键基因对HCC预后的影响,作者通过单变量和多变量Cox比例风险回归分析建立了一个有效的模型来预测预后状态。ROC曲线下面积(AUC)显示CD320(AUC = 0.922460)、PSMD14(AUC = 0.937861)、SORT1(AUC = 0.871925)和NTF3(AUC = 0.966288)是显著的预测因子(图8A)。在单变量Cox比例风险回归分析中,四个基因和肿瘤分期被确定为预后生物标志物(图8B)。多变量Cox比例风险回归分析显示CD320(HR = 2.484,95% CI = 1.571–3.928,p < 0.001)、PSMD14(HR = 1.787,95% CI = 1.153–2.767,p = 0.009)和SORT1(HR = 1.743,95% CI = 1.121–2.710,p = 0.014)对预后有显著影响(图8C-a–c)。同时,NTF3(HR = 0.649,95% CI = 0.422–0.998,p = 0.049)在多变量Cox比例风险回归分析中也具有统计学意义(图8C-d)。作者使用了一个预后判断的图表。每个因素都有一个“分数”,而“总分”是总分数的刻度(图8D-a–d)。此外,校准分析的结果表明,四个预测模型与肝细胞癌患者的结果相吻合良好。
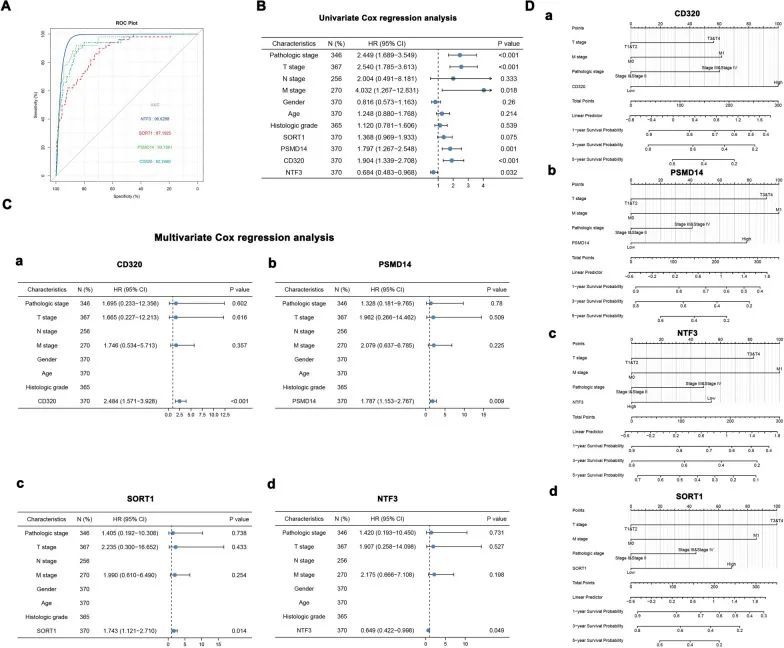
图8 生存分析和预后模型
8. miRNA及其靶向基因表达的验证
作者使用qRT-PCR验证了两种miRNA及其靶基因在HCC细胞系和HCC样本中的表达。与L02细胞相比,hsa-miR-21-5p在六种HCC细胞系(HCCLM3、MHCC97H、Hep3B、Huh7、PLC/PRF/5和HepG2)中的表达显著上调(图9A-a)。相反,hsa-miR-125b-5p在L02肝细胞中的表达显著上调,而在五种HCC细胞系中的表达显著下调(图9A-b)。与肝细胞L02相比,CD320和PSMD14的mRNA表达在六种HCC细胞系(HCCLM3、MHCC97H、Hep3B、Huh7、PLC/PRF/5和HepG2)中显著上调(图9B-a、b)。SORT1的mRNA水平在五种HCC细胞系中高于L02细胞(图9B-c)。相反,除了huh7细胞系外,五种HCC细胞系(HCCLM3、MHCC97H、Hep3B、PLC/PRF/5和HepG2)中的NTF3 mRNA水平明显低于L02细胞(图9B-d)。有趣的是,作者发现miRNA和mRNA的表达在Huh7细胞中没有显著变化。然后,作者选择了15对人肝癌和癌旁组织,进一步检测这四个关键基因的表达水平。结果显示,15个肝细胞癌组织中有9个下调了NTF3,11个上调了PSMD14,而9个上调了SORT1(图9C-a–c)。
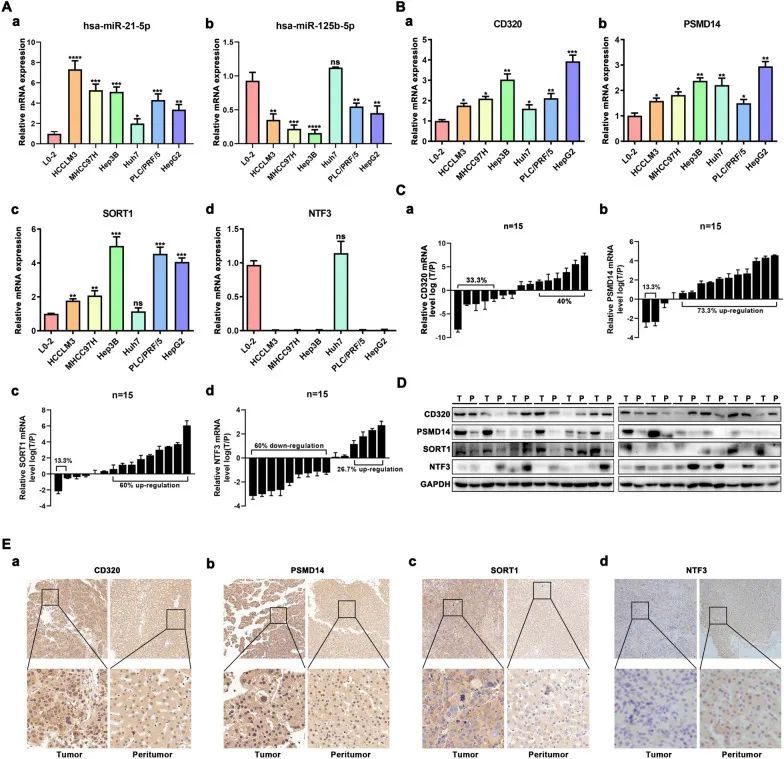
图9 验证miRNA及其靶基因的表达
CD320在HCC肿瘤组织和相配的邻近正常组织之间的表达差异不显著(图9C-d)。接下来,作者使用免疫印迹分析验证了12对HCC组织和正常肝组织中PSMD14、SORT1和NTF3蛋白水平(图9D)。此外,作者还进一步探索了来自Human Protein Atlas数据库的4个基因蛋白表达的变化。结果表明,CD320、PSMD14和SORT1蛋白水平在肿瘤组织中高于正常组织,而NTF3在正常组织中的水平高于肿瘤组织。类似地,免疫组化实验表明,在15例HCC患者中,CD320、PSMD14和SORT1的水平高于相配的邻近正常组织(图9E-a-c),而NTF3则呈相反的结果(图9E-d)。作者还利用GSE14520、GSE76427和TCGA表达矩阵研究了这四个关键基因的表达水平。
9. HCC潜在机制的验证
根据先前的PCR结果,选择了MHCC97H和HCCLM3细胞进行进一步的实验。使用qRT-PCR确认了转染siRNA的MHCC97H和HCCLM3细胞中PSMD14和SORT1的表达情况(图10A)。CCK-8和Transwell实验表明,PSMD14和SORT1的下调可以减缓MHCC97H和HCCLM3细胞的生长、迁移和侵袭(图10B-D)。此外,细胞功能实验的结果与最近的研究一致,表明PSMD14和SORT1在各种癌症中具有致癌作用。然而,它们在肝细胞癌中的潜在机制仍不清楚。上述GSEA结果显示,PSMD14与自噬过程有关,SORT1与mTOR信号通路相关。因此,作者通过进行免疫印迹实验检测了这些通路生物标志物的蛋白表达水平。作者发现,SORT1的干扰降低了p-mTOR(Ser2448)的表达,导致mTOR信号通路的失活(图10E)。随后,在PSMD14下调后,肝细胞癌细胞的自噬过程被抑制。当干扰PSMD14时,LC3B和ATG5的表达显著降低,p62蛋白明显增加(图10F)。与GSEA一致,SORT1可以激活mTOR通路,促进HCC的进展。同时,作者推测高水平的PSMD14可能通过刺激自噬来维持肿瘤细胞的生存,从而确保它们在特定情况下的能量代谢,并减少损伤。总之,这些结果揭示了SORT1和PSMD14在HCC细胞中的致癌作用。
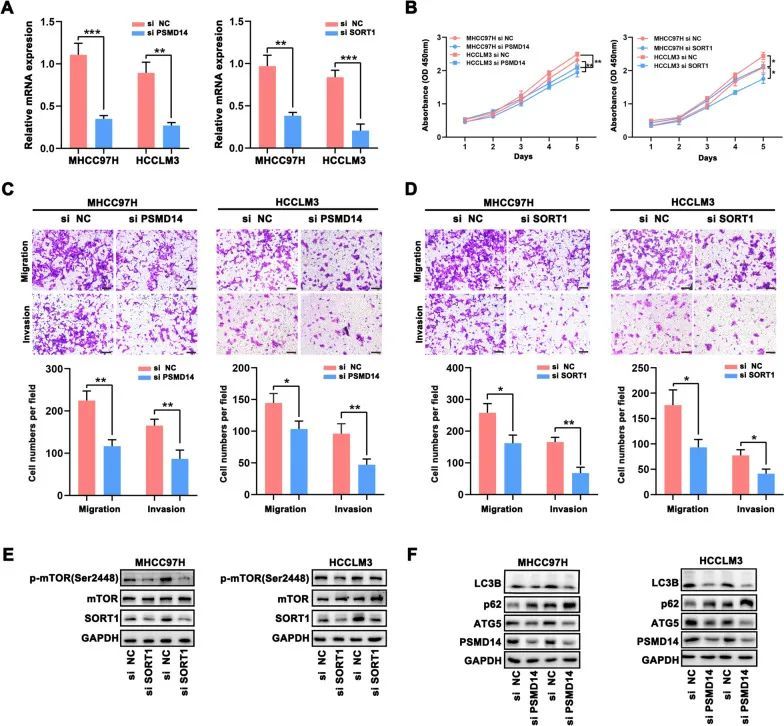
图10 在肝细胞癌中验证潜在机制
10. DEIRGs相关药物的预测
之前筛选出的miRNA靶基因已上传至DSigDB进行药物预测富集分析。作者选择了与miRNA靶基因相关的前10种药物。筛选标准调整为p值<0.05。作者发现pinaflavol TTD 00010236、harmaline CTD 00006074、GNF-Pf-3464 TTD 00008265、sulfuretin TTD 00011132、chloroxine TTD 00007143、Tyrphostin B48 CTD 00003485、chloroxine和Redoxal TTD 00010526可能与PSMD14相关;AlphaRedisol BOSS可能与CD320相关;selenium methyl cysteine CTD 00000103可能与SORT1相关。其中一些药物已被报道具有抗癌作用。例如,harmaline可以通过诱导p53/p21和Fas/FasL信号通路抑制肝癌细胞的生长,并可能具有控制乳腺癌侵袭性的治疗潜力[26];chloroxine可以促进铂类药物诱导高级别浆液性癌细胞的DNA损伤,诱导其死亡。因此,预测与DERIGs相关的药物作为一个良好的参考,推动了作者未来的科学研究。
总结
总之,在肝细胞癌中鉴定出了六个潜在的与免疫相关的预后预测因子或生物标志物,包括两个异常的miRNA(hsa-miR-125b-5p和hsa-miR-21-5p)以及四个靶向基因(NTF3、PSMD14、CD320和SORT1),这些可能与免疫细胞浸润密切相关。同时,进一步的实验发现,SORT1介导的mTOR通路激活和PSMD14介导的自噬过程可能促进肝细胞癌的进展,这表明作者的研究作为未来研究的良好参考,可以加速肝细胞癌相关生物标志物和治疗方法的发展。