微生物是群落型的生存方式,高通量测序时代到来后,掀起了针对微生物群落整体研究的高潮,比如基于功能基因/16S/ITS/扩增子、宏基因组等进行群落多样性分析。但是,我们基于分离培养等方法获得单菌落,针对单菌开展基因组、转录组的研究同样很有价值,有时甚至是必不可少的。
在微生物群落研究异常火爆的今天,仍然有里程碑式的成果离不开单菌基因组的研究。例如可以同时催化两步反应硝化过程的细菌的发现。另一方面,针对新物种的基因组序列,可以开展更丰富深入的研究。

图 硝化微生物特征
在细菌基因组研究中,所有的分析内容均基于组装得到的基因组序列。那么如何利用基因组序列进行后续的分析就显得尤为重要了。微生物主宰地球的生物圈并驱动生物地球化学循环,但人们对微生物种群的地理分布或形成这些分布的环境因素知之甚少。
凌恩生物开发细菌基因组个性化分析!通过公共数据库(NCBI)等构建了全球范围的原核生物基因组和注释信息,收集大量不同生境细菌基因组数据,研究关注细菌功能基因多样性和全球尺度下的进化分布,进一步解析地理和群落统计学如何对细菌基因组的进化产生不同的影响。
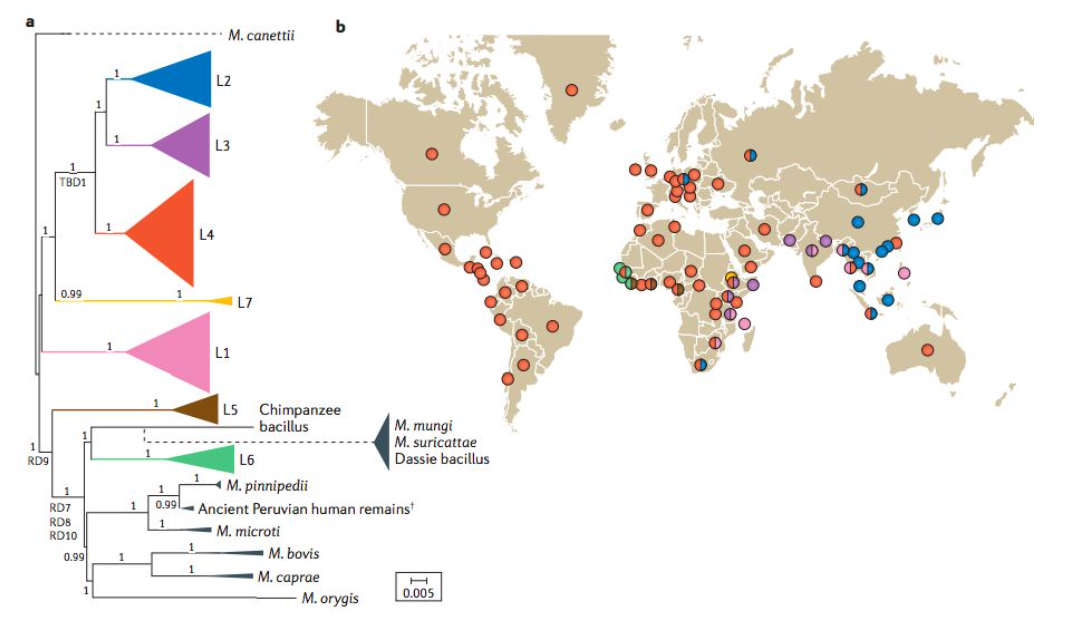
图 人类适应的结核分枝杆菌的全球系统地理学[1]
文献案例一

题目:全球种群基因组学揭示了地理和系统发育对土壤细菌水平基因转移的不同[2]
期刊:PNAS
影响因子:13.117
DOI:10.1073/pnas.1900056116
尽管已知微生物主宰地球生物圈并驱动生物地球化学循环,但人们对微生物种群的地理分布或形成这些分布模式的环境因素知之甚少。本研究在全球范围进行分层采样,来全面表征作物鹰嘴豆固氮细菌共生体的进化关系和分布限制,获得了1027个固氮细菌全基因组草图,包括来自系统发育代表性子集的14个高质量基因组。
研究发现,不同的Mesorhizobium类群与鹰嘴豆共生,并在全球范围内有很大的重叠分布。然而,采样位置基于Mesorhizobium种群的系统发育多样性进行聚类,主要是土壤类型和纬度影响细菌分布。尽管存在长期的进化分歧和地理孤立,但观察到的使鹰嘴豆结瘤的不同分类群共同具有一组编码共生主要功能的整合结合元素(ICEs)。这种共生ICE在细菌染色体中有两种形式——tripartite和monopartite,tripartite ICE仅限于广泛分布的超物种分支。这些成对进化相关性在很大程度上受到地理距离和背景基因组进化相关性的控制。相反,Mesorhizobium基因组更广泛的基因含量的多样性与核心基因组系统发育距离呈紧密的线性关系,几乎没有地理影响。这些结果说明了地理和人口学如何对细菌基因组的进化产生不同的影响,并为开发可持续农业的改进技术提供了有用的见解。
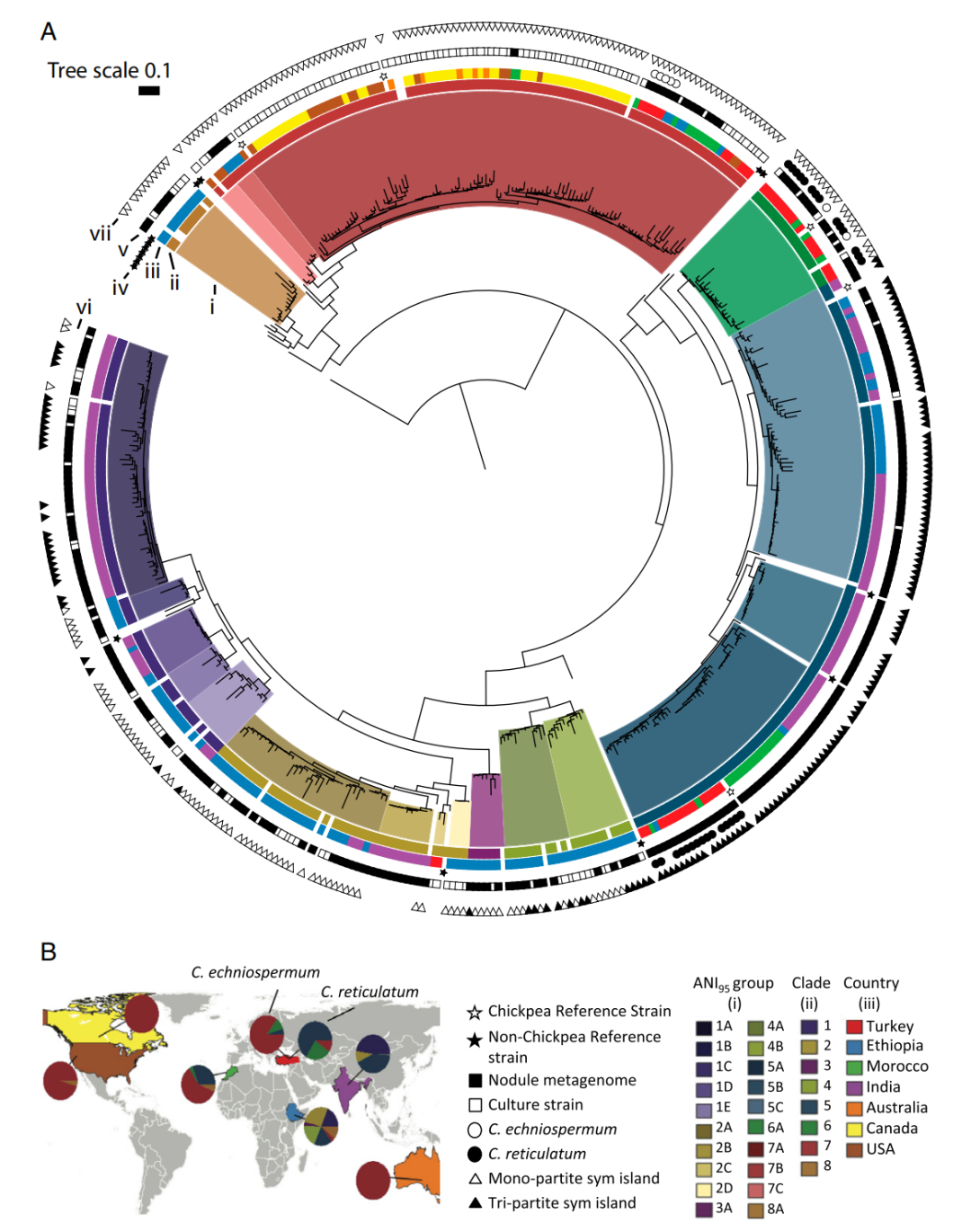
图1 全球鹰嘴豆中Mesorhizobium共生体的系统发育关系、物种分配和地理分布
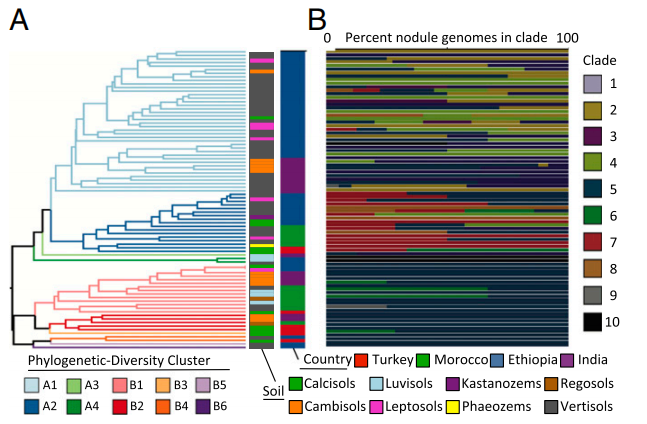
图2 500-km2采样区域内的多样性分析和土壤特征
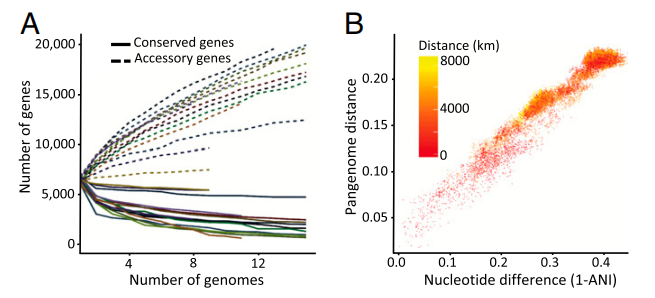
图3 全球Mesorhiozbium种群中的泛基因组关系由核心基因组进化驱动
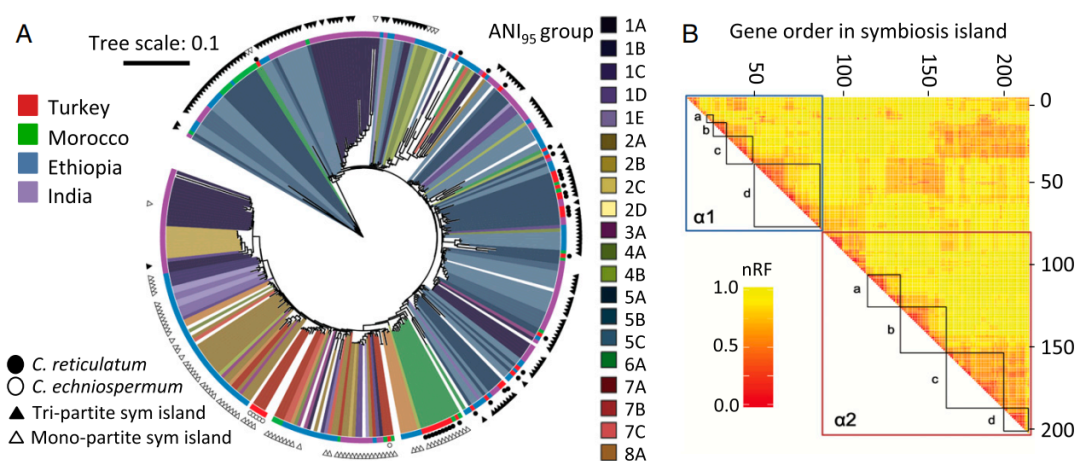
图4 共生岛系统型的分布由 ICE 结构和地理驱动,具有频繁但模式化的重组
文献案例二

题目:粪肠球菌明显的医院适应能力早于现代医院时代[3]
期刊:Nature Communications
影响因子:14.919
DOI:10.1038/s41467-021-21749-5
粪肠球菌是一种常见细菌,在大多数人中都存在于肠道中,不会对宿主造成伤害。但是,如果某人免疫力低下并且该细菌进入血液,则可能导致严重感染。在医院中,发现粪肠球菌的抗生素抗性菌株更为普遍,最初认为现代医院中抗生素的广泛使用和其他抗菌控制措施导致了这些菌株的发展。
本研究使用从患者身上分离的血流以及动物和健康人的粪便样本分析了从1936年至今的大约2000份粪肠球菌样本。通过使用二代和三代技术对基因组(包括染色体和质粒)进行测序组装,并识别多种现存的医院相关谱系,最后一个共同的祖先可以追溯到19世纪。研究绘制了细菌的进化历程,并确定了何时何地开发出不同菌株的时间表,包括如今发现的对抗生素具有抗性的菌株。结果发现,在广泛使用抗生素之前,抗药性菌株的出现要比先前想像的要早,因此,并非仅使用抗生素就可以导致这些菌株的出现。
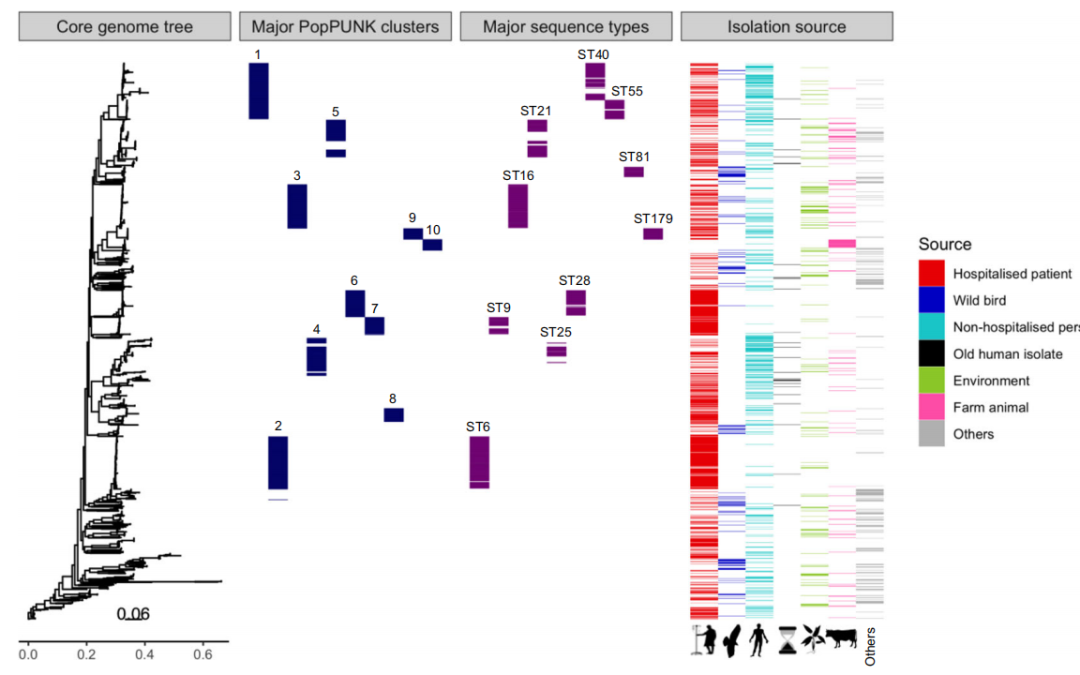
图1 大时间尺度下全部粪肠球菌(n = 2027)收集概述描述了不同宿主类型之间人口的相互联系
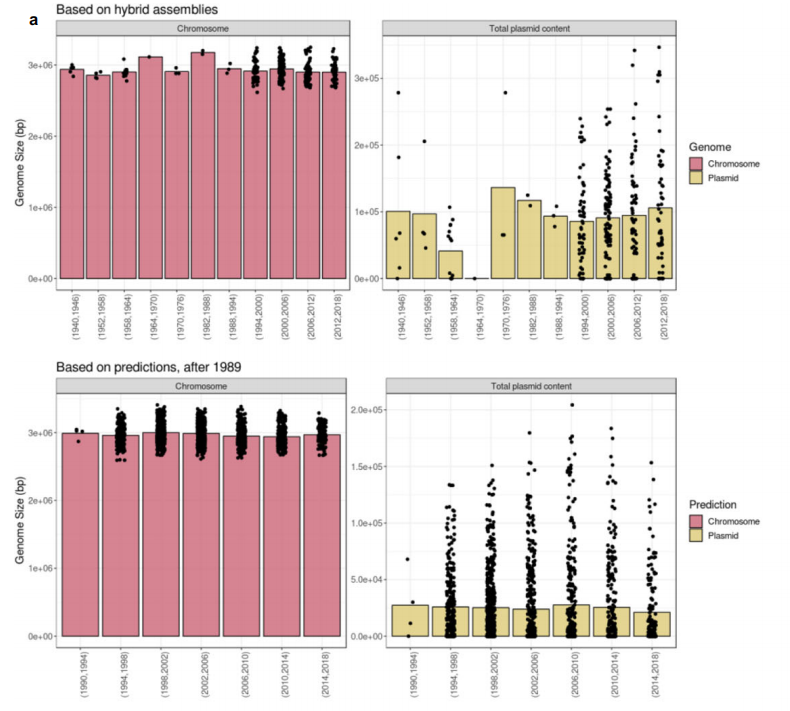
图2 群体染色体和质粒组显示随时间推移稳定的基因组大小(bp)和旧粪肠球菌分离株中的质粒抗性特征
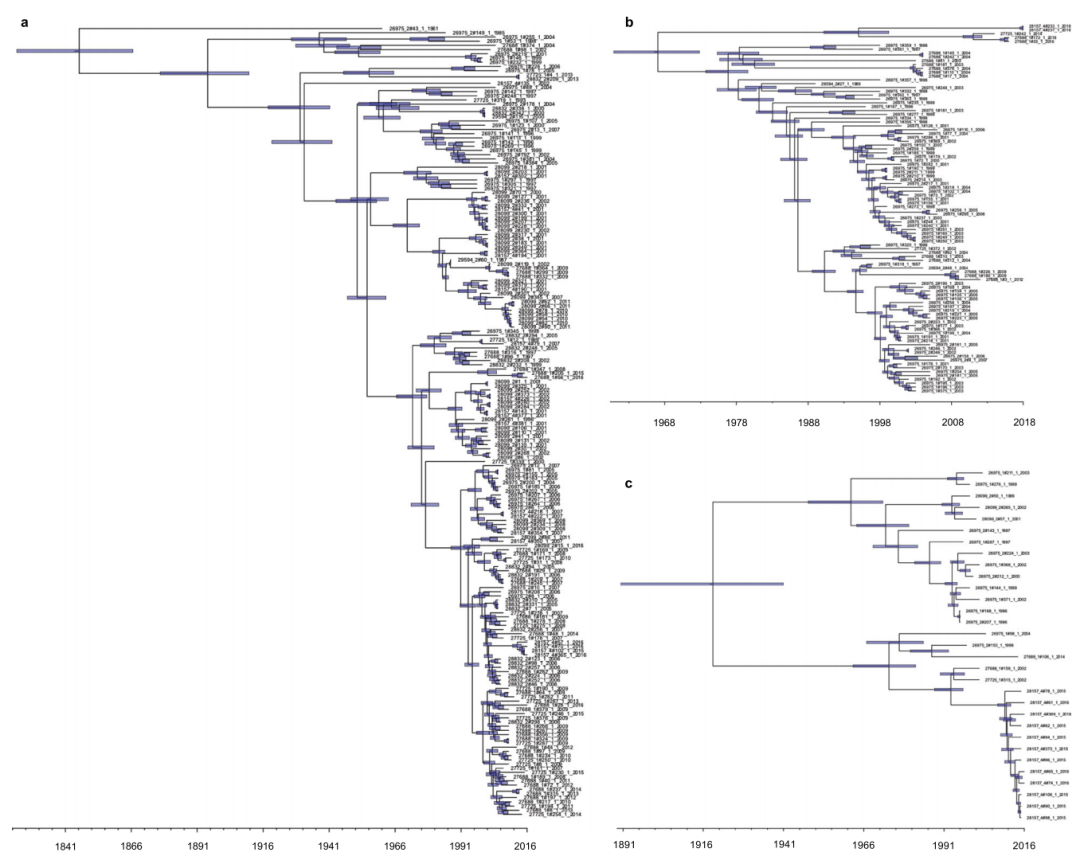
图3 分子时钟定年揭示了现存医院相关粪肠球菌种群早期和重复出现
通过全球大范围尺度分析细菌基因组进化关系,为研究打开新的视角,带来新的认知!想要get同款研究思路和分析,那就不要犹豫,马上联系我们小助教或者当地的销售了解详情吧!
参考文献
[1] Gagneux S. Ecology and evolution of Mycobacterium tuberculosis. Nat Rev Microbiol. 2018 Apr;16(4):202-213. doi: 10.1038/nrmicro.2018.8. Epub 2018 Feb 19. PMID: 29456241.
[2] Greenlon A, Chang PL, Damtew ZM, et al. Global-level population genomics reveals differential effects of geography and phylogeny on horizontal gene transfer in soil bacteria. Proc Natl Acad Sci U S A. 2019 Jul 23;116(30):15200-15209. doi: 10.1073/pnas.1900056116. Epub 2019 Jul 8. PMID: 31285337; PMCID: PMC6660780.
[3] Pöntinen AK, Top J, Arredondo-Alonso S, et al. Apparent nosocomial adaptation of Enterococcus faecalis predates the modern hospital era. Nat Commun. 2021 Mar 9;12(1):1523. doi: 10.1038/s41467-021-21749-5. PMID: 33750782; PMCID: PMC7943827.