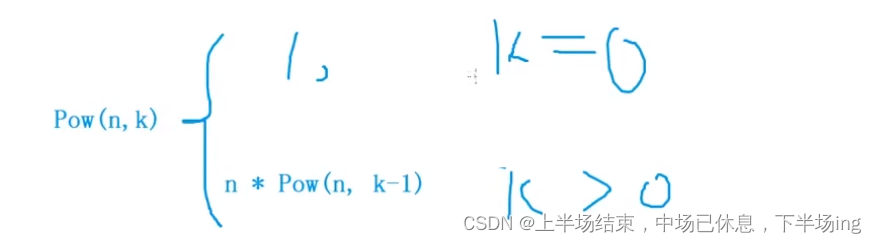越来越多的证据表明,肿瘤免疫微环境的变化与肿瘤的存活和进展有关(Soysal等人,2015年;Hinshaw和Shevde,2019年)。然而,氧化应激及其与肝癌免疫微环境的关联机制仍不清楚。本研究旨在筛选与免疫相关的氧化应激相关基因(OSRGs),并建立氧化应激相关特征来预测肝癌预后。这项研究为肝癌治疗的免疫生物标志物和治疗策略提供了见解。
1.正常样本和肿瘤样本之间的免疫微环境
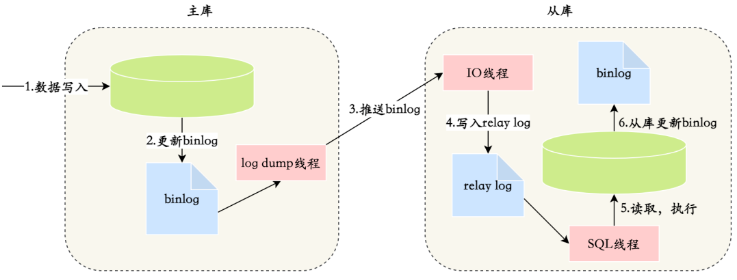
正常组和肿瘤组共获得 9 个 DIC(图 1A),肿瘤组的免疫和基质评分最低,肿瘤纯度评分最高(图 1B-D)。
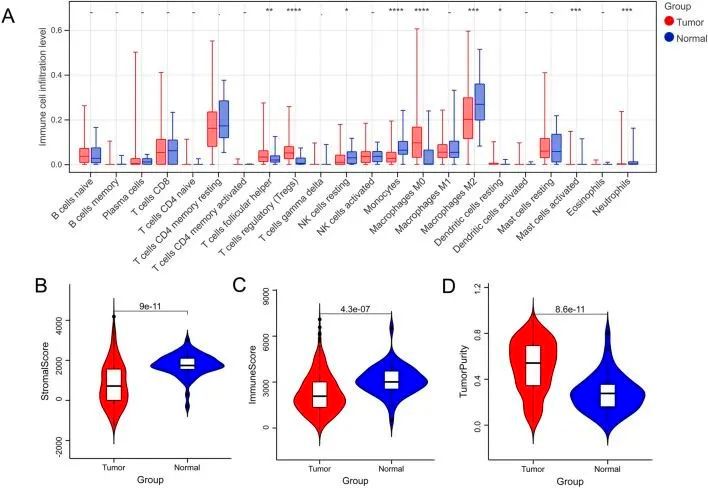
图1 正常样本与肿瘤样本的免疫微环境
2.确定三种免疫亚型
根据 9 个 DICs,进行了无监督分层聚类分析,最佳肿瘤亚型为 K = 3(图 2A)。结果得出了三个亚型,即聚类 1、2 和 3,分别有 146、154 和 65 个肝癌样本(图 2B)。模糊聚类比例(PAC)分析进一步验证了最佳肿瘤亚型为 K = 3(图 2C)。生存分析表明,在所有聚类中,聚类 1 的预后最好(图 2D)。预后亚型与临床信息的相关性见图 2E-G。
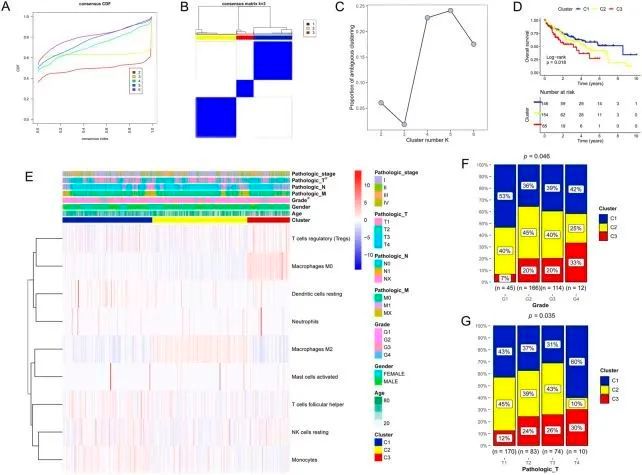
图2 无监督分层聚类分析
3. 与免疫有关的 OSRGs
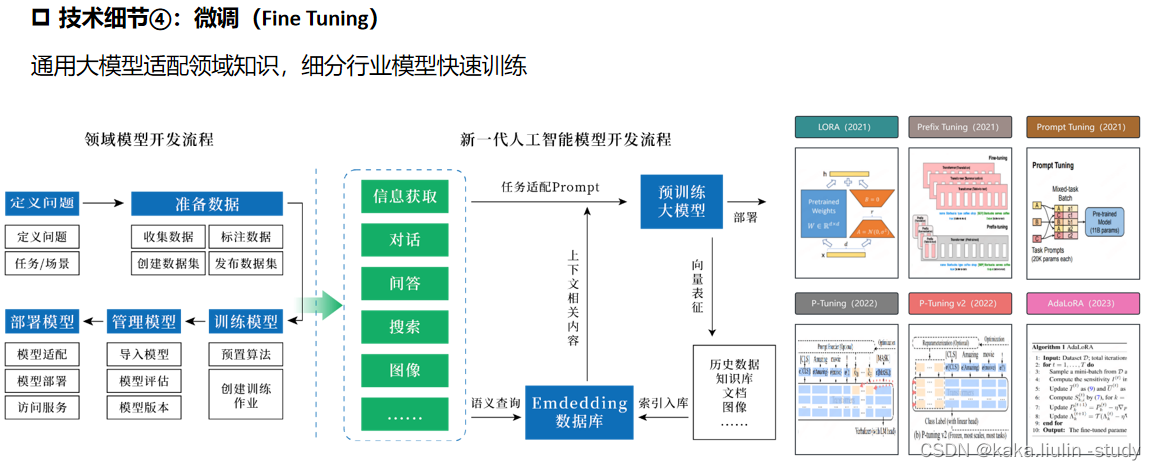
根据 758 个 OSRG,确定矩阵变换的软阈值功率为 6,其中 log2k 和 log2p k) 之间相关系数的平方为 0.85(图 3A、B)。筛选出六个模块,并计算了临床特征与每个模块之间的相关性。与临床特征相关性最高的棕色和绿色模块被选为关键模块,分别有 80 个和 58 个免疫相关 OSRG(图 3C、D)。
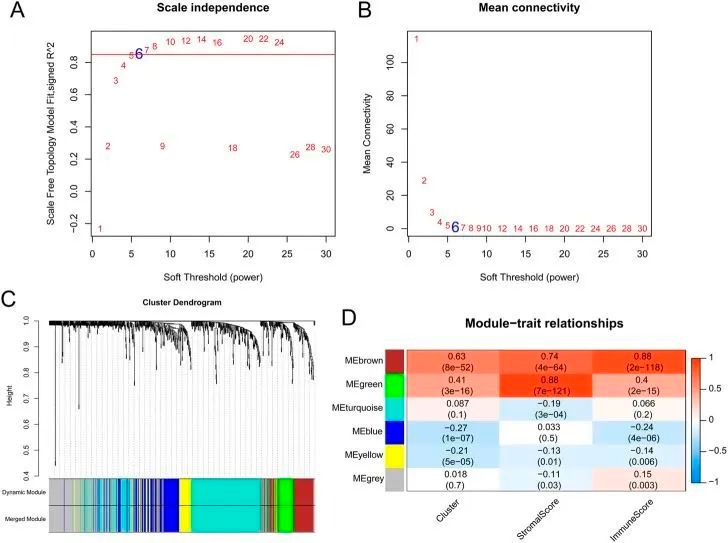
图3 加权基因共表达网络分析结果
4. OSRG 评分预后模型
在 138 个免疫相关 OSRG 的基础上,经过单变量 Cox 回归分析得出 29 个预后相关 OSRG(图 4A)。对这 29 个预后相关的 OSRG 进行 LASSO 回归分析,得出 18 个 OSRG(图 4B、C)。逐步Cox回归分析得出了7个OSRGs:BDNF、FASLG、KLF2、MMP9、S100A9、SGCB和TNFRSF1B,并将其用于建立OSRG评分预后模型(图4D)。与低OSRG评分组相比,高OSRG评分组患者的预后较差(P<0.05;图5A,B)。图 5C 和 D 分别显示了 TCGA 和 GSE14520 数据集中 OSRG 评分和生存状况的分布。TCGA 数据集中 1 年、3 年和 5 年的 OS 曲线下面积(AUC)分别为 0.753、0.791 和 0.737,GSE14520 数据集中分别为 0.711、0.700 和 0.673(图 5E、F)。此外,还评估了OSRG高分和低分与临床信息(年龄、性别、分级、病理T/N/M和分期)的相关性,结果显示OSRG得分与群集、分级、病理T和分期显著相关(图5G)
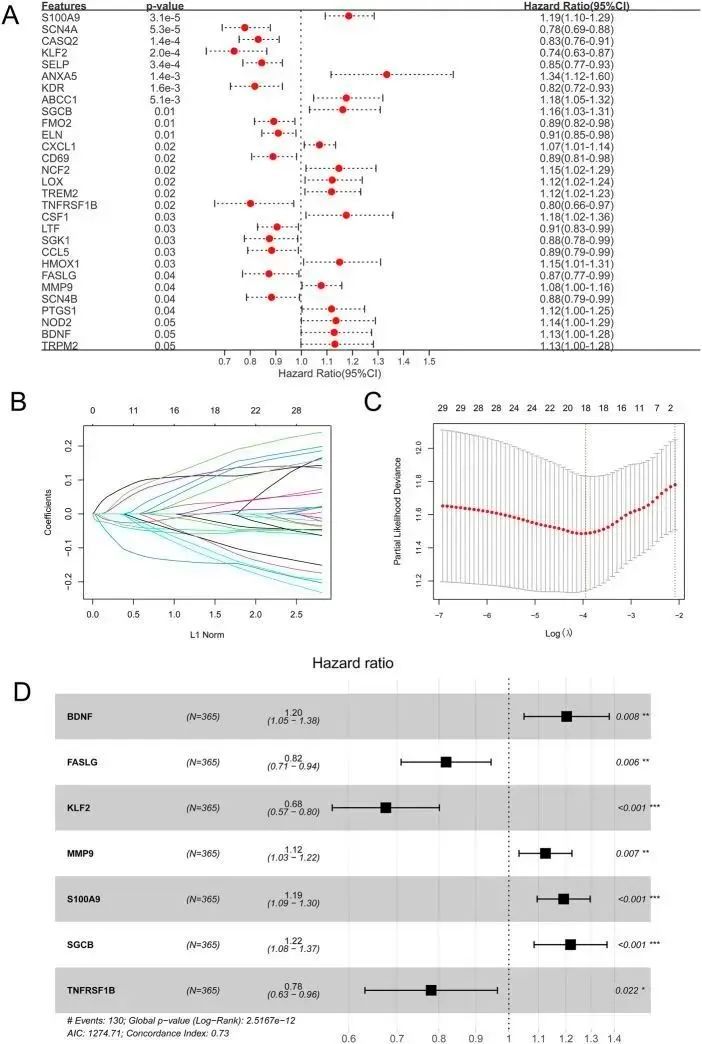
图4 氧化应激相关基因(OSRG)评分预后特征
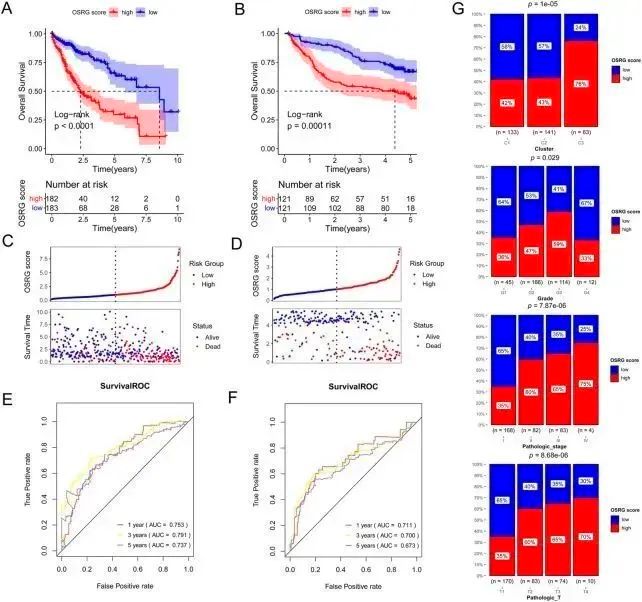
图5 OSRG 评分预后特征的生成、评估和验证
5.OSRG 高分组和低分组之间的免疫微环境
根据TCGA样本的表达谱数据,使用MCPcounter算法评估免疫细胞浸润得分,结果显示高OSRG得分组和低OSRG得分组之间有6个DIC(图6A)。16个免疫基因组的富集得分在高OSRG得分组和低OSRG得分组之间存在显著差异(图6B)。
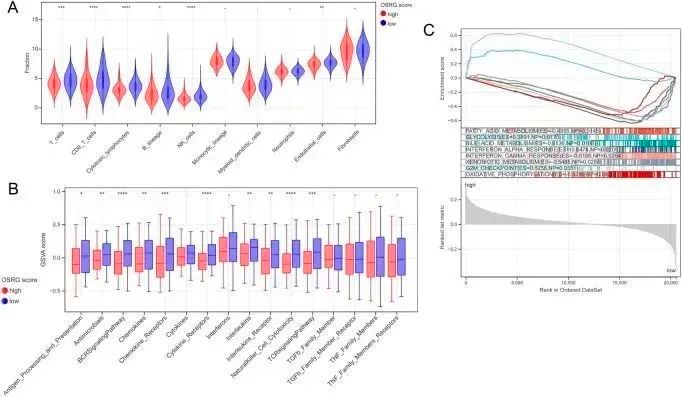
图6
6. GSEA
对高OSRG评分组和低OSRG评分组的HALLMARK基因集的差异进行了GSEA比较,截断值为p< 0.05 and NES >1。结果显示,8 个 HALLMARK 基因的富集途径在两组间存在显著差异(图 6C),包括脂肪酸代谢、糖酵解和胆汁酸代谢。
7. 构建预测患者 OS 的诺莫图
为了探索临床病理特征与预后模型之间的关系,对TCGA样本中的年龄、性别、病理MNT、分期、分级和OSRG评分进行了分析,结果显示病理T和OSRG评分是独立的预后因素(P<0.05;图7A、B),病理T和OSRG评分的C指数分别为0.600和0.687。此外,还利用病理 T 和 OSRG 评分建立了诺莫图(图 7C),并通过测量 C 指数、校准曲线和 ROC 曲线验证了其性能。结果显示,诺莫图的 C 指数为 0.703,校准图显示诺莫图准确估计了死亡率(图 7D)。生存分析表明,诺莫图与患者的预后显著相关(图 7E)。ROC 曲线显示,1 年、3 年和 5 年的 AUC 分别为 0.725、0.751 和 0.720(图 7F)。这些结果表明诺莫图具有相当高的可靠性。
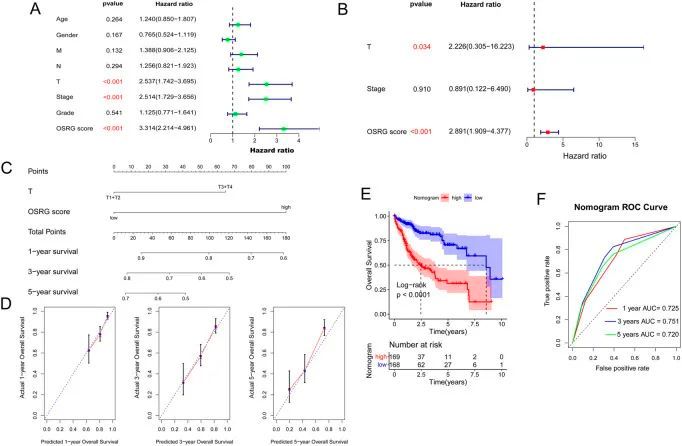
图7 构建提名图
总结
总之,作者构建了一个可靠的 OSRG 相关预后特征,它与免疫系统密切相关,可以准确预测生存期,并为肝癌患者提供了预测生物标志物或潜在靶点的见解。