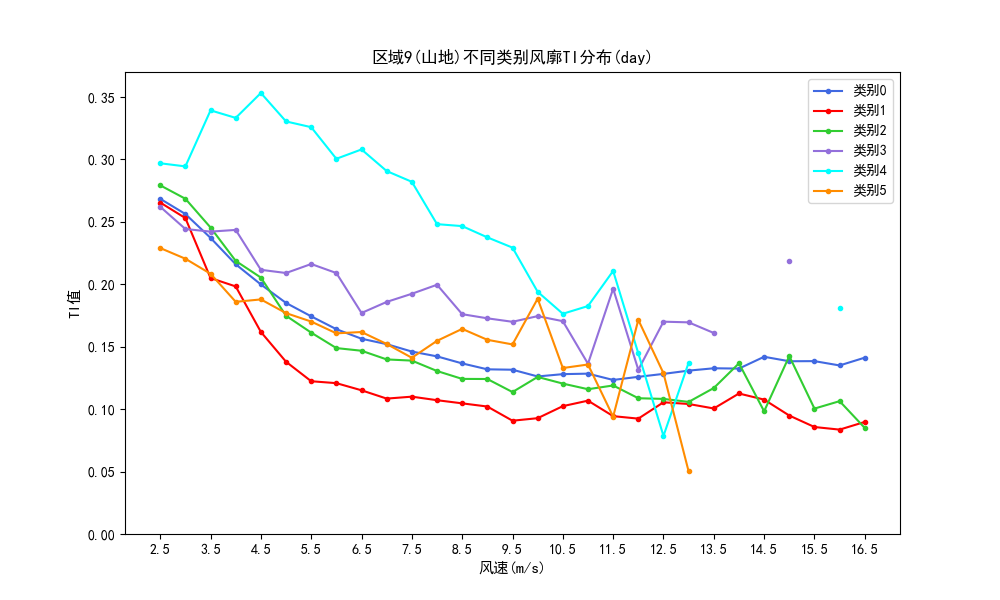
来源:BRUNO DELESSARD/CHALLENGES-REA/REDUX
新的CAR-T细胞疗法有望能治疗几乎所有血液癌症。目前,该疗法已被批准用于五种亚型的血液癌症。宾夕法尼亚大学帕尔曼医学院的科学家们在预临床试验中展示了这种方法的潜在效能。

2023年8月31日,发表于《Science Translational Medicine》(IF2022=17.1)的一项研究中,研究人员使用了工程改造的CAR-T细胞靶向CD45(几乎所有血细胞表面都存在该标记物)。鉴于CD45也存在于健康的血细胞表面,研究团队利用CRISPR基因编辑技术开发了"表位编辑"(epitope editing)的方法以防止健康细胞被CAR-T细胞所靶向,否则可能会导致血细胞计数降低,甚至出现威胁生命的副作用。早期结果描述了表位编辑的概念,该方法仅改变目标CD45分子的一小部分,使CAR T细胞无法识别它,但CD45仍然可以在血液免疫系统中发挥正常功能。
"到目前为止,尚未开发开出能够应对几乎所有血液和骨髓癌症的靶向细胞疗法,"血液肿瘤学副教授Saar Gill(MD,PhD)说。"我们很高兴能提出一种新的解决方案,可以应对免疫疗法中的一个主要问题,即无法针对癌细胞和健康细胞都存在的表面标志物。"
目前,针对血液癌症的每一种基于细胞的免疫疗法都是针对其特定靶标抗原设计的,这限制了其适用范围。例如,第一种CAR-T细胞疗法,由宾夕法尼亚大学的Carl June博士开发,该疗法针对B细胞上的CD19蛋白标志物,用于治疗B细胞淋巴瘤和白血病。目前被批准用于治疗血液癌症的六种CAR-T细胞疗法中的四种都针对CD19。另外两种针对BCMA蛋白标志物,用于治疗多发性骨髓瘤。尽管CAR-T细胞疗法取得了显著的成功,但宾夕法尼亚大学和全世界的研究人员正在努力使其对更多的患者更有效。
"目前CAR-T细胞疗法的一个缺点是,每种疗法都必须根据该癌症类型的靶标单独开发," 宾夕法尼亚大学细胞免疫疗法中心的主任June说,他是本研究的共同通讯作者。"该研究为开发更通用的方法奠定了基础,有望实现一种CAR-T细胞疗法应用到所有血液癌症。"
由于CD45存在于几乎所有的血细胞中,并且通常在血液癌症细胞中高度表达。一种能够清除所有带有CD45的细胞的治疗方法会导致患者失去所有的血细胞,包括红细胞、血小板、血浆,甚至是产生新血细胞的骨髓基础干细胞。此外,由于T细胞是血细胞并且通常表达CD45,靶向CD45的CAR-T细胞可能在被输注到病人体内之前就相互攻击。
为了克服这一挑战,该团队利用之前的工作,开发了一种新的策略,称为表位编辑。这涉及对CAR-T细胞和血干细胞进行遗传修饰,改变CD45分子结构的一小部分,即"表位"(CAR-T细胞与CD45分子结合的位点)。修饰后的CD45仍然具备功能,但与正常的CD45有足够的差异,使得抗CD45的CAR-T细胞无法识别并攻击它。
"这本质上是将CAR-T细胞疗法与造血干细胞移植相结合的方法,"Gill和June实验室的药理学研究生Nils Wellhausen说, "原理是,当基因工程改造的细胞被输注时,CAR T细胞会杀死带有正常CD45分子的癌细胞,但不会相互攻击或杀死新的工程化造血干细胞。因此工程化的造血干细胞可以分化为新的血细胞。"
由于这种策略替换了产生新血细胞的干细胞,它很有可能作为一种较温和的化疗调节形式,通常在进行骨髓移植之前给予患者,以抑制免疫系统。
研究人员在一系列细胞培养和小鼠模型的实验中测试了这种策略。他们证实,新的方法不仅能防止靶向CD45的CAR T细胞相互攻击或攻击干细胞,而且还能快速癌症细胞。在一项测试中,靶向CD45的CAR T细胞在输注后三周内消除了白血病细胞,并在两个月后仍然存在并能杀死白血病细胞。
目前该团队正在进行进一步的毒理学研究和建模研究,为新药研究申请做准备,然后才能进入第一阶段的临床试验。

在缺乏细胞表面特异性癌症抗原的情况下,免疫疗法(如嵌合抗原受体(CAR)T细胞、单克隆抗体或双特异性T细胞诱导剂)通常以细胞系抗原为目标。目前,这些免疫疗法通常是为每种疾病单独设计和测试的。这种方法效率低,并且仅限于少数几种细胞系抗原,其靶向/非肿瘤毒性在临床上易产生耐受性。该研究中,我们试图开发一种针对血液癌症的通用CAR-T细胞疗法,针对泛白细胞标记物CD45。为了保护健康的造血细胞以及CAR-T细胞,免受CD45导向的靶向/非肿瘤毒性的影响,同时保留CD45的基本功能,我们对CAR作用的CD45上的抗原表位进行了修饰,并利用CRISPR腺嘌呤碱基编辑插入了一个足以逃避CAR-T细胞识别且保持正常功能的突变。表位编辑的CD45 CAR-T细胞对内源性急性髓细胞白血病、B细胞淋巴瘤和急性T细胞白血病患者来源的肿瘤具有杀伤作用,且不会相互攻击。表位编辑的造血干细胞(HSCs)免受CAR-T细胞的攻击,与CD45基因敲除细胞不同,能够在体内植入、持续存在并发育。体外表位编辑在HSCs和T细胞中的应用,使得可以安全有效地使用CD45靶向的CAR-T细胞和双特异性T细胞诱导剂来通用治疗血液恶性肿瘤,并且这种方法还可能被应用于其他需要强烈造血系统清除的疾病。
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习






























![CUDA说明和安装[window]](https://img-blog.csdnimg.cn/img_convert/bebf45183e54509b2d7ba66fecd63ba1.png)