1、CAR-T细胞的体外扩增能力
CAR-T细胞疗法需要先从患者体内获得T淋巴细胞,然后通过体外转基因技术 transduce CAR靶向结构域。这一过程需要在细胞培养体系中得到充分的扩增,以获得足够的治疗CAR-T细胞数量。因此,CAR-T细胞的体外扩增能力直接决定了能否获得满足治疗需要的细胞数量。我们可以通过多次传代培养获得的累积细胞数、细胞扩增的倍数增加(Fold increase)以及达到设定细胞数需要的培养时间来评估CAR-T细胞产品的体外扩增能力【1】。这些指标反映了CAR-T细胞的增殖和活力,是CAR-T细胞工艺开发的关键性能指标之一。
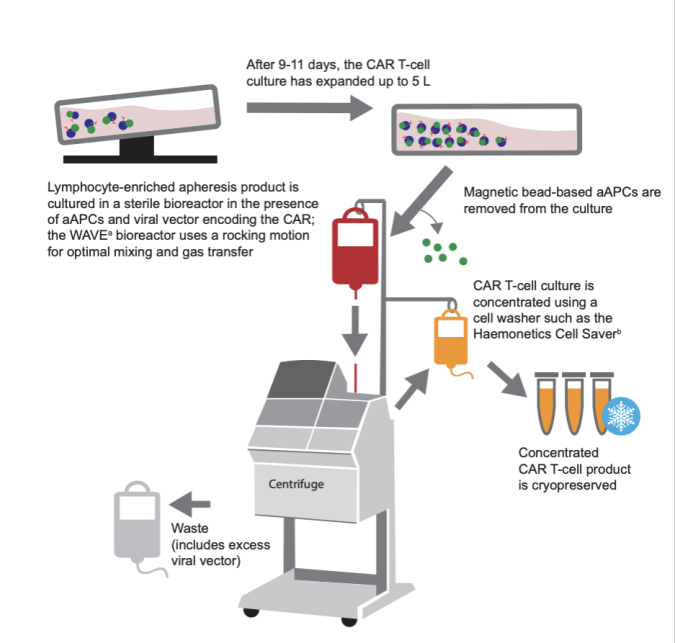
Fig1:CAR-T细胞体外扩增过程
2、CAR-T细胞在体内的持久性
CAR-T细胞输注入体内后的存活时间和持久性也是功能的重要衡量指标。持久存活的CAR-T细胞可以发挥更持久的肿瘤杀伤作用。我们通常通过流式细胞术定期检测外周血CAR-T细胞的数量变化来评估其在体内的持久性。一般输注后1-6个月甚至更长时间都可持续检出,检出峰值一般出现在输注后1-2周,峰值后的CAR-T细胞数量随时间递减是正常的【2】。理想的CAR-T细胞制剂应具有至少3-6个月的体内存活时间,这样才可以保证达到满意的治疗效果。
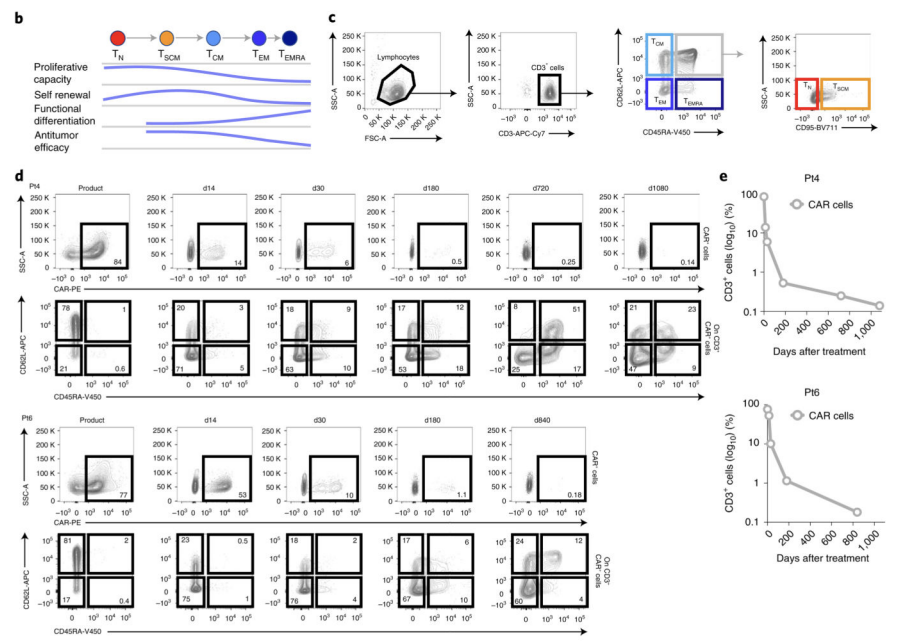
Fig2:CAR-T细胞体内持久性相关检测
3、CAR-T细胞的肿瘤靶向性能
CAR-T细胞治疗的关键机制在于经过改造,T淋巴细胞获得了高亲和力识别肿瘤表面特异性抗原的能力,所以CAR-T细胞产品必须明确具备这种靶向肿瘤细胞的能力。我们可以通过体外实验,检测CAR-T细胞对表达靶向抗原的肿瘤细胞系的杀伤作用,来判断其靶向性能。此外,我们还可以在患者体内通过流式细胞术检测肿瘤组织中CAR-T细胞的浸润情况,看其是否能高效进入肿瘤部位发挥杀伤功能【3】,理想的CAR-T细胞应高度富集于肿瘤处。
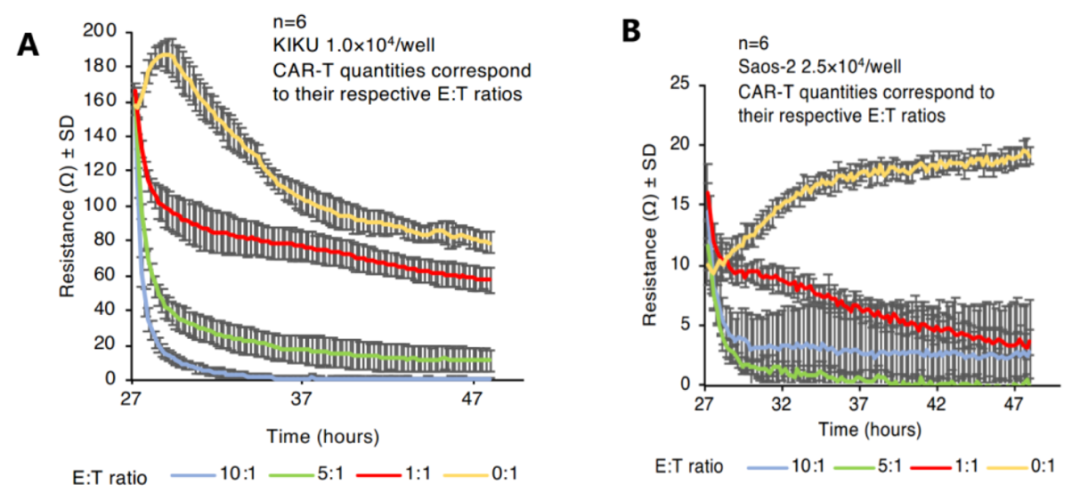
Fig3:CAR-T细胞阻抗检测
4、CAR-T细胞的细胞毒活性
CAR-T细胞识别肿瘤并激活后,会释放各种细胞因子和细胞毒颗粒来攻击和杀伤肿瘤细胞。所以我们可以检测CAR-T细胞释放的IFN-γ、肿瘤坏死因子-α、穿孔素、颗粒酶等水平,来评价其毒杀肿瘤的细胞毒活性以及活化状态【4】。体外我们可以通过共培养CAR-T细胞和靶肿瘤细胞,检测上述细胞因子和毒素的含量。脱颗粒实验也可以直观反映CAR-T细胞释放穿孔素和颗粒酶的水平,这些都是评价CAR-T细胞产品杀伤活性的重要指标。
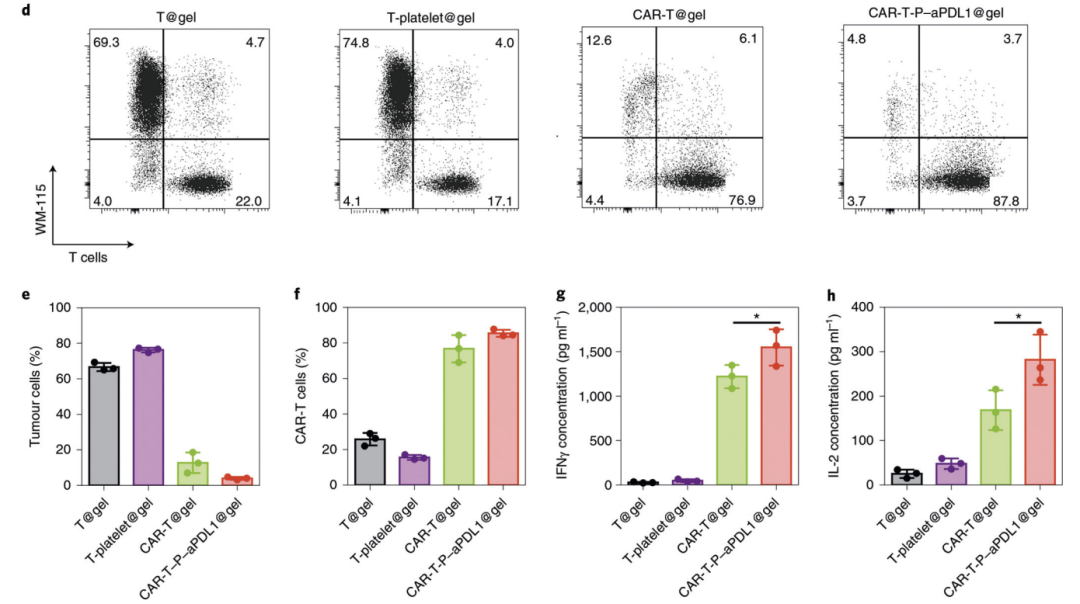
Fig4:CAR-T细胞击杀靶细胞能力检测
5、CAR-T细胞的记忆能力
理想的CAR-T细胞还应具有记忆功能,也就是重复激活后能够取得更强的活性,更快地响应肿瘤信号【5】。我们可以在体外通过多次刺激CAR-T细胞,检测其产生记忆效应,如细胞因子释放水平提高,杀伤活性增强。这种获得记忆能力的CAR-T细胞输注体内后,可实现对肿瘤更持久更强劲的杀伤作用。
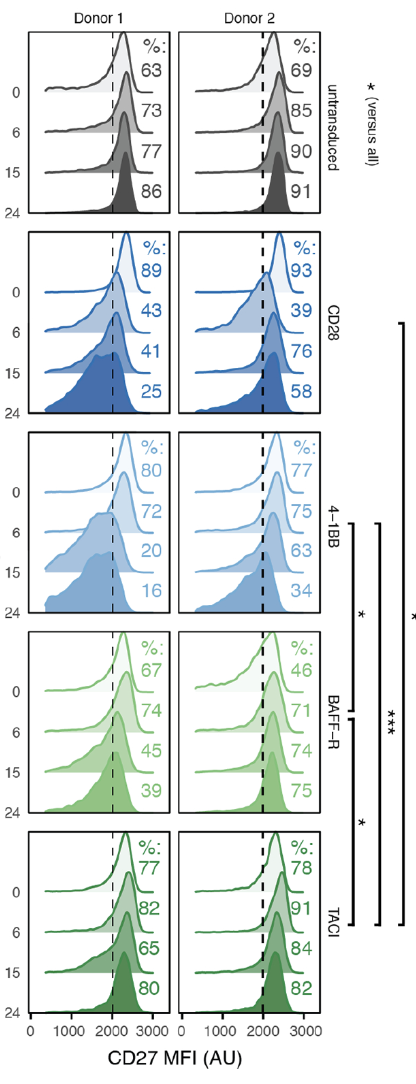
Fig5:CAR-T细胞长久持久性检测
6、CAR-T细胞治疗的安全性评价
CAR-T细胞治疗的主要风险在于可能引发严重的细胞因子释放综合征。所以我们需要检测CAR-T细胞产生的与CRS相关的细胞因子如IL-6、IL-10和IFN-γ的水平,评估CAR-T细胞治疗可能引起CRS的风险。此外还需要监测其它可能的毒副反应【6】。

Fig6:CAR-T细胞治疗B-NHL的CRS分级
这些指标可以全方位反映CAR-T细胞的关键性能,包括增殖能力、肿瘤靶向性、细胞毒活性、持久性和安全性等。只有同时满足上述指标要求的CAR-T细胞产品,才可能在临床中发挥出真正的抗肿瘤疗效。因此,开发高活性高质量的CAR-T细胞产品,必须建立科学合理的质量评价体系,扫除在发展即用型产品道路上的障碍,才能在未来实现降低成本和提高治疗效果的长远目标,惠及更多亟需治疗的患者。
明星产品推荐
CAR-T疗法作为时下最热门的明星疗法,紧随国内第三款CAR-T产品获批上市,相关CAR-T企业和平台纷纷加速研发步伐,积极着眼于差异化布局。未来相关企业除竞逐产品安全性能,降本增效将势在必行,国产替代也将成为产业发展的主要途径。免疫磁珠作为CAR-T细胞制备的重要物料,在T细胞分选/激活环节扮演着相当重要的角色。同立海源生物GMP级产品ActSep® CD3/CD28分选激活磁珠(货号:GMP-TL603)集分选和激活功能于一体,高效实现T细胞的分选、激活和扩增,适合于人T细胞、CAR-T等多种T细胞培养技术的应用,并且该产品已完成美国FDA的DMF II型备案(备案号:038124),支持细胞药物注册申报。

T细胞耗竭水平
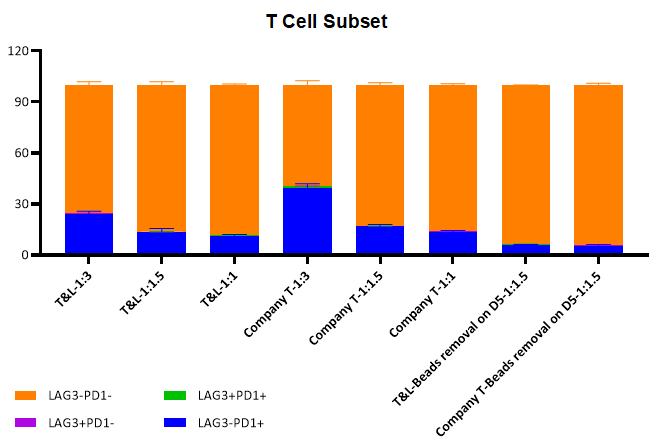
不同的磁珠添加比例下,T细胞激活培养14天后检测LAG3和PD1的表达水平, ActSep®与竞品基本持平,3:1的磁珠与细胞比例下,ActSep®耗竭指标表达更低。此外,在Day 5去除磁珠,将进一步降低T细胞的耗竭水平。
T细胞亚型分析
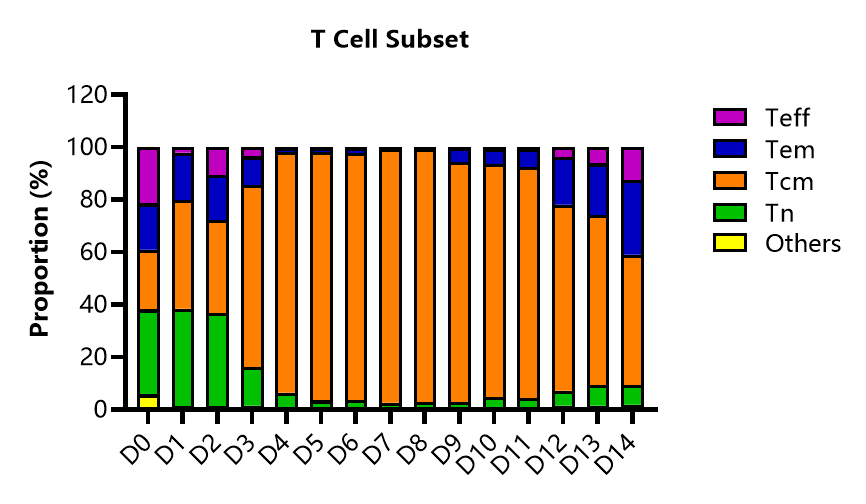
检测ActSep®分选激活后,不同培养时间点T细胞亚型的变化。Tcm占比在培养过程中升高,随着培养时间延长Teff与Tem比例有所升高。
参考文献:
【1】 Levine BL, Miskin J, Wonnacott K, Keir C. Global Manufacturing of CAR T Cell Therapy. Mol Ther Methods Clin Dev. 2016 Dec 31;4:92-101.
【2】 Biasco L, Izotova N, Rivat C, Ghorashian S, Richardson R, Guvenel A, Hough R, Wynn R, Popova B, Lopes A, Pule M, Thrasher AJ, Amrolia PJ. Clonal expansion of T memory stem cells determines early anti-leukemic responses and long-term CAR T cell persistence in patients. Nat Cancer. 2021 Jun;2(6):629-642.
【3】 Watanabe Y, Tsukahara T, Murata K, Hamada S, Kubo T, Kanaseki T, Hirohashi Y, Emori M, Teramoto A, Nakatsugawa M, Yamashita T, Torigoe T. Development of CAR-T cells specifically targeting cancer stem cell antigen DNAJB8 against solid tumours. Br J Cancer. 2023 Mar;128(5):886-895. doi: 10.1038/s41416-022-02100-1. Epub 2022 Dec 16. PMID: 36526673; PMCID: PMC9977765.
【4】 Hu Q, Li H, Archibong E, Chen Q, Ruan H, Ahn S, Dukhovlinova E, Kang Y, Wen D, Dotti G, Gu Z. Inhibition of post-surgery tumour recurrence via a hydrogel releasing CAR-T cells and anti-PDL1-conjugated platelets. Nat Biomed Eng. 2021 Sep;5(9):1038-1047.
【5】 Goodman DB, Azimi CS, Kearns K, Talbot A, Garakani K, Garcia J, Patel N, Hwang B, Lee D, Park E, Vykunta VS, Shy BR, Ye CJ, Eyquem J, Marson A, Bluestone JA, Roybal KT. Pooled screening of CAR T cells identifies diverse immune signaling domains for next-generation immunotherapies. Sci Transl Med. 2022 Nov 9;14(670):eabm1463.
【6】 《CD19 CAR-T治疗B-NHL毒副作用临床管理中国专家共识(2022)》
关于同立海源
北京同立海源生物科技有限公司,成立于2011年,专注细胞和基因治疗(CGT)上游GMP级原料试剂研发,致力于为生命科学提供可靠的产品与服务。产品涉及细胞分选磁珠试剂,真核/原核重组蛋白、无血清培养基、细胞培养试剂盒、转染试剂、基因编辑工具酶等。为细胞和基因治疗药物、抗体药物开发、细胞储存等生物制药和IVD领域提供核心原料试剂与服务。
北京同立海源生物科技有限公司的全资子公司北京景达医疗器械有限公司建有2000㎡的研发实验室及GMP级洁净车间,包括真核与原核蛋白表达工程平台、细胞培养技术开发平台、体外诊断试剂生产平台,通过ISO13485和ISO9001双认证,部分产品已获美国FDA DMF备案。