导读
人脑在微观、介观和宏观尺度的组织原则上表现出复杂的相互作用。最近的协同多模态方法已经开始将微观尺度信息与系统水平的动力学联系起来,超越了组织层级,并为大脑的功能和功能障碍提供了新的视角。具体来说,可以将微观尺度特性(如受体密度或基因表达)的分布映射到宏观尺度的fMRI测量上,以提供新的神经生物学见解。利用分子信息丰富功能成像的分析方法正在迅速发展,每个研究方向都提供了探索大脑跨层级功能的独特潜力。本文探讨了三个主要的研究方向——空间相关性、分子富集网络和全脑建模分析——以提供对不同分子信息源的关键概述,这些信息如何在fMRI数据分析中使用、每种方法的优缺点,并通过使用关键示例,强调了它们有望为神经科学研究的关键领域提供新的思路。
前言
神经精神疾病是一项艰巨的医疗挑战,我们在很大程度上仍然缺乏靶向和基于机制的治疗方法。尽管近几十年来取得了重大进展,但这在很大程度上反映了我们目前无法描述控制大脑功能的基本原理。这部分是由于大脑的分层组织所带来的挑战,该组织表现出微观、介观和宏观尺度系统之间复杂的非线性相互作用(图1)。本文使用“层级”一词来指代这种多尺度组织,它整合了嵌套和多官能元素,并最终促进行为和认知。迄今为止,阐明这种复杂性的研究大多遵循一种简化的方法,其中每个组织尺度都是独立探索的。例如,认知神经科学已经从非侵入性成像技术的出现和扩展中受益,这些技术在宏观系统层面探索神经机制。在此背景下,fMRI已成为人类研究的主要工具,用于将心理过程映射到其神经生物学基质、描述各种临床条件下大脑功能障碍的特征,以及研究大脑对药理挑战的反应。然而,血氧水平依赖(BOLD)信号在解决这些核心神经科学问题中的效用受到了限制,因为其间接性质和无法提供有关产生血氧水平依赖的细胞和分子过程的信息。总之,这些限制使得BOLD fMRI在实践和概念上都脱离了探索大脑功能和功能障碍的精细生化基础的神经科学研究领域。
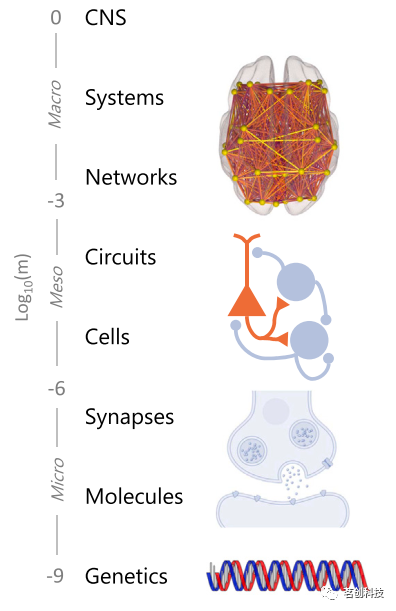
图1.大脑的微观、宏观和介观组织结构。
因此,对大脑及其疾病的全面描述,必须弥合神经系统微观和宏观组织之间的理论空白。人脑在髓细胞、细胞以及至关重要的化学结构方面表现出丰富的变化。事实上,最近的证据表明,神经受体密度显示了一种通过皮层的自然空间组织轴,与皮层地幔的层流和功能分级组织有关。通过将人脑的特定微观和介观尺度特性映射到其宏观尺度的血流动力学上,可以利用这些信息为BOLD信号提供神经生物学特异性,并产生超越组织层级的新假设。具体而言,这些方法利用分子信息(如神经递质系统或基因表达),通过测量大脑激活或连接来检查空间共变。这主要是由于正电子发射断层扫描(PET)和单光子发射计算机断层扫描(SPECT)的受体密度图谱的扩展和公开可用性,以及来自艾伦人脑图谱(AHBA)等来源的转录组数据,这些数据为新型多模态分析提供了动力。简单地说,这涉及到静息态功能连接(FC)或基于任务的激活模式与不同受体密度或基因表达分布之间的空间一致性。其他方法描绘了更复杂的时空关系。例如,最近开发了靶点功能连接的受体富集分析(REACT)方法,用于将BOLD信号的时空动态映射到不同受体系统的分布上,并获得连接生物学和FC的受体富集网络。此外,如全脑动力学的计算机模拟等方法,已被用于探索受体子系统对皮层动力学的假定贡献。这些新颖的综合方法将分子水平的微观尺度信息与宏观尺度的神经成像特征结合在一起,从而有助于表征大脑的i)功能网络结构及其与认知的关系,ii)疾病中的紊乱,以及iii)对药物的反应。至关重要的是,药物治疗是神经精神治疗的主要手段,而使用fMRI表征的网络级功能障碍仍然是从分子水平的机制中抽象出来的,这些干预措施通过分子水平的机制发挥作用。通过了解潜在疾病分子系统的紊乱和个体特异性功能障碍,我们或许能够通过与已知药物的药理学和药效学作用的联系来靶向治疗,使从功能性神经成像中获得的理论知识更接近患者的需求。
这一领域现在正积聚着巨大的发展势头,最近的一些研究展示了我们通过将分子信息与大脑固有的功能组织、认知、疾病状态和精神药理学联系起来来理解大脑的进展。在这篇综述中,作者探讨了协同多模态分析在fMRI数据中的应用和前景。首先,本文概述了分子信息源及其各自的用例。然后,本文批判性地概述了协同多模态研究中使用的三种主要方法,包括它们各自的优缺点(概述见表1)。除了这些方法之外,本文还重点介绍了它们在神经科学研究的各个领域的应用实例,用于讨论多模态神经成像分析如何促进我们对大脑及其疾病紊乱的理解。
表1.将分子信息纳入fMRI数据分析的方法。

分子信息源
利用分子信息丰富fMRI研究的一个关键共性是,需要高质量的数据来描绘受体分布和基因表达。到目前为止,这些数据主要有两个来源。首先,PET和SPECT示踪剂的开发以及数据共享实践的逐步发展,已经产生了广泛公开可用和共享的图谱,这些图谱提供了健康参与者平均受体密度的体素估计。其中包括应用PET/SPECT研究的回顾性共享数据,以及从一个非常大(N=210)的标准样本中获得的高分辨率多受体5-羟色胺能图谱,这标志着在绘制大脑“受体”方面迈出了重要一步。其次,AHBA等大型项目提供了(在6个成年神经典型人脑中测量的3702个组织样本中)超20000个基因表达模式的丰富特征。EBRAINS(https://ebrains.eu/)还提供了一个多级人脑图谱,该图谱将大脑组织的各种微观和介观尺度方面整合到一个高分辨率图谱中。然而,也存在其他来源。放射自显影图在很大程度上受到了全脑解剖覆盖率低的限制。同样,基因型-组织表达(GTEx)项目在比AHBA更大的队列中提供了额外的转录信息来源,但仅来自少数几个区域。因此,本文主要关注的是受体密度的PET估计和基因表达的AHBA测量,这两者都可以映射到与fMRI数据相同的三维解剖空间,以便在新的多模态分析中直接应用。
选择源:结合潜力还是基因表达?
选择使用PET还是转录组分子信息在很大程度上取决于研究问题。例如,AHBA提供了涵盖整个转录组的大量表达数据,而PET数据仍然局限于已经开发出配体的受体系统和子系统。因此,探索广泛分子系统的方法,或对没有PET示踪剂的特定系统的分析,拓展了AHBA的广度。尽管最近有研究尝试使用机器学习创建基因表达的顶点/体素图,但PET数据通常提供卓越的空间分辨率,允许基于体素而非基于分割的感兴趣区域(ROI)的分析。此外,六个个体的有限样本(其中只有两人同时采集了两个半球)对AHBA数据的普适性提出了质疑。此外,转录组数据具有潜在的局限性,即mRNA 仅近似于实际的蛋白质水平,以及mRNA的产生位置与许多蛋白质的表达位置之间不匹配。这些局限性的程度因受体系统而异。同样,将AHBA基因表达与放射自显影测量的蛋白质水平进行比较,发现不同受体之间存在显著差异,且大多数相关性较弱。来自210个个体的血清素系统的高分辨率多受体图谱也与AHBA基因表达数据进行了比较。有关基于AHBA的分析相关理论和方法挑战的更详细讨论,请参见Selvaggi等人(2021)的研究。从长远来看,转录组学可以通过从更多个体中获得更高分辨率的数据集来克服这些关键限制。事实上,基因和受体的相关性本身可以从基因的差异稳定性中预测出来,这表明测量的一致性提高可能会使受体丰度得到更好的估计。未来的研究可以同时利用这两种分子信息源进行比较,以减少错误分子-功能关系的产生和传播。
结构效度
当利用PET、SPECT成像和AHBA的分子信息时,一般假设标准、独立队列中的受体空间分布适用于新样本的fMRI数据。一般来说,受体密度和基因表达的平均分布似乎为给定受体或基因对给定区域BOLD信号的影响提供了有用的近似值。到目前为止,分子富集分析发现了假设驱动的药效学效应与不同药物的已知受体亲和力和(抑制)兴奋剂活性一致,这一事实主要证明了这一点。然而,从长远来看,阐明这一假设适用范围的验证性研究将很重要。特别地,使用同一受试者的PET和fMRI数据进行的分子富集分析与从不同受试者收集的fMRI数据进行比较可以提供进一步的见解。此外,从Beliveau及其同事(2017)的大量规范样本中开发和公开共享的PET图谱,可能比传统PET研究中的图谱更不容易受到异常值的影响,因为传统PET研究的参与者往往少得多。尽管有这些潜在的注意事项,但还必须强调的是,这种分子信息提供了一种相对直接的探测系统的能力,而这些系统需要昂贵且侵入性的多示踪剂研究。事实上,PET研究通常在不到20名的参与者中进行,而一些合作的fMRI数据集现在包括1000多名参与者。因此,虽然这些技术必须在适当考虑这些局限性的情况下使用,但它们也为新的大规模脑功能分析提供了机会。
fMRI结果与分子信息的空间相关性
如果假设fMRI数据的特定变化模式是由特定的生物过程驱动的,那么大脑每个区域表现出变化的程度至少可以部分地解释为该过程背后跨区域的分子机制的相对丰度。从fMRI数据中获得分子见解的最常见方法是进行常规fMRI分析,然后检查结果与不同受体或感兴趣基因的空间分布是否重叠(图2)。这种方法不再试图确定大脑中不同认知病理过程发生的“位置”,而是转向理解这些过程“如何”从更广泛的网络活动模式中出现。这种方法在推断分子水平的微观信息和宏观神经成像特征之间的关系方面很简单,因此在神经科学的许多领域都有广泛的应用。
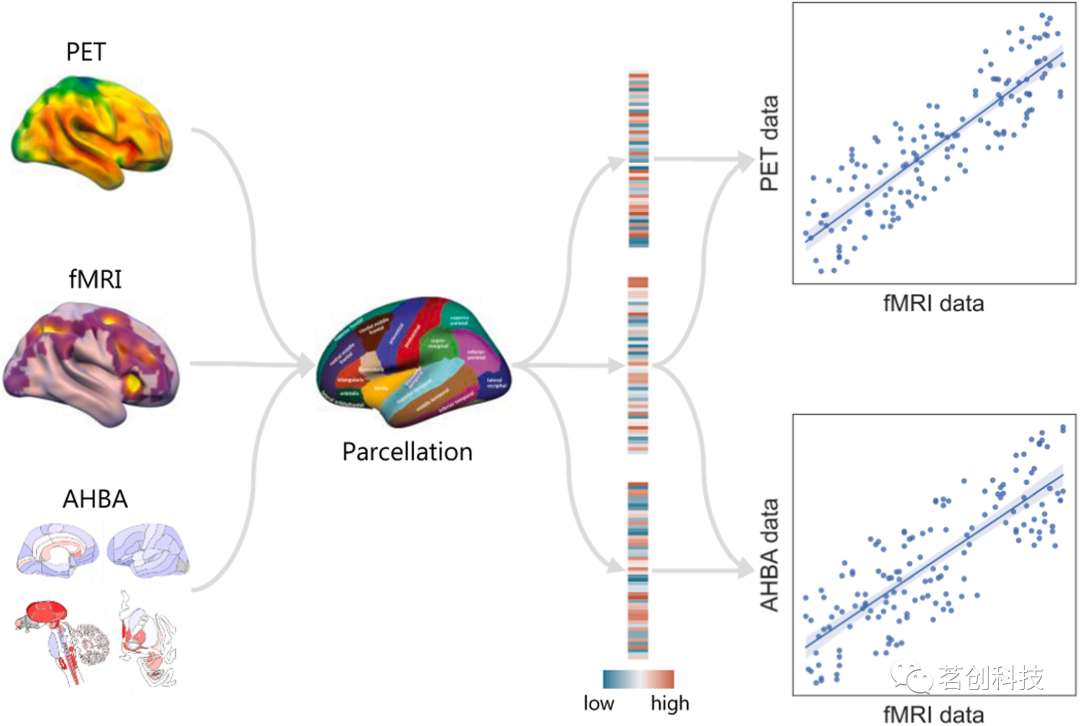
图2.简单空间相关分析概述。
方法学
在利用解剖或功能图谱(如Desikan-Killiany图谱)对全脑无阈值统计图和潜在解释系统的分子信息(如药物作用受体的分子密度或基因表达)进行对比后,这些值可用于计算fMRI和这些脑区分子数据之间的相关性(通常是Pearson相关系数)。fMRI结果与给定受体密度或基因表达谱之间的相关性或缺乏相关性,间接支持或反对分子系统与传统fMRI分析的网络水平的相关性。虽然概念简单,但具有空间自相关结构的相关脑图需要一些额外的考虑方法以避免结果夸大。
该领域也已经超越了简单的空间相关性分析,并开始以数据驱动的方式更广泛地将多个分子系统与功能成像和行为方面联系起来。当使用多个受体或基因作为解释变量来检验它们与多元线性回归框架内感兴趣的功能测量的联系,以估计每个变量对总方差的相对贡献时,必须考虑到这些系统经常表现出强烈的共线性。克服这一挑战的常用技术是偏最小二乘回归 (PLS),它将解释变量的数量减少到更小的不相关成分集。在这种情况下,PLS旨在生成与fMRI测量具有最大协方差的基于分子的成分。然后根据协方差对这些数据进行排序,使得前几个成分通常提供高维数据协方差的最佳低维表示。然而,必须注意的是,包含多种受体系统的模型并不是万能的,试图解释共线性产生的结果也具有挑战性。此外,当每个特征的样本数量较低时,PLS回归也可能不准确,导致无法充分约束模型。特别是,特征权重可能严重偏向于主成分轴,这对于基因集富集分析来说,可能会掩盖强关联的解释,因为无论fMRI数据如何,这些强关联可能是由给定基因和基因表达的第一个主成分之间的相似性驱动的。因此,需要足够数量的样本来提供PLS回归模型的稳定估计。虽然这与数据和研究问题高度相关,但Helmer及其同事(2021)根据数据集属性提出了更具体的建议。另一种同时检查多个受体系统的选择是主成分分析(PCA),在主成分分析中,一组变量(这里是PET/AHBA的分子系统)被减少到一组较小的成分,这些成分可以解释原始变量的大部分方差。与PLS一样,这允许同时对多种分子机制进行大规模检查,但代价是失去了结果的可解释性。
使用相关性分析来探索脑图(即fMRI统计图和PET或基因表达图)之间的关联时,主要挑战是主导这些数据的固有空间自相关(SA),其中相邻脑区的功能连接、受体密度和基因表达的相关性比在解剖学上较远的脑区相关性更强。这可能会夸大p值,因为两个显著自相关的空间图比具有随机值的图更有可能显示出强空间相关性。一种常见的解决方法是尝试通过回归来消除物理距离的影响。另一种是自旋方法,它使用皮层表面球形表示的随机旋转来随机化fMRI和分子分布之间的解剖排列,从而产生一个解释SA的零模型。然而,这显示出仅适用于皮层表面图的明显局限性。一种更通用的方法是生成模型代理映射,通过将其与输入数据中存在的水平匹配来保持空间自相关性。这些方法的广泛应用对于确定有意义的多模态关系至关重要,而且为了保持统计严谨性,新统计方法的发展必须与分子富集分析的进展同步。
分子富集网络分析
尽管上述空间相关性分析通过易用性提供了初步见解,但其在利用全脑BOLD波动的丰富时空动力学方面的能力有限。为了克服这一点,人们开发了新的分析方法,利用PET和SPECT成像提供的分子信息以及AHBA的基因表达数据来丰富fMRI数据。与空间相关性分析相比,分子富集网络的推导提供了两个关键优势。首先,它同时利用了BOLD信号的空域和时域,为神经生物学提供了更细致的见解。其次,它允许基于网络的fMRI分析,提供关于受体特异性的额外信息,同时也可以对差异FC区域进行空间定位,允许与先前的分子、神经解剖学和神经认知工作建立概念联系。简言之,分子富集功能网络不仅具有传统网络分析的分析灵活性,而且更直接地参与了潜在的神经生物学过程。因此,尽管分子富集网络与空间相关性分析有相似之处,但分子富集网络允许有针对性地和假设驱动地描绘药理作用和疾病状态,为通过新型诊断和预测生物标志物将这些联系起来提供了机会。
方法学
该方法采用了与传统静息态网络(RSN)分析中相同的两步多元线性回归方法,从独立成分分析中得出的组水平概率图来估计受试者特定的RSNs。然而,与传统的RSN模板不同,这些新方法将fMRI数据投射到PET和SPECT成像或AHBA的特定神经递质空间,以获得功能连接的生物信息网络(图3)。Dipasquale及其同事(2019)首次将这种方法定义并应用于药理学数据集,并将其命名为REACT(https://github.com/ottaviadipasquale/react-fmri)。REACT通常使用受体和转运蛋白分布密度的体内模板,通过对健康对照组数据集的PET和SPECT数据进行平均来估计,作为一组针对单个受试者fMRI数据的一阶GLM中的空间回归量,以提取与这些分子系统分布相关的主要BOLD波动。在这一步骤中,分子密度较高的区域比分子密度较低的区域对与分子系统相关的BOLD波动的估计贡献更大。然后将一阶GLM的输出用于二阶GLM中,以估计每个分子系统的受试者特异性分子富集功能图。来源于REACT的分子富集网络可以被认为是描绘其时间序列与特定递质系统的“核心”区域内的BOLD波动功能耦合(即正相关)或不耦合(即负相关)的区域,即高富集该神经递质的区域。所得的分子富集网络可以在组(例如,患者与对照组)、条件(例如,休息与自然刺激)或状态(例如,药物与安慰剂)之间进行比较,并与感兴趣的变量(例如:临床、心理测量或药代动力学测量)相关联。这种将分子信息整合到fMRI网络中的方法最近已扩展到基因表达数据,并使用艾伦小鼠/人脑图谱中的基因表达数据来检测小鼠和人类的受体富集网络,以得出所谓的“血清素受体网络(SRN)”。
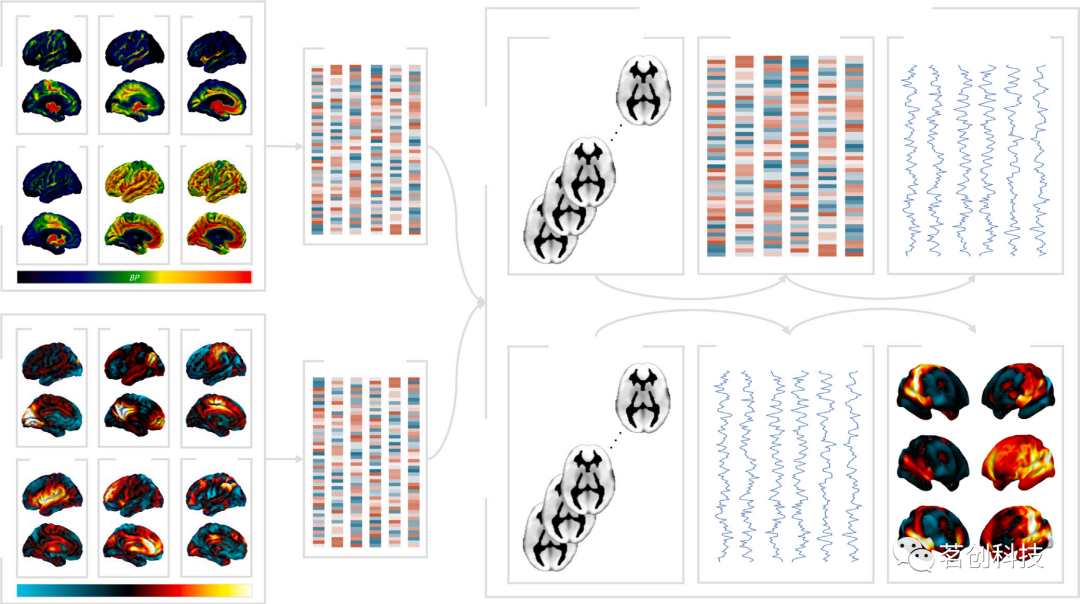
图3.传统RSN和REACT分析中使用的双重回归方法概述。
迄今为止,绝大多数分子富集的fMRI分析都集中在静息态数据上,这主要是因为它相对简单、丰富,并且在不局限于特定认知现象的情况下探索大脑功能的一系列神经机制。然而,仅从静息数据中获得的见解是有限的,与基于任务的数据相关的动态神经活动似乎更适合捕捉与行为相关的变化。此外,对于分子富集网络分析,需要考虑以下因素。首先,使用分子富集网络背后的一个关键假设是它们可能捕获神经传递的各个方面,而这一点迄今尚未得到严格证实。其次,受体系统的选择需要仔细考虑。第三,从规范队列中获得的PET和AHBA数据是否适用于存在实质性差异的人群仍存在争议。最后,不同分子系统之间存在一定程度的空间重叠。
连接分子和功能系统的计算建模方法
计算神经科学的进步越来越多地允许在计算机上对全脑动力学进行建模,为探索不同的受体系统如何促进动态大脑活动提供了新的机会。虽然现有的方法试图从系统级动力学到分子机制进行推理,但全脑计算模型试图从神经元微电路的基础构建来模拟系统级动力学。与空间相关性分析一样,这不再是简单地定位与感兴趣的认知或临床机制相关的大脑区域,而是转向跨层次地描述复杂系统如何跨尺度和区域相互作用。与前面所述的非生成式方法相比,该方法有两个重要的优势。首先,它提供了一个平台,可以轻松检验关于微电路特定变化的多个相互竞争的假设,以及它们如何通过拟合和比较不同的模型导致宏观尺度的变化。其次,使用生成模型需要对可能的机制进行先验假设(而不是依赖于事后解释),以提高准确性、严谨性和透明度。
方法学
生成全脑模型的全部细节超出了本综述的范围,但Cofre及其同事(2020)对关键的方法进行了详细概述。简而言之,需要对大脑进行分区以描绘局部动力学和全局交互建模的不同区域,提供这些区域之间白质纤维连接近似值的解剖连接矩阵,以及已经提出了大量不同选择的局部动力学模型(图4)。局部动力学的常见选择包括神经质量和平均场模型,即构成抽象但现实的神经元相互作用模型的一系列微分方程,可以近似于实验数据中观察到的涌现宏观尺度动力学。因此,对这些模型的组成部分(模型参数)的因果操纵,可以系统地检查改变大脑功能不同方面(与这些参数相关的生物学机制)的反事实因果。

图4.全脑计算模型所需的多模态组成部分概述。
在分子富集分析的背景下,可将PET受体密度信息纳入这些模型,以探索其在假定受体系统参与的条件下模拟实验数据的能力。然而,这些感兴趣的生物学机制必须整合到特定的模型参数中。这在神经调节系统的药理学操作背景下尤其容易处理,在这种情况下,可以根据受体系统的相对分布包括神经增益的缩放来模拟药物的效果,以试图捕捉实验中观察到的动力学变化。这提供了一种强大的手段,可用于检测关于给定受体在产生网络变化中所起作用的明确假设,例如,在假定与之结合的药物作用下所产生的网络变化。因此,这些来自PET或AHBA的分子信息源可以被认为是整个大脑模型异质性的来源,有机会获得许多额外的参数,如时间常数tau、静息膜电位、动作电位阈值和最大神经放电率。
结论
本文概述的新方法将微观分子水平的信息与宏观系统动力学结合在一起,为大脑在健康和疾病中的跨层级功能组织提供了重要的见解。尽管空间相关分析通过易用性提供了初步机会,但它越来越多地用于将多分子系统大规模映射到多变量fMRI测量。受体富集网络分析可以表征BOLD信号与分子系统分布之间的时空关系,其中受体富集连接图适用于传统的被试间分析,包括基于感兴趣的行为和临床指标的体素回归。最后,全脑建模允许对大脑结构和功能的微观和介观层面进行系统和因果操纵,以检查对模拟的网络动力学产生的反事实因果。此外,通过将系统级动力学与其分子底物联系起来,我们可以将多个层级的分析结果汇集在一起。本文希望这最终有助于促进大脑功能和功能障碍的所有重要“全局”理论的形成,提供新的可检验假设,这些假设可以用现代神经科学可用的全套工具在微观和宏观尺度内进行检验。此外,通过表征跨疾病分子功能障碍将临床症状学与药物疗法联系起来,可能有助于使功能成像更接近临床现实。
原文:Timothy Lawn, Matthew A Howard, Federico Turkheimer, Bratislav Misic, Gustavo Deco, Daniel Martins and Ottavia Dipasquale, From Neurotransmitters to Networks: Transcending Organisational Hierarchies with Molecular-informed Functional Imaging, Neuroscience and Biobehavioral Reviews, (2023) Doi: https://doi.org/10.1016/j.neubiorev.2023.105193