文章信息
题目:Sugar transporter TaSTP3 activation by TaWRKY19/61/82 enhances stripe rust susceptibility in wheat
刊名:New Phytologist
作者:Baoyu Huai,Zhensheng Kang,Jie Liu et al.
单位:Northwest A&F University
日期:21 June 2022
01
摘要
寄主植物的糖外流对于病原体的存活和增殖至关重要。糖转运蛋白介导的宿主糖再分配有助于植物-病原体相互作用。然而,很少有研究关注在宿主定植期间如何战略性地操纵糖易位。
为了阐明这个问题,小麦糖转运蛋白 (STP) TaSTP3 响应于Puccinia striiformis ( Pst ) 感染的特征,通过小麦中 RNA 干扰和过表达揭示STP在Pst感染过程中的潜在作用。此外,进一步确定了调节TaSTP3表达的转录因子。
结果表明,TaSTP3 定位于质膜并作为己糖和蔗糖的糖转运蛋白发挥作用。TaSTP3增强了小麦对Pst的敏感性,并且TaSTP3的过表达导致蔗糖积累增加和防御相关基因的转录抑制。此外,TaWRKY19、TaWRKY61 和 TaWRKY82 被鉴定为TaSTP3表达的正转录调节因子。
我们的研究结果表明,Pst诱导的糖转运蛋白TaSTP3被 TaWRKY19/61/82 转录激活,并可能通过提高蔗糖浓度促进小麦对条锈病的易感性,并表明TaSTP3是小麦对条锈病抗性的强靶点。
02
技术路线
wheat (Triticum aestivum) cv Suwon11 (Su11) and the Pst isolate CYR31
RNA extraction, reverse transcription quantitative PCR, and sequence analysis
Primers, strains, and plasmid constructs
BSMV-mediated transient gene silencing
Histological observation
Generation of transgenic Arabidopsis and wheat
Transient expression in plants
Heterologous expression of TaSTP3 in yeast
Split-ubiquitin analysis
Extraction and quantification of soluble sugars
RNA-Seq and data analysis
Yeast one-hybrid assay
Transactivation assay in plants
03
主要结果
3.1 推测糖转运蛋白TaSTP3在小麦Pst感染期间被诱导。
为了更好地理解STPs在小麦Pst-定殖中的作用,我们首先试图全面表征STP在小麦基因组中的分布。为此,我们使用来自水稻的STP序列作为小麦基因组数据库(EnsembPlants)中的BLAST搜索查询,该数据库显示了小麦基因组中总共79个STP(表S3)。然后,我们使用推测的TaSTP以及来自水稻和拟南芥的STP的全长蛋白质序列生成了最大似然(ML)系统发育树(图S1)。
为了确定哪些TaSTP对Pst感染有反应,我们从实验中搜索转录组数据(http://www.wheat-expression.com/)数据库。结果表明,接种Pst后,79个转运体中的5个(TaSTP3、TaSTP6、TaSTP13、TaSTP25和TaSTP26)被诱导,TaSTP2表达最显著(图S2)。由于先前的研究表明TaSTP6和TaSTP13对Pst感染有反应,因此我们使用RTqPCR检测了其他三个基因的相对表达谱。我们发现,TaSTP3的所有三个亚基因组拷贝(即TaSTP3-2A、TaSTP3-2 B和TaSTP3-3 D)在小麦Pst相互作用过程中均高度转录上调(图S3a),这与转录组数据一致,而TaSTP25和TaSTP26仅表现出轻微的表达差异(图S3b,c)。因此,我们在随后的功能表征分析中关注TaSTP3。
使用从小麦基因组序列中产生的特异性引物(表S1),我们从感染Pst的Su11小麦品种收集的RNA中扩增了TaSTP3每个亚基因组拷贝的全长cDNA。三个拷贝显示98.93%(图S4)核苷酸序列同一性和99.74%(图S5)氨基酸同一性。使用隐马尔可夫模型(TMHMM)和Pfam分析进行的跨膜预测表明,TaSTP3含有12个跨膜结构域(TMD)(图S6)。综上所述,这些发现表明,TaSTP3作为一种推测的糖转运蛋白,可能响应小麦的Pst感染。
3.2 TaSTP3能在酵母中运输己糖和蔗糖
为了表征TaSTP3的糖转运特性,在酵母(酿酒酵母)突变株YSL2-1中表达了三个TaSTP3的拷贝,该突变株缺少所有内源性己糖转运蛋白和细胞外转化酶,但保留了胞质转化酶。结果表明,携带TaSTP3-2A、TaSTP3-2 B或TaSTP3-2D的转化子可以在补充有葡萄糖、果糖、甘露糖或蔗糖作为唯一碳源的SD Ura培养基上正常生长,但携带空载体(pDR195)的YSL2-1不能正常生长(图1a、S7a)。此外,在含有半乳糖作为唯一碳源的SD平板上,对照组和携带菌株的TaSTP3之间的生长没有发现显著差异(图S7a)。
由于表达TaSTP3-2A、TaSTP3-2 B或TaSTP3-2D的酵母菌株在生长方面没有明显差异(图1a、S7),我们选择了表达TaSTP2B的酵母菌株进行进一步实验。由于已知STP通常只运输己糖,而不是蔗糖,我们试图进一步确认蔗糖可以作为TaSTP3的底物。为此,我们使用荧光蔗糖类似物七叶皂苷在酵母中进行摄取测定。随后的共聚焦显微镜显示,在表达TaSTP3-2B的酵母细胞中荧光七叶皂苷的积累(图1b),而在对照菌株中未观察到荧光信号(图1b)。
此外,与TaSTP3不同,其他两种Ps诱导的STP蛋白TaSTP6和TaSTP13没有显示蔗糖转运活性(图S7b)。这些数据表明TaSTP3与其他特征性STP相比具有更宽的底物特异性。为了确定TaSTP3的动力学参数,我们接下来进行[14C]葡萄糖摄取测定。我们的结果表明,表达TaSTP3-2B的互补菌株可以摄取[14C]葡萄糖,而空载体对照菌株不能(图1c)。此外,TaSTP3在pH 5.5时显示了[14C]葡萄糖转运的最大速率(图1d)。基于[14C]葡萄糖摄取对葡萄糖浓度的响应,TaSTP3对葡萄糖的Km值估计为62.8±6.3µM,最大摄取率(Vmax)为454.6±12.8 pmol mg-1 min-1(图1e)。
为了进一步阐明TaSTP3的底物特异性,我们还测量了10倍过量非放射性糖存在下的[14C]葡萄糖转运。非放射性葡萄糖和甘露糖干扰[14C]葡萄糖摄取(图1f),而果糖对葡萄糖摄取没有明显影响(图1f)。此外,戊糖(如木糖和阿拉伯糖)以及双糖蔗糖都降低了[14C]葡萄糖摄取率(图1f)。此外,在存在质子解偶联剂羰基氰化物间氯苯基腙(CCCP)的情况下,TaSTP3对[14C]葡萄糖的摄取显著减少,这表明TaSTP3-介导的糖摄取需要质子梯度(图1f)。通过在酵母中异源表达获得的这些数据表明,TaSTP3作为糖(己糖或蔗糖)/质子转运体发挥作用。
Fig. 1
3.3 TaSTP3定位于质膜并形成同源低聚物
为了检测TaSTP3蛋白的亚细胞定位,我们使用荧光显微镜观察了TaSTP3-GFP在小麦叶原生质体、本氏菌叶和酵母突变体YSL2-1中的表达。作为阴性对照,游离GFP广泛分布在细胞质和细胞核中(图S8a),而TaSTP3-GFP融合蛋白明显移动到小麦叶原生质体的质膜上(图S8 a)。类似地,在荧光强度的路径分析中,来自本氏菌叶片中瞬时表达的TaSTP3-GFP的信号与来自质膜选择性荧光染料FM4-64的信号共定位(图S8b)。此外,TaSTP3在酵母中的亚细胞定位与小麦原生质体和烟草叶片中的定位相同(图S8c)。因此,这些结果表明TaSTP3锚定在质膜上,与其预测的TMD一致。由于已知一些STP作为二聚体具有功能活性,我们使用分裂泛素系统和BiFC来测试TaSTP3是否形成同源低聚物。我们发现,与TaSTP3 NubG(一种仅携带N末端的截短泛素变体)和TaSTP3-Cub(一种C末端截短泛肽变体)共转化的酵母细胞可以在含有X-Gal的SD培养基(-Trp、-Leu、-His和-Ade)上生长(图S9a),这表明酵母中TaSTP3的自身相互作用。
BiFC分析研究了TaSTP3在植物中的二聚体是否在共同表达Yn:TaSGT1/TaRAR1:Yc(阳性对照)或Yn:TaSTP3/TaSTP3:Yc的本氏菌叶片中显示出强烈的绿色荧光信号(图S9b)。然而,在与单独含有Yn:TaSTP3或Yc的根癌菌共渗的本氏菌叶片中未观察到荧光(图S9b)。综上所述,我们的结果支持TaSTP3可以形成同源寡聚复合物的假设。
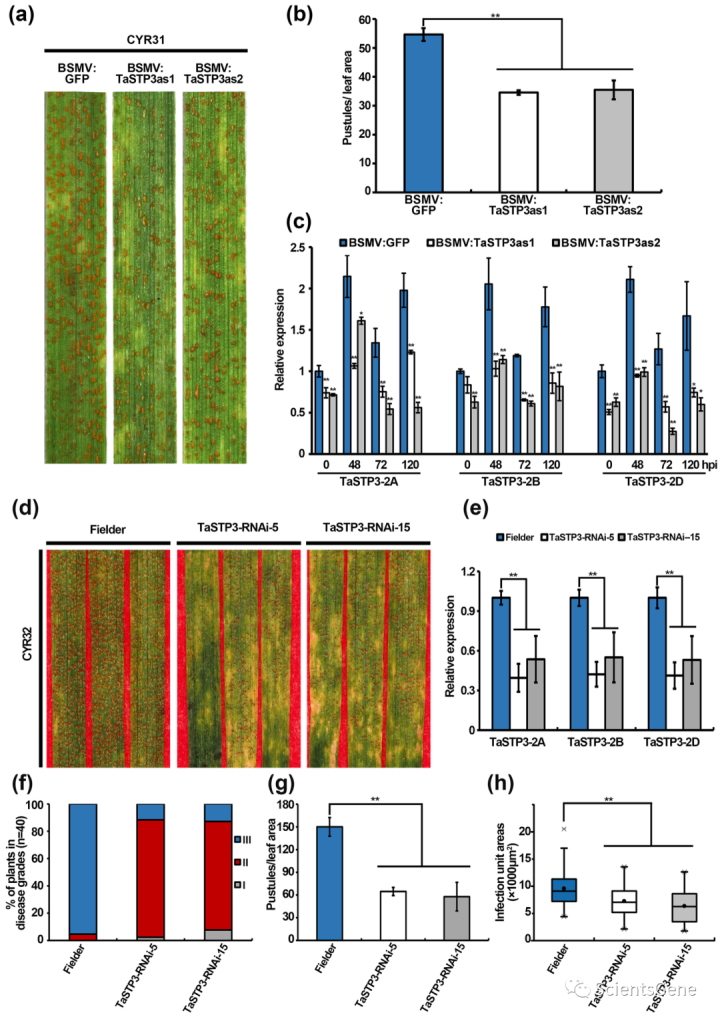
3.4 沉默TaSTP3提高小麦对Pst感染的抗性
为了确定TaSTP3在小麦Pst相互作用中的潜在作用,我们使用BSMV-VIGS使用两个特定片段敲除TaSTP3的表达(图S4)。我们发现,在14dpi时,感染Pst分离物CYR31的TaSTP3沉默小麦叶片比对照植物(BSMV:GFP)产生更少的毒性(图2a,b)。RT-qPCR对沉默效率的定量分析表明,TaSTP3基因敲除小麦幼苗中的TaSTP3转录水平显著降低(图2c)。
此外,通过荧光显微镜对Pst感染叶片的观察表明,与对照(BSMV:GFP)相比,TaSTP3沉默植物的菌丝分支(HB)、吸器母细胞(HMC)和吸器的数量在48 hpi时均较低(图S10a,b)。与此观察一致,在72和120 hpi时,TaSTP3沉默植物的感染面积也小于对照(图S10a、S10c-e)。这些结果表明,TaSTP3的抑制导致小麦对Pst的抗性增强。
为了进一步确认Pst感染期间TaSTP3在小麦中的功能,RNAi用于产生两个独立的T2转基因系(TaSTP3RNAi-5和TaSTP3-RNAi-15),在对Pst毒株CYR32表现出增强抗性的模型小麦“Fielder”中稳定抑制TaSTP3。沉默效率的评估表明,与对照组相比,转基因系中所有TaSTP3亚基因组拷贝的转录均受到类似的显著抑制(图2e)。温室条件下疾病严重程度的统计比较显示,TaSTP3-RNAi-5和TaSTP3/RNAi-15系表现出中等抗性(即,2级,分别为86%和79%),而Fielder表现出对Pst CYR32感染的高敏感性(3级,95%)(图2f)。因此,转基因植株叶片上脓疱的平均数量与对照植株叶片上的脓疱数量相比显著减少(图2g)。此外,通过Alexa Fluor 488染色对Pst CYR32感染的TaSTP3 RNAi株系的叶片中的平均菌丝面积进行量化,发现菌丝定殖率低于对照植物(图2h,S11a)。
此外,与对照植物相比,我们观察到TaSTP3 RNAi小麦植株的农艺性状没有明显变化(图S12a-d)。总的来说,这些TaSTP3抑制的结果表明,它对小麦Pst感染的严重程度有很大的影响
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
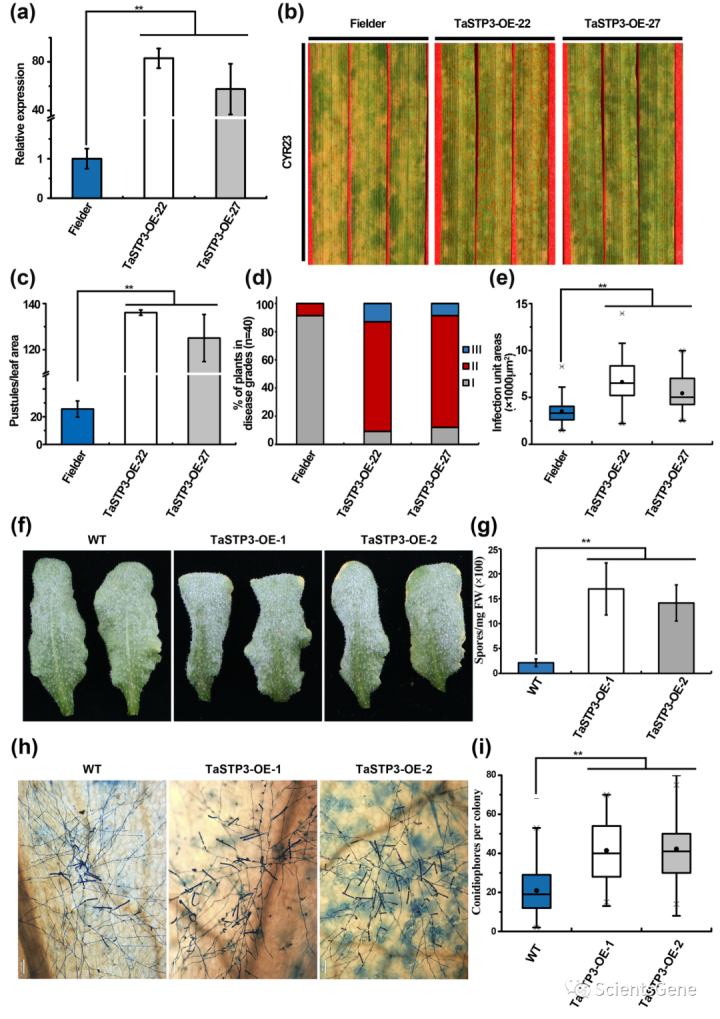
3.5 TaSTP3的过表达促进宿主对生物营养真菌病原体的敏感性
为了进一步研究TaSTP3对小麦对Pst敏感性的贡献,我们产生了过表达TaSTP3的转基因小麦植株。选择了两个在RT-qPCR检测中表现出高TaSTP3-转录水平的独立T2转基因系(TaSTP3-OE-22和TaSTP3-0E-27)进行进一步分析(图3a)。
我们发现,用无毒Pst分离物CYR23接种转基因过表达系导致在14dpi时出现疾病症状,这表明在TaSTP3高表达下,小麦对Pst的敏感性显著增强,与野生型(WT)相比,具有更大的脲原体丰度(图3b,c)和更高的疾病严重性得分(图3d)。此外,受Pst感染的TaSTP3 OE系显示出更大的菌丝定植面积(图3e,S11b)与ROS积累(图S13a,b)和细胞死亡(图S13a,c)相关的过敏反应较少。
然后,我们在拟南芥Col-0中产生了两个TaSTP3过表达系(TaSTP3-OE-1和TaSTP3-0E-2),并将这些系接种白粉病病原体。我们随后观察到,在TaSTP3过度表达下,对白粉病的敏感性增强(图3f),在12dpi时,TaSTP3OE植物上形成的孢子明显多于野生型Col-0植物(图3g)。
此外,组织学观察还显示,在5 dpi时,TaSTP3 OE植物上的菌落比Col-0植物上有更多的分生孢子团(图3h,图3i中量化)。因此,这些结果表明,TaSTP3的过度表达促进了宿主对专性生物营养真菌(如锈菌和白粉病)的敏感性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.6 TaSTP3过表达导致蔗糖积累增加和防御相关基因表达降低
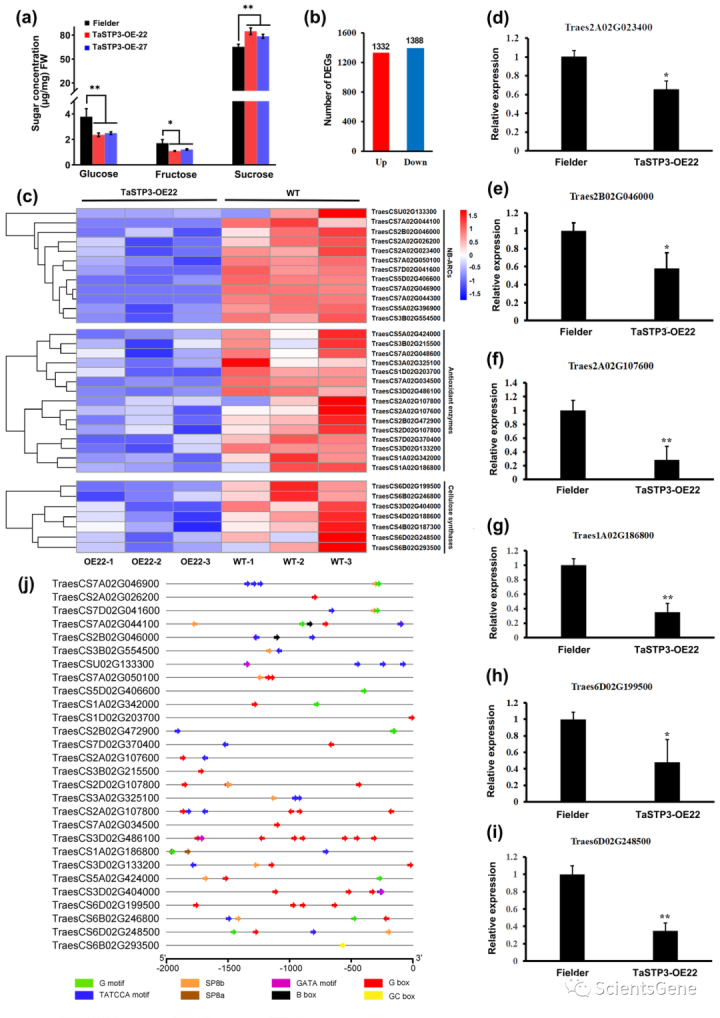
鉴于STPs已被证明能够介导糖从质外体到跨质膜的胞浆的回收,我们假设TaSTP3可能通过质外体糖的导入潜在地影响防御反应。为了验证这一假设,使用GC-MS对过表达(TaSTP3-OE-22和TaSTP3-OE-27)和RNAi(TaSTP-RNAi-5和TaSTP2-RNAi-15)小麦幼苗叶片中的糖浓度进行定量。结果表明,与WT植物相比,TaSTP3 OE的叶片中的蔗糖含量显著增加(图4a),而TaSTP3RNAi小麦植物的叶片中蔗糖含量明显减少(图S14)。在过表达和RNAi小麦植株中,葡萄糖和果糖含量都在一定程度上降低(图4a,S14)。值得注意的是,转基因过表达植物叶片中的总糖浓度增加(图4a)。TaSTP3 OE植物在受到Pst攻击时也表现出较少的细胞死亡和ROS积累(图S13a-c)。
为了更好地了解糖积累的增加是如何导致转基因过表达系中宿主免疫力减弱的,我们对Fielder和TaSTP3 OE-22幼苗的未感染叶片进行了RNA序列分析。在TaSTP3过度表达下,共鉴定出1332个差异上调基因和1388个差异下调基因(图4b)。使用R包中的clusterProfiler对这些差异表达基因(DEG)进行的GO富集分析表明,在下调的DEG中,NB ARC、抗氧化酶和纤维素合成酶等防御相关基因富集(图4c)。为了确认RNA序列数据的可靠性,选择上述6个DEG进行RT-qPCR评估。结果表明,这六个基因的表达模式与RNA序列数据中的相应模式相匹配(图4d-i)。有趣的是,这些防御相关基因的启动子被发现含有糖响应元件(SRE)(图4j),这表明这些基因表达的变化可能与TaSTP3 OE植物中糖积累的增加有关。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
3.7 TaSTP3被TaWRKY19/61/82转录激活
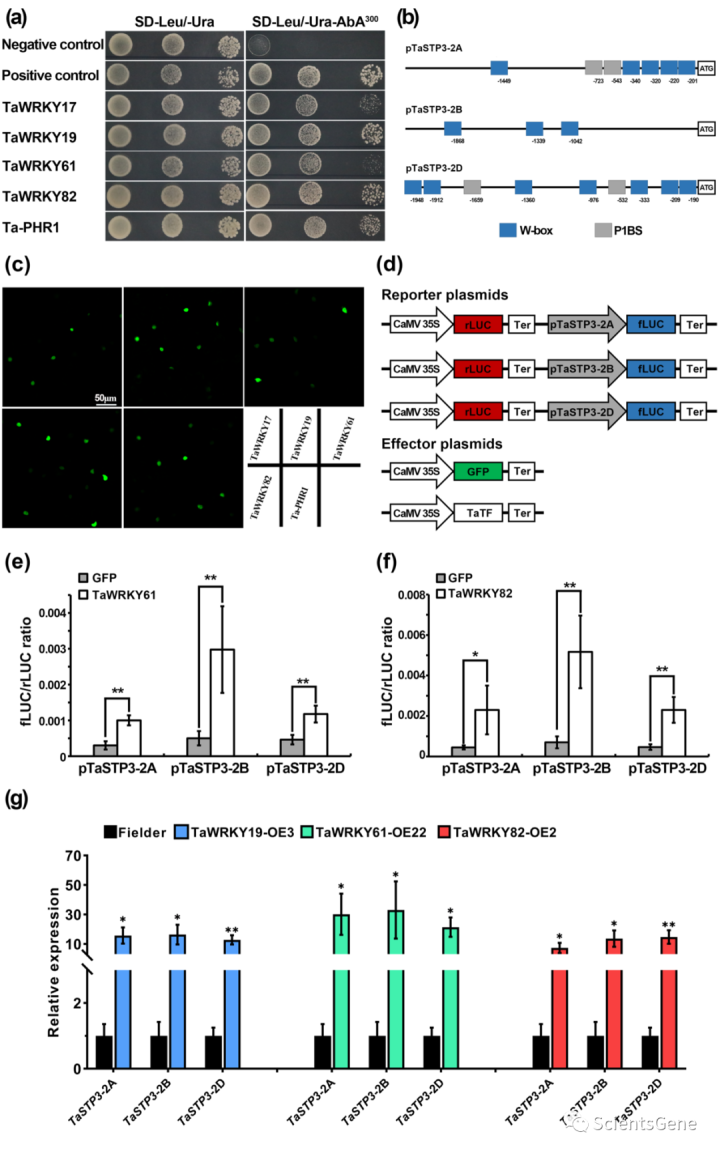
为了研究TaSTP3的转录调控,我们使用预测的TaSTP3-2A起始密码子上游的2.0kb启动子区作为“DNA诱饵”,筛选了由Pst感染的小麦叶片产生的Y1H文库。Y1H分析确定了五种蛋白质作为通过Y1H分析与TaSTP3-2A启动子结合的候选蛋白(图5a)。在这些潜在候选蛋白中,有四种是I组WRKY超家族的成员,通常包含两个WRKY结构域(TaWRKY17、TaWRKY19、TaWRKY61和TaWRKY82)和一个MYB DNA结合结构域蛋白Ta-PHR1。与Y1H确定的TF结合位点一致,TaSTP3的三个亚基因组拷贝中的两个的2-kb启动子区域携带W-box(TTGAC)和P1BS(GNATNC)顺式作用元件(图5b)。
使用融合到烟草叶中瞬时表达的GFP的上述TF的编码序列进行亚细胞定位分析表明,可以在烟草叶表皮细胞的细胞核中检测到荧光信号(图5c),支持这些蛋白作为TF的功能。
为了进一步评估这五种TF对转录调控的影响,我们使用双荧光素酶(LUC)报告系统进行了瞬时表达分析。每个启动子构建体包含两个荧光素酶盒,CaMV35S启动子驱动的Renilla荧光素素酶基因(rLUC)作为内部对照,以及由TaSTP3启动子(pTaSTP3-2A、pTaSTP4-2B和pTaSTP2-2D)驱动的萤火虫荧光素酶基因(fLUC),作为报告子。表达GFP或由CaMV35S驱动的五种TF的质粒用作效应剂(图5d)。报告质粒和效应质粒的共表达表明,与对照(GFP)相比,TaWRKY61和TaWRKY 82具有更高的fLUC/rLUC比率(图5e,f)。然而,除了TaWRKY17对TaSTP3-2D的相对弱但显著的激活外,其余三种TF对TaSTP2的转录调节的影响可忽略不计(图S15a-c)。这些结果表明TaWRKY61和TaWRKY 82可能能够在植物中转录激活TaSTP3。
此外,为了确认小麦中五个候选TF对TaSTP3转录调控的模式,我们产生了两个独立的T2转基因小麦系,它们过表达TaWRKY17、TaWRKY19、TaWRKY61、TaWRK182或Ta-PHR1(图S15d,f)。与烟草瞬时表达测定结果一致,TaWRKY61或TaWRKY82的过度表达导致TaSTP3表达显著增加(图5g、S15e),而TaWRKY17和Ta-PHR1对TaSTP3的转录没有可检测的影响(图S15g)。有趣的是,在TaWRKY19过表达下,TaSTP3也强烈上调(图5g,S15e),这表明小麦中TaWRKY19的调控机制与烟草中不同。因此,我们的结果表明,TaWRKY19、TaWRKY61和TaWRKY82可以结合TaSTP3的启动子区并上调其在小麦中的表达。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
3.8 TaWRKY19/61/82通过调节TaSTP3促进小麦对Pst的敏感性
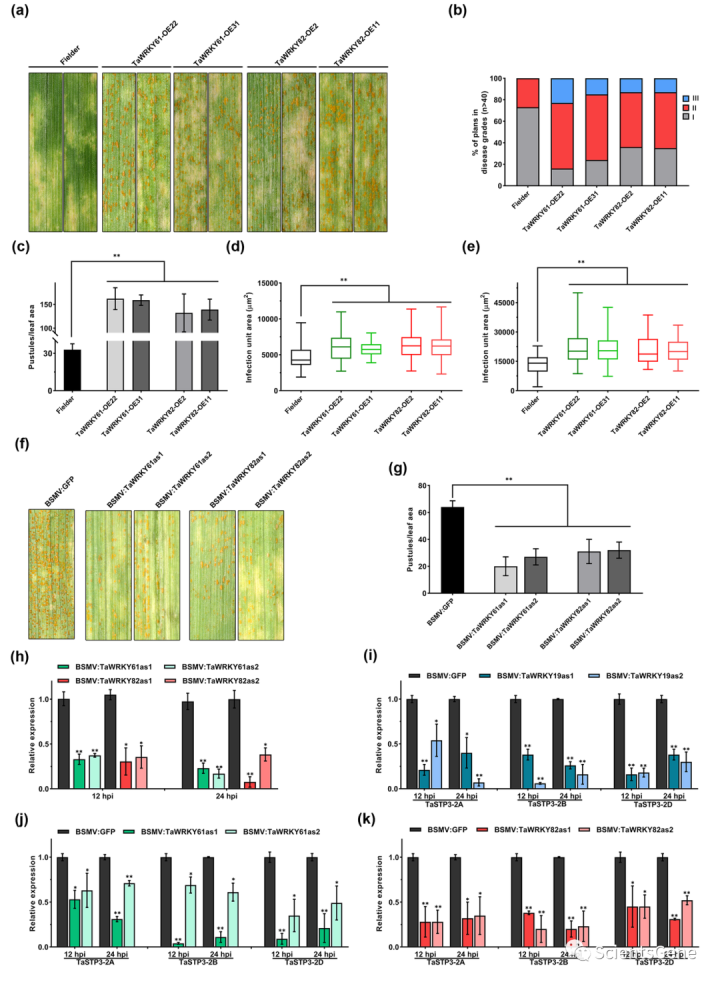
为了确定TaWRKY19/61/82在小麦Pst相互作用中的作用,我们接下来用Pst CYR23接种三个转基因TF过表达系。结果表明,在TaWRKY19、TaWRKY61或TaWRKY 82过表达下,小麦对Pst的敏感性增强(图6a、S16a)。因此,我们还观察到,与对照植物相比,发病严重程度得分更高(图6b、S16b),病情指数也显著增加(图6c、S16c)。
此外,在组织学分析中,在96和120 hpi时,菌丝定殖面积大于对照植物(图6d、e、S16d和e)。我们随后使用BSMVVIGS研究了TaWRKY19/61/82的功能。结果表明,单独沉默三个TF可降低小麦对Pst感染的敏感性(图6f、S16f)。RT-qPCR分析证实三个TF被有效沉默(图6h、S16h)。值得注意的是,与BSMV:GFP对照植物相比,VIGS植物中TaSTP3表达下调(图6i–k)。组织学观察还显示,VIGS植物在72和120 hpi时真菌发育受限(图S17a,b)。总之,这些结果表明,TaWRKY19/61/82通过调节TaSTP3表达参与了确定小麦对Pst的敏感性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
04
结论
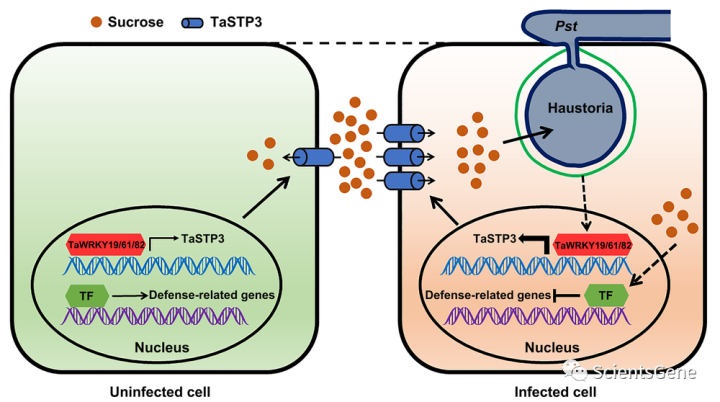
我们的结果为小麦Pst相互作用过程中糖重新分配的分子调控提供了新的见解。在Pst感染期间,TaSTP3,一种质膜定位的STP家族己糖和蔗糖转运蛋白,被TaWRKY19/61/82转录激活,以刺激质外体蔗糖进入Pst侵入的宿主细胞,从而增加病原体的糖利用率(图7)。此外,糖积累的增加触发了防御相关基因的转录抑制,进一步促进了Pst定殖(图7)。需要进一步的工作来确定Pst操纵TaWRKY19/61/82表达或活性的潜在机制。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 7
05
获取原文
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18331
PDF获取:
https://www.scientsgene.com/h-nd-115.html#_np=107_423
文末附件。
赛思基因www.scientsgene.com致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
赛思基因可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。










![[附源码]计算机毕业设计springboot课室预约系统](https://img-blog.csdnimg.cn/2237d3eec6c243ea81843afe77282265.png)