文章信息
题目:The red flesh of kiwifruit is differentially controlled by specific activation–repression systems
刊名:New Phytologist
作者:Wen-qiu Wang,Andrew C. Allan,Xue-ren Yin et al
单位:Zhejiang University
日期:29 March 2022
01
摘要
花青素是授粉和种子传播的视觉线索。含有花青素的水果也因其外观和健康益处而吸引消费者。在猕猴桃(猕猴桃属)中,研究已经确定了至少两种花青素 MYB 激活剂,但它们在水果中的功能以及它们的作用机制尚不完全清楚。
在这里,转录组和小 RNA 高通量测序被用于全面鉴定猕猴桃中花青素积累的贡献者。
在葡萄藤中稳定的过表达表明,35S::MYB10和MYB110都可以上调猕猴桃果实中花青素的生物合成,并且MYB10的过表达导致花青素积累仅限于内果皮,表明抑制机制是该物种花青素生物合成的基础。此外,MYB10/110的 C 末端区域中的基序被证明与花青素反应的激活强度有关。瞬时分析表明MYB10和MYB110 均不被 miRNA 直接切割,但 miR828 及其定相小 RNA AcTAS4-D4(-) 有效靶向MYB110。鉴定了在内果皮和外果皮之间差异表达的其他miRNA,并观察到SPL13、ARF16、SCL6和F-box1的切割,这些都是MYB10的阻遏物。
我们得出结论,是 MYB 激活剂的差异表达和随后的抑制导致猕猴桃物种中花青素积累的变化。
02
技术路线
Hongyang’ (Actinidia chinensis) kiwifruit at colour change stage
Kiwifruit and Nicotiana benthamiana total RNA extraction
First-Strand cDNA synthesis and RT-qPCR (Real-Time Quantitative PCR)
High-throughput sequencing and analysis
Kiwifruit stable transformation
Genome synteny and collinearity Analysis
Isolation and cloning of candidate genes and MIRNAs
Transient over-expression in Nicotiana tabacum and Nicotiana benthamiana plants
Dual-luciferase assays
Anthocyanin extraction and quantification
Firefly luciferase complementation imaging assay (LCI)
03
主要结果
3.1 红阳猕猴桃花色素苷代谢关键基因的鉴定
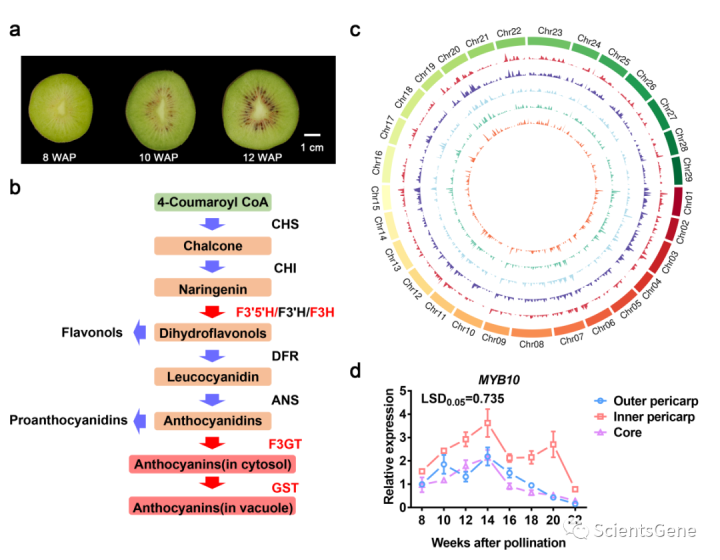
授粉10周后,花青素在“红阳”果实的内果皮中明显积累(图1a)。通过RNA高通量测序,以探索基于高质量参考基因组(Red5)的关键基因。根据先前的研究总结了编码生物合成酶的花青素相关基因(图1b,补充表S6)。进一步的分析表明,F3H1、F3H2、F3’5'H、F3GT1和GST1与发育系列和差异组织中花青素积累的视觉观察结果呈正相关(图1a,补充图S1)。
我们根据共表达基因的表达模式(R≥0.6,图1c),以及它们在猕猴桃基因组中的位置。从该分析中,我们发现279个基因与所有这五个花青素相关基因共表达(补充图S2a,b;补充表S2)。这些基因在发育和空间上都受到调控,在内果皮中高度表达,表明受转录调控。
PlantTFDB(植物转录因子数据库)用于分析279个基因,其中17个被预测为转录因子,包括NAC、AP2、MADS和MYB(补充图S3a、b;补充表S2)。所有转录因子都被克隆,并在烟草叶中瞬时过表达。17种TF与花青素积累相关,但只有MYB10激活了烟草中的花青素水平。使用MYB110作为对照,其具有比MYB10更强的激活作用(补充图S4)。然而,其他16种TF中没有一种有助于MYB10活性(补充图S5),事实上有三种是强阻遏物(Acc23145/HSFB3、Acc25983/C2H2-82和Acc29865/MYB223)。共表达分析的预测包括MYB10,实时定量PCR(RT-qPCR)证实了这一点,该PCR显示MYB110的转录水平在整个果实发育过程中在内果皮中较高(图1d)。因此,转录组和瞬时分析支持MYB10在“红阳”水果着色中的重要性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
3.2 猕猴桃中MYB10和MYB110的过度表达揭示了不同的功能
猕猴桃(品种A.chinensis cv.Hort16A)中35S::MYB10和35S::MYB110的稳定过表达增加了叶片中的花青素含量。尽管在“红阳”中未检测到MYB110,但基于RNA seq或RT-qPCR(补充图S6a,b),我们的结果表明,MYB10和MYB11在过度表达时,都会产生积累花青素的果实(图2)。对照品系保留黄色果肉,类似于果园种植的“Hort16A”果实。
MYB10过表达植物的果实在内部果皮中积累花青素(图2),尽管MYB110由组成型35S启动子驱动。RT-qPCR用于比较外果皮和内果皮之间的转录水平,这表明转基因在整个果实中表达良好,但在内果皮中表达稍高(补充图S7)。因此,这些MYB10过度表达的水果现象复制了“红阳”水果的自然外观。相比之下,MYB110过表达系在果肉和皮肤的所有区域都积累了花青素(图2),这反映出了黑木耳和黑木耳的红色肉质选择,其中MYB10已被观察到表达。RT-qPCR显示MYB110在外果皮和内果皮中组成性表达(补充图S7)。因此,MYB10和MYB110似乎足以激活猕猴桃属植物的花青素。MYB10和MYB110在果实中过度表达时的表型表明,潜在的阻遏物控制花青素合成和最终外观。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
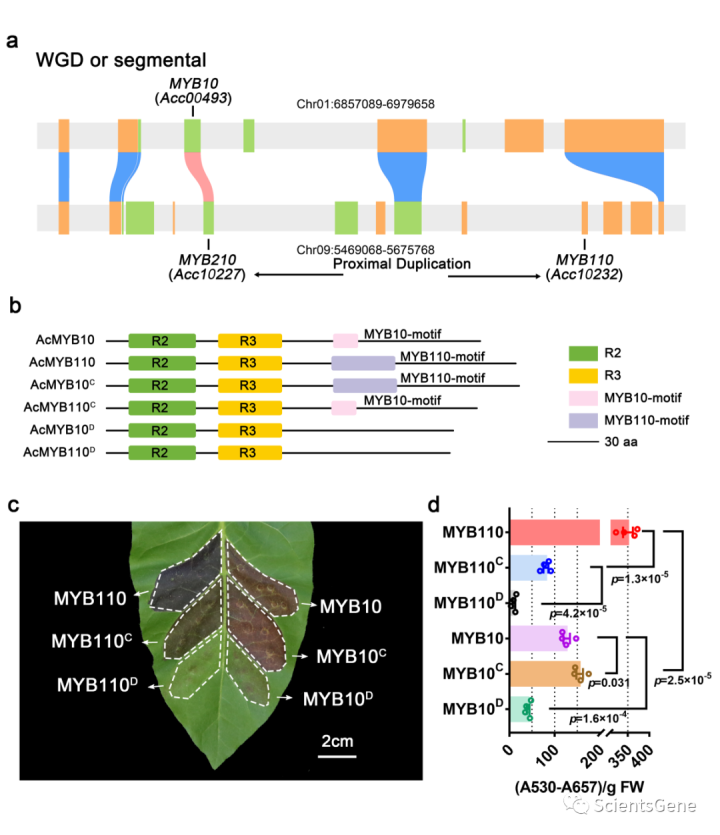
3.3 猕猴桃中MYB10和MYB110的进化分析揭示了激活花青素生物合成的关键基序
系统发育分析表明,MYB10和MYB110是同源基因,它们与另一个MYB(Acc10227)聚集成一个亚组(补充图S8)。Acc10227(MYB210)已在猕猴桃杂交种群中鉴定,与MYB110紧密相关。这些结果暗示了一种潜在的遗传关系。MCscanX用于检测猕猴桃基因组中是否存在共线性。有趣的是,分析显示,在一个分别含有MYB10和MYB110/210的区域,Chr01:6720929-9462208和Chr09:5346916-7131334显示了大规模连锁(图3a)。微合成图显示MYB110和MYB210位于Chr09:5346916-7131334上,紧密连接但不直接连接。分析表明MYB10和MYB210是直接共线的。此外,MYB110和MYB210更可能是近端重复的产物。MYB10和MYB110在不同的猕猴桃中表达,它们在进化过程中趋向于亚功能化(导致不同的红色果实表型);MYB210在花瓣、肉或其他组织中未检测到,因此可能没有功能。
对MYB10和MYB110蛋白序列的比较显示了C末端区域的差异(图3b)。MYB10和MYB110都含有一个非常相似的R2R3结构域,以及一组C端残基,分别称为MYB11基序和MYB110基序(图3b)。为了测试这些MYB10-或MYB110基序是否影响花青素诱导的效率,我们交换了基序或将其从编码序列中删除(图3b)。瞬时分析表明,MYB110基序可以增加MYB10的花青素积累水平(MYB10C,图3c,d),而携带MYB12基序的MYB11在花青素诱导方面表现出显著损失(MYB110C,图3c,d)。此外,当C端基序缺失(MYB110D和MYB10D)时,渗透导致花青素诱导很少(图3c,d)。因此,MYB10/110的C末端的基序被显示为影响花青素产生的强度。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig.3
3.4 “红阳”果实抑制性转录过程的鉴定
尽管MYB10在整个果实中都有表达,但过表达MYB110的果实的色素沉着模式与“红阳”果实表现出相似的外观。这表明,由MYB10表达驱动的花青素积累进一步受到抑制机制的影响,这种抑制机制在外果皮中表现得更强。此外,MYB110在“红阳”果实中不表达。因此,分析了MYB10和MYB110的潜在阻遏物。
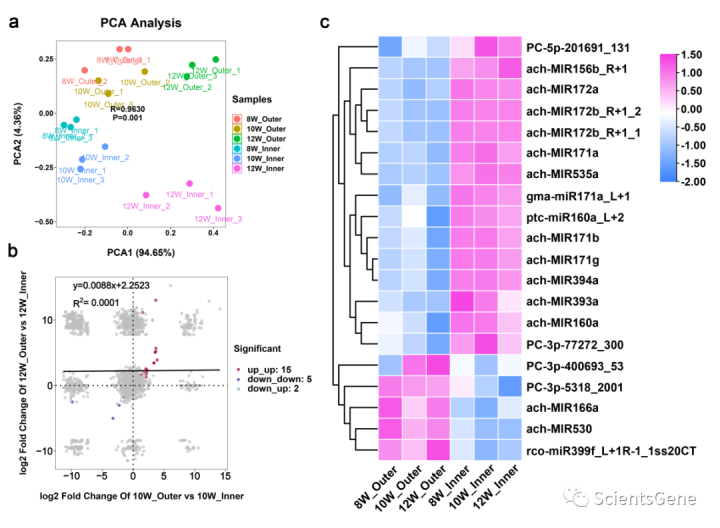
进行小RNA测序以检测“红阳”果肉中表达的miRNA。发现了近2800个具有潜在前体的成熟miRNA。主成分分析(PCA)表明,内果皮和外果皮在PCA2维度上有区别(图4a)。共表达分析显示,授粉后10周和12周(WAP),当比较外果皮和内果皮中的miRNA水平时,15个miRNA上调,5个下调(图4b,c;补充表S7)。然而,预测分析(使用psRobot软件)表明,这些不同表达的miRNA不能直接切割MYB10或MYB110。发现MYB11和MYB12与AtMYB75(AtPAP1)和AtMYB90(PAP2)同源,已证明其受相iRNA AtTAS4-siR81(-)调控。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
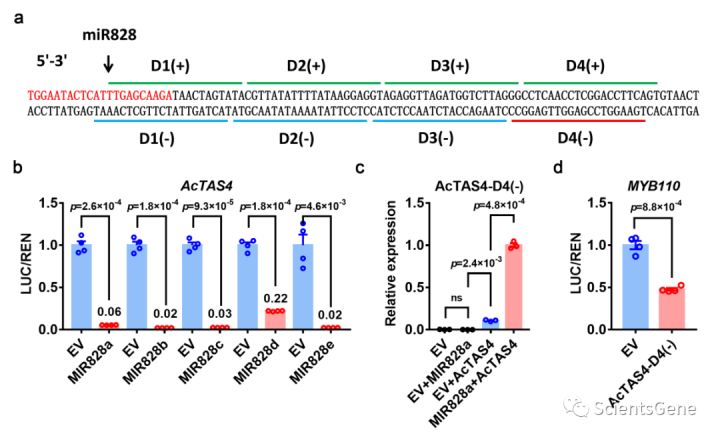
在小RNA测序数据中发现了一种类似于AtTAS4-siR81(-)的小RNA,具有四个核苷酸差异(补充图S10a)。该推测的小RNA被预测与MYB110(补充图S10b)有效结合,但与MYB1 0无效。推测的小RNA位于Chr05:14577221-14577201上,然后延伸300 bp至侧翼区域,其中发现了miR828靶位点(图5a)。在该区域发现了大量的小RNA,这观察到了阶段RNA的生成规律(补充图S11)。因此,我们将该区域视为AtTAS4的同源基因座,它包含位于D4(-)区域的假定小RNA,我们称其为AcTAS4-D4(-)。检测到五种潜在的miR828前体(称为MIR828a-e),其中两种类型的成熟miR826是由这些前体产生的。miRNA活性的双荧光素酶分析支持这五种前体产生成熟的miRNA(miR858a至e),随后切割AcTAS4(图5b)。
将含有MIR828a、AcTAS4和MIR829a+AcTAS44的农杆菌渗透到本氏菌叶片中。RT-qPCR检测叶片中phasiRNA的生成;当用空载体或MIR828a注射时,在烟叶中不能检测到AcTAS4-D4(-)。然而,当MIR828a和AcTAS4的混合物被渗透时,AcTAS4-D4(-)的丰度显著增加。单独渗透的AcTAS4也会导致AcTAS4-D4(-)出现,这可能由内源性烟草miR828触发(图5c)。此外,miRNA双荧光素酶分析进一步显示AcTAS4-D4(-)可以有效切割MYB110(图5d)。MYB10和MYB110是拟南芥亚群S6 MYB的同源物。在先前的研究中,AtMYB75(AtPAP1)、AtMYB 90(AtPAP2)和AtMYB113被预测受AtTAS4-siR81(-)调控。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
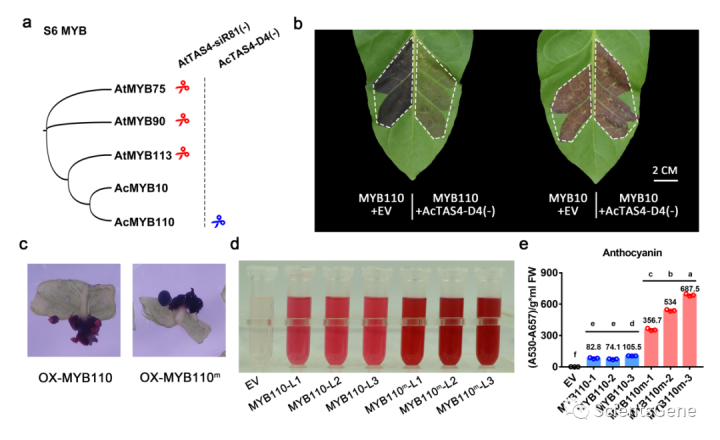
在猕猴桃中,MYB110被TAS4位点产生的phasiRNA切割,尽管与拟南芥有一些核苷酸差异(图6a)。然而,分析表明MYB10将逃脱AcTAS4-D4(-)和AtTAS4-siR81(-)的切割(图6a)。当与AcTAS4-D4(-)共渗透时,MYB110的花青素诱导活性显著降低(图6b;补充图S12a),但对MYB10驱动的花青苷积累没有影响(图6a;补充图S2b)。当MYB110中AcTAS4-D4(-)的靶位点突变时,在不改变氨基酸序列的情况下(补充图S13),它不再受AcTAS4-D4(-1)的调控。过度表达结果表明,MYB110在猕猴桃中产生暗红色愈伤组织,而MYB110m产生黑色愈伤组织(图6c)。MYB110m愈伤组织中的花青素积累量是MYB110的三到六倍(图6d和e),虽然呈黑色,但提取时呈深红色。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
3.5 miRNA靶向介导的miRNA对MYB10的抑制
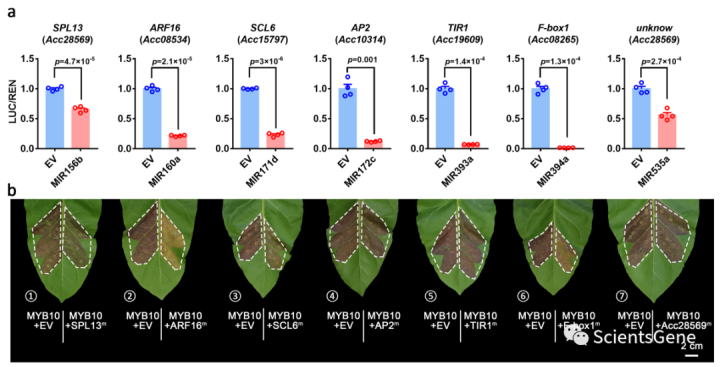
由于MYB10不受表达的miRNA或AcTAS4-D4(-)直接调控,我们研究了可能影响MYB12活性的其他抑制机制。研究了涉及miRNA的其他靶点的间接调控。根据我们的目标预测(通过psRobot软件),每个miRNA通常针对一类特定的基因,其中许多是转录因子(补充表S3)。这些转录因子包括SQUAMOSA启动子结合蛋白样(SPL)、生长素应答因子(ARF)、SCL和APETALA2(AP2)。为每个miRNA选择一个有代表性的靶基因,然后进行miRNA双荧光素酶测定,以确定这些基因是否被相应的miRNA直接抑制。
实验证实所有靶转录因子都被相应的差异表达miRNA(DEmiRNA;图7a)切割。为了测试DEmiRNA对花青素积累的间接调节,在miRNA结合位点突变所有靶基因(氨基酸序列未改变),以防止由同源内源性烟草miRNA驱动的任何影响(补充图S14)。
使用这些突变的TF构建体,进行显色瞬时分析,以评估靶点对MYB10的抑制作用。显色分析清楚地表明SPL13(Acc29651;或SQBP28)、ARF16(Acc08534)、SCL6(Acc15797;或GRAS76)和F-box1(Acc08265)可有效抑制MYB12(图7b;补充图S15)。其中,ARF16和F-box1的效果最为显著,而SPL13和SCL6可以将花青素积累减少到40-50%(图7b;补充图S15)。这些结果表明,一组抑制性转录因子本身是miRNAs的靶标,可以介导MYB10蛋白活性的抑制,并可能在果实外果皮中起作用。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 7
3.6 miRNA靶向抑制MYB10是通过MBW转录复合物中MYB110的竞争实现的
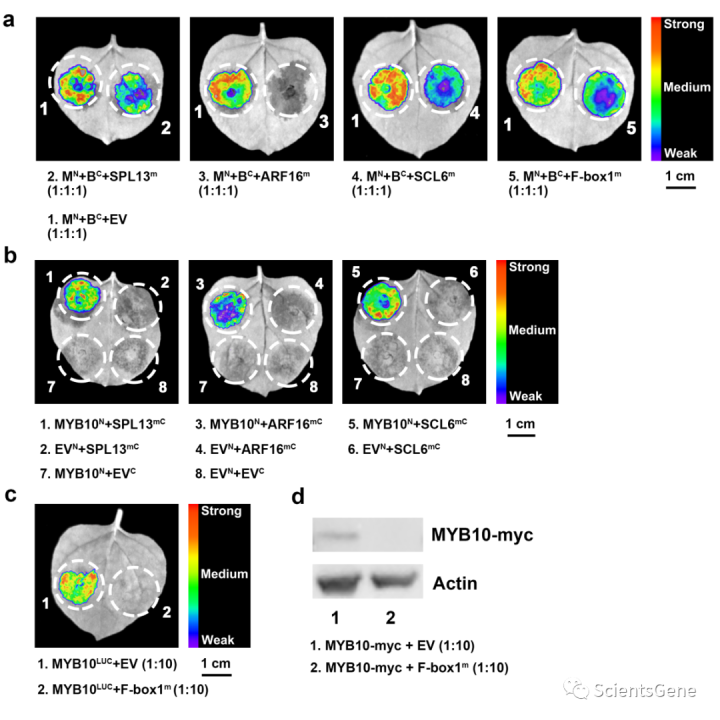
从烟草中花青素积累的结果来看,一组miRNA靶点通过抑制MYB10蛋白影响花青素的积累。亚群6分支的MYB通过形成MYB-bHLH-WD40复合物控制花青素生物合成。因此,进行荧光素酶测定以测试miRNA靶点是否改变MBW复合物。荧光素酶的C端(CLUC)或-N端(NLUC)与靶蛋白或MBW复合物的成员融合。正如预期的那样,SPL13(Acc29651)、ARF16(Acc08534)、SCL6(Acc15797)和F-box1(Acc08265)的过度表达显著降低了MYB10和bHLH5的相互作用(猕猴桃bHLH4,Acc19563;图8a)。四种最强的抑制因子中有三种是转录因子SPL13、ARF16和SCL6。
此外,萤火虫荧光素酶互补分析支持SPL13,ARF16及SCL6可以结合MYB10蛋白形成蛋白-蛋白复合物(图8b)。因此,似乎miRNA靶点SPL13、ARF16和SCL6可以通过与MBW复合物竞争MYB10来抑制花青素积累。F-box1(Acc08265)蛋白被注释为属于E3泛素连接酶家族的蛋白质,其参与蛋白质降解。F-box1能够减少由MYB10驱动的花青素积累并干扰MBW复合物(图7b,8a)。
此外,F-box1的过度表达导致MYB10-LUC融合蛋白的荧光素酶活性降低(图8c)和MYB10蛋白降解(图8d)。这些结果表明,F-box1通过泛素化途径直接靶向MYB10蛋白降解。因此,miRNA靶点F-box1也可以通过蛋白质转换影响MYB10。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 8
04
结论
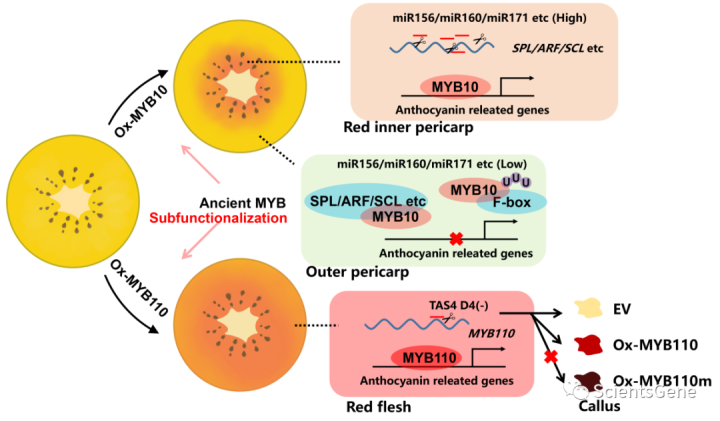
猕猴桃果肉中花青素的外观由两种MYB激活剂MYB10(红色内果皮)和MYB110(红色全果肉)确定(图9)。MYB10和MYB110可能起源于祖先的MYB,在基因复制后具有亚功能化。蛋白质C末端的两个关键基序被表征并直接影响MYB活性的强度。MYB110被小RNA AcTAS4-D4(-)直接切割,由miR828触发。MYB10被miRNA的基因靶标广泛抑制,这些miRNA在外果皮中的表达低于内果皮,导致MYB11抑制。这项研究揭示了猕猴桃色素沉着的激活抑制系统。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 9
05
获取原文
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18122
PDF获取:
https://www.scientsgene.com/h-nd-116.html#_np=107_423
文末附件.
赛思基因www.scientsgene.com致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
赛思基因可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。





![[附源码]计算机毕业设计springboot快转二手品牌包在线交易系统](https://img-blog.csdnimg.cn/ddf0258afbf942b89b2468ef992f118b.png)