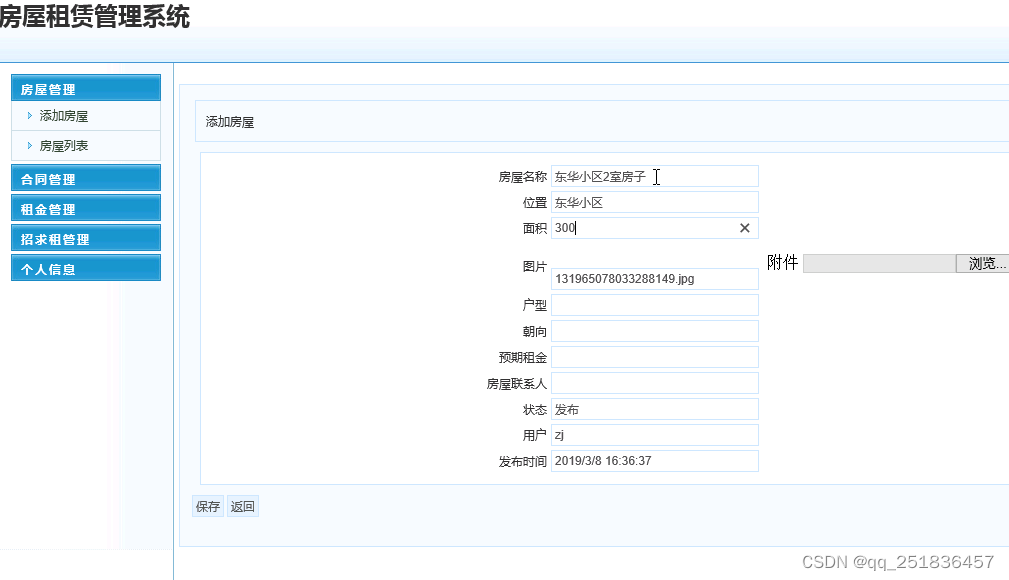
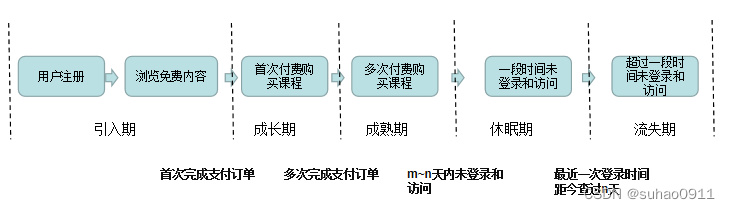
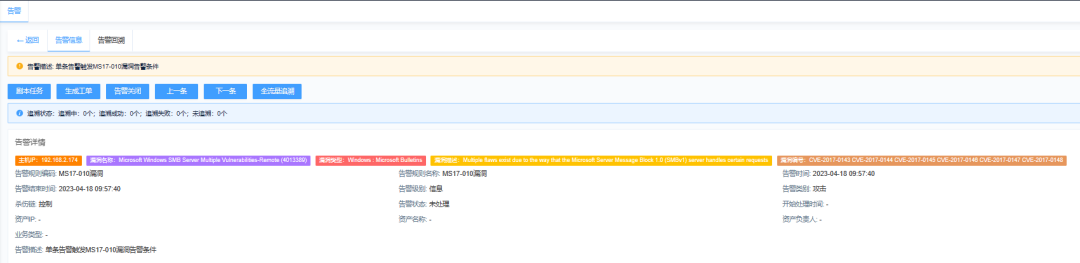
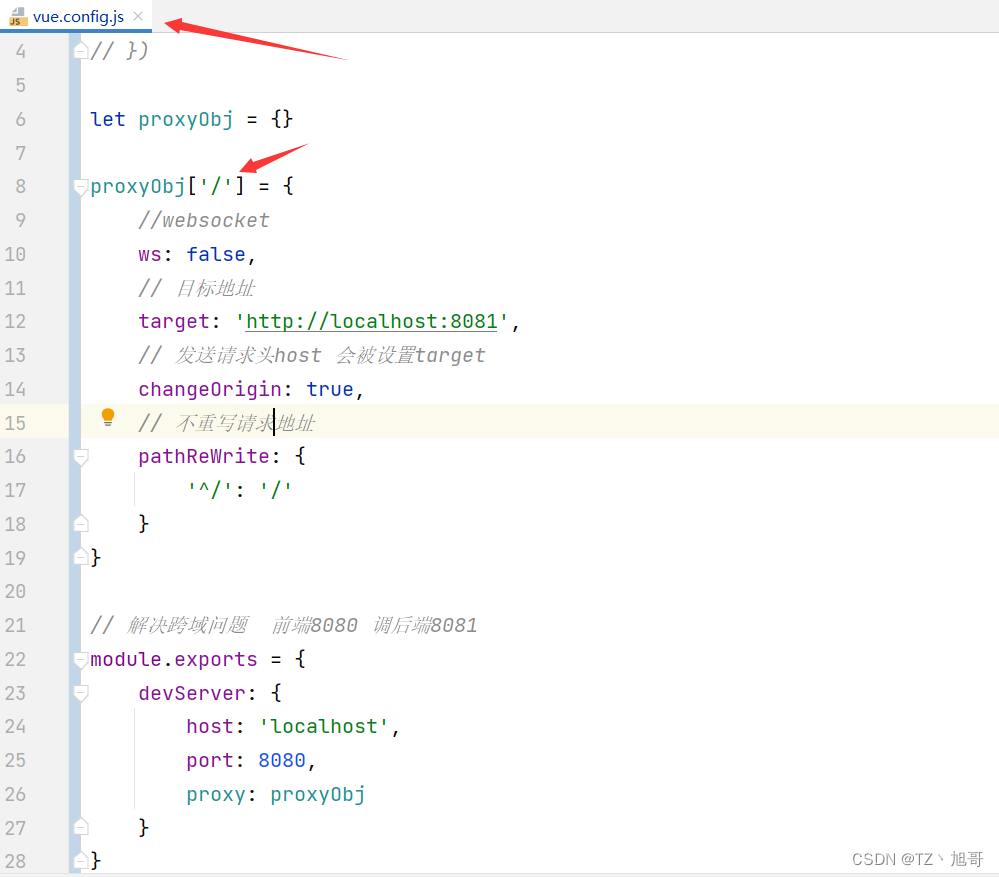
2023年4月13日,弗雷德·哈钦森癌症中心的微生物学家Susan Bullman教授在《Cell》杂志发表了关于肿瘤内微生物群的评论。

微生物群是肿瘤微环境的一个组成部分
在患者的肿瘤内部,恶性细胞处在一个复杂的生态系统中,周围是正常细胞的网络,包括成纤维细胞、内皮细胞和免疫细胞等。除了这些细胞成分外,还有证据表明细菌群落也是肿瘤微环境(TME)的一个组成部分。每个组成部分都对肿瘤生态系统贡献了力量,它们之间的相互作用可以直接或间接地影响癌症进展和患者对治疗的反应。
肿瘤中具有活性代谢的原核细胞一直深藏不露,直到最近才被揭示。随着下一代测序方法和计算工具的广泛应用,通过从现有的人类测序数据中分析微生物数据,揭示了微生物在一系列实体肿瘤中普遍存在。这些发现最初受到科学界的怀疑,尤其是当人类肿瘤组织被认为是无菌场所时。然而,随着时间的推移,先进的工具和技术提供了对TME细胞成分更高分辨率的图像,为人类肿瘤内存在微生物群落提供支持。不同癌症类型之间的微生物丰度和物种组成存在巨大差异。甚至在同一个体肿瘤内部也存在区域性差异,这反映了在人类肿瘤组织这个复杂生态系统内微生物群落组成、丰度和分布具有异质性。
肿瘤内微生物群落与癌细胞:一种互惠关系?
在肿瘤生态位内部,癌细胞和细菌细胞都有一个共同的利益:生存。例如,它们都需要逃避免疫系统,它们都具备在压力下限制生长和代谢的能力,它们都有在机会出现时迁移或扩散到新的适合生存的生态位的能力。作者观察到随着结直肠癌(CRC)转移到肝脏,微生物群落成员的持久存在,这为两者具备共同利益的观点提供了支持。此外,作者曾经从患者的原发肿瘤和远端转移瘤(两者的切除相隔多年)中培养出相同的Fusobacterium菌株。
另一个问题:如果考虑TME内的群落动态,那么免疫细胞和癌细胞以及细菌细胞之间存在着捕食-被捕食的关系。癌细胞和细菌细胞的生存需要逃避或规避免疫细胞。癌细胞和细菌细胞是否共同努力实现这一目标?或者,一个是否因另一个的存在而获得生态适应优势?肿瘤内的细菌和癌细胞是否存在共生关系?
如果存在共生关系,那么靶向细菌应该会影响癌细胞的生存。之前的研究表明:利用抗生素处理F. nucleatum阳性患者来源的异种移植瘤减缓结直肠肿瘤的生长和癌细胞增殖。随后在筛选与结直肠癌相关的这种细菌的窄谱抑制剂时,发现结直肠癌的一线癌症治疗药物5-氟尿嘧啶对这种细菌具有很强的生长抑制作用。这引出了一个问题,即患者对这种化疗药物的反应在一定程度上是否可能是由于其对这种与结肠直肠癌相关的细菌的抗微生物活性所致。但为了满足互惠共生的定义,这些微生物在这些微环境中的存活也应该依赖于癌细胞的存在。F. nucleatum在口腔中很常见,与牙周病有关,但在下消化道微生物群落中是罕见菌。然而,在结肠直肠癌中,这种细菌一直是肿瘤内微生物群落的优势菌群。大于50%的未经治疗的结肠直肠癌中均可分离出这种细菌,在某些个体肿瘤中其相对丰度>80%。简而言之,它在下消化道的寄生与结肠直肠癌的存在很强的相关性,这也暗示着这个微环境内存在着互惠共生关系。
另一种可能是,肿瘤内细菌和癌细胞存在一种条件互惠共生的关系。这种情况下,它们将共存并从它们的关系中获得好处,但它们也可以互相独立生存。例如,研究表明,F. nucleatum的Fap2粘附蛋白可以结合天然杀伤细胞(NK细胞)的TIGIT结构域,防止肿瘤上皮细胞被杀死。这种细菌-免疫细胞结合将便于邻近癌细胞发生免疫逃逸。当然,癌细胞也可以通过癌上皮和抗原呈递细胞表达的CD155和CD112结合TIGIT而幸免于NK细胞的杀伤,此时其生存不依赖于细菌,该研究案例支持条件互惠共生的关系。另一个例子是伽马变形菌属(Gammaproteobacteria)能够将化疗药物吉西他滨(gemcitabine)代谢令使其失活。在胰腺导管腺癌模型中,已经证明这种微生物药物相互作用可以促进癌细胞的生存,表明了癌细胞与Gammaproteobacteria在TME中共存的好处。然而,如果癌细胞已经在核苷酸代谢酶或凋亡通路中发生了基因突变,它们可能不依赖于Gammaproteobacteria细菌来抵抗化疗药物。
与任何生态系统类似,在肿瘤微环境中,细菌与癌细胞之间的关系存在很多可能性,这些关系可能会受到生态系统时间和空间特征的影响。从治疗角度来看,理解可以为癌细胞提供生态适应优势的关系将特别重要。除了互惠共生之外,这还包括共生关系,其中一个生物体将受益,但另一个生物体既不会受益也不会受害。最初发现肿瘤内细菌时,研究工作旨在确定特定的微生物是否可以为癌细胞提供适应优势,或者它们只是TME内的旁观者。例如,研究小组表明,微生物群落中的特定成员可以促进癌细胞增殖,并诱导自噬介导的化疗耐药性,从而满足了共生关系定义的一半。然而,要满足定义的另一半,细菌细胞不应受到癌细胞的帮助或伤害。这种关系很可能取决于细菌分类。再以F. nucleatum和CRC为例,已经证明癌细胞通过提高多糖Gal-GalNAc(Fap2的结合位点)的水平促进F. nucleatum在肿瘤内的富集。至少在F. nucleatum和CRC的情况下,这并不构成严格的共生关系。最终,需要进一步研究肿瘤微环境中细菌微生物群落与肿瘤的不同细胞组分之间的相互作用,以增强我们对TME的理解。

肿瘤内微生物丰度是否重要?
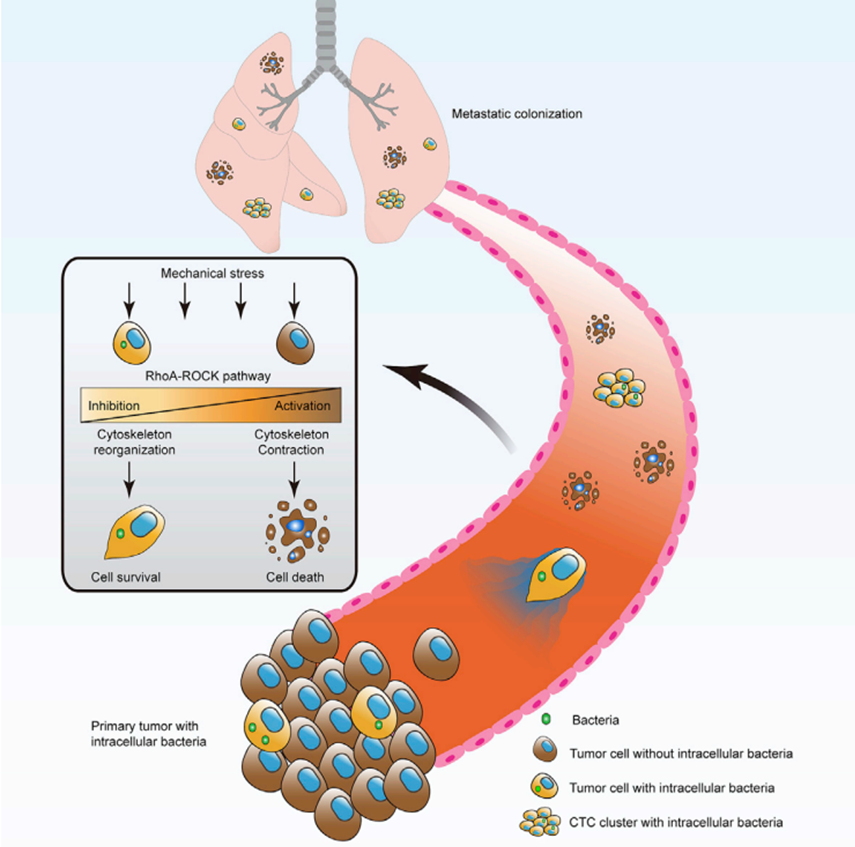
在癌细胞和肿瘤内细菌之间的互惠关系中,这种有益关系是否仅适用于彼此直接相邻的细胞?这引发了更多关于微生物丰度在塑造TME内这些相互作用中的重要性的问题。目前仍不清楚为什么肿瘤内菌群驻留在特定的肿瘤区域以及是什么决定或限制了它们在TME内和癌症类型之间的定殖和生长。首先,考虑微生物丰度相对较高的癌症类型,特别是从口腔到结肠直肠的肠道癌症。在这些癌症类型中,肿瘤组织内存在密集的侵袭性细菌群落,在特定的肿瘤区域中,细菌数量可以超过人类细胞。这些组织的蛋白质和基因组空间分析证实了这些微生物微生态区域与组织中无细菌区域相比具有功能异质性。从微小的肿瘤组织块中可以培养出丰富的细菌。然而,要严格研究微生物丰度较低的癌症类型则更具挑战性。当微生物丰度较低时,细菌污染的影响更大。获取具有培养和空间分析所需的足够细菌的组织生物量更加困难。虽然微生物可能丰度很低,但这并不否定它们影响TME的潜力。这类似于癌细胞的休眠状态,其中少量的癌细胞可以促进癌症复发和转移。乳腺癌模型证明,即使是单细胞内的细菌也可以通过改变其细胞骨架来促进循环肿瘤细胞的存活,从而促进转移。通过对具有高微生物丰度的癌症进行单细胞RNA测序表明,细胞相关的细菌可以在单细胞水平上促进异质性,上调与癌症进展相关的通路。
结论
将“多态微生物群落”添加到癌症基本特征之一中反映了对肿瘤生态系统内微生物与癌细胞相互作用日益增长的认识。虽然本文关注于肿瘤内微生物群落中的细菌,但也有越来越多的证据表明在固体癌症类型中存在肿瘤内真菌群落,这进一步增加了肿瘤微环境的复杂性。总的来说,癌细胞和微生物之间的互惠关系将意味着这两个细胞组分都会获得双赢。肿瘤内微生物群落可以为癌细胞提供益处,细菌也能从这些相互作用中受益,使它们能够在肿瘤微环境中存活并持久存在。如果是这样,互惠共生将是肿瘤内微生物和其相邻的癌细胞之间的主导关系。任何使癌细胞因细菌存在而受益的关系都可以在治疗上得到利用。这些肿瘤的微生物组分是可塑的:它们可以被修改或操纵,将会为癌症患者开辟新的治疗途径。
阅读原文内容:
https://www.cell.com/cell/fulltext/S0092-8674(23)00272-6?rss=yes
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习
后台回复“生信宝典福利第一波”或点击阅读原文获取教程合集