国自然已经放榜许久,【免疫】和【m6A】(N6-甲基腺苷)再次成为热门研究主题。m6A作为真核生物mRNA的主要表观遗传修饰之一,它通过调控mRNA的稳定性、剪接、运输和翻译等过程,进而影响基因的表达[1]。
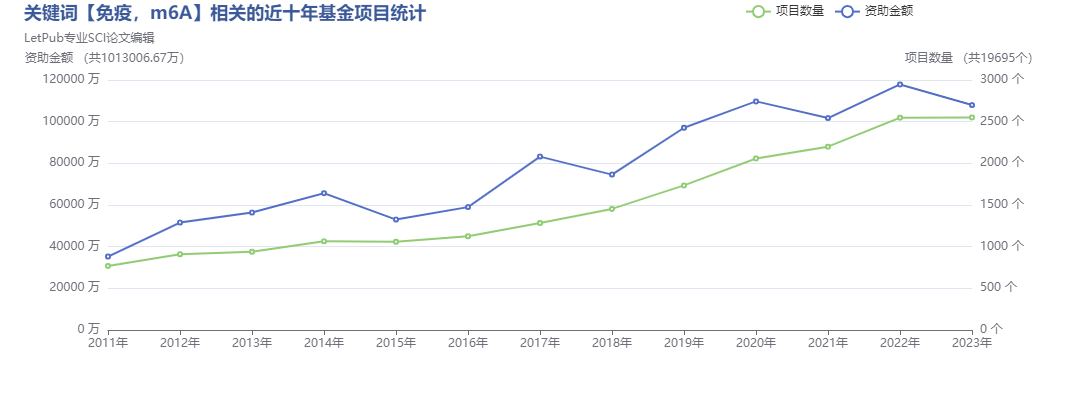
图1.关键词【免疫、m6A】相关的近十年基因项目统计
在免疫应答中,m6A修饰的作用尤为重要,它参与调控免疫细胞的发育、功能以及免疫反应的激活[2]。特别是在肿瘤免疫微环境中,m6A修饰被发现可以调节肿瘤细胞与免疫细胞之间的相互作用,影响肿瘤免疫逃逸机制。例如,m6A去甲基化酶FTO通过增强肿瘤细胞的糖酵解代谢,进而抑制T细胞的激活和抗肿瘤功能,揭示了m6A在肿瘤免疫逃逸中的新机制[3]。此外,m6A修饰在天然免疫信号通路中也显示出重要作用。研究发现,病毒感染后,TBK1激酶能够与METTL3相互作用,通过磷酸化METTL3增强其m6A甲基化活性,从而增强机体的抗病毒免疫反应[4]。
这些研究不仅揭示了m6A修饰在免疫调节中的重要作用,而且为开发新的免疫治疗策略提供了潜在靶点。例如,靶向m6A修饰酶或通过小分子抑制剂干预m6A修饰,可能成为增强免疫反应和治疗肿瘤的新途径[5]。因此,m6A和免疫的联合研究不仅在基础科研中占据重要地位,也具有显著的临床应用前景。
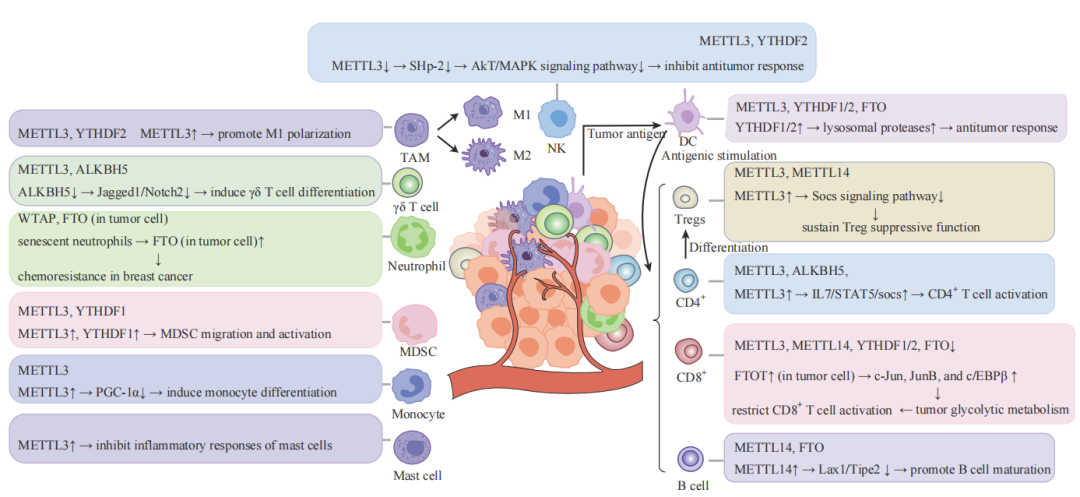
图2.m6A修饰对免疫细胞及肿瘤免疫应答的调控作用
本期就让我们一起看看【m6A】如何调节【免疫】,双热点如何碰撞出火花?
文章一
-
m6A甲基转移酶METTL3在β细胞中的氧化还原调节控制1型糖尿病中的先天免疫反应[6]

-
研究内容:
本文研究了N6-甲基腺苷(m6A)甲基转移酶METTL3在1型糖尿病(T1D)中的作用,特别是在胰岛β细胞中如何通过氧化还原调节控制先天免疫反应。研究发现,在T1D发病初期,METTL3在β细胞中的水平上升,但随着疾病进展迅速下降。METTL3的上调能够通过m6A甲基化调节关键先天免疫介质的mRNA稳定性,从而控制抗病毒先天免疫反应的幅度和持续时间。此外,通过在NOD小鼠模型中延长Mettl3的过表达,可以延缓糖尿病的进展。这些发现揭示了m6A甲基化在调节β细胞先天免疫反应中的重要性,并为开发新的T1D治疗策略提供了潜在靶点。
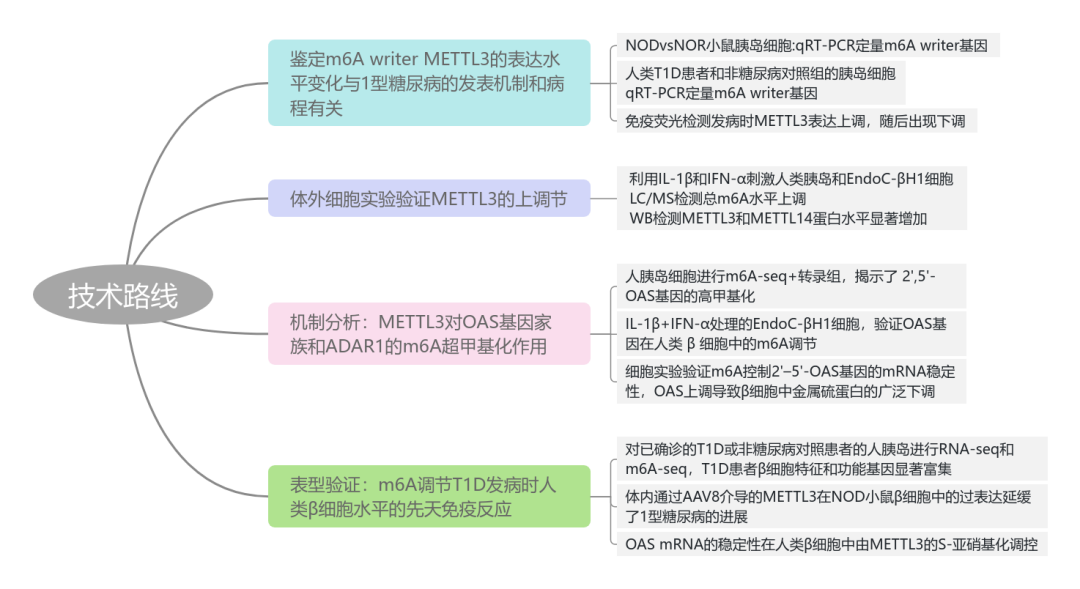
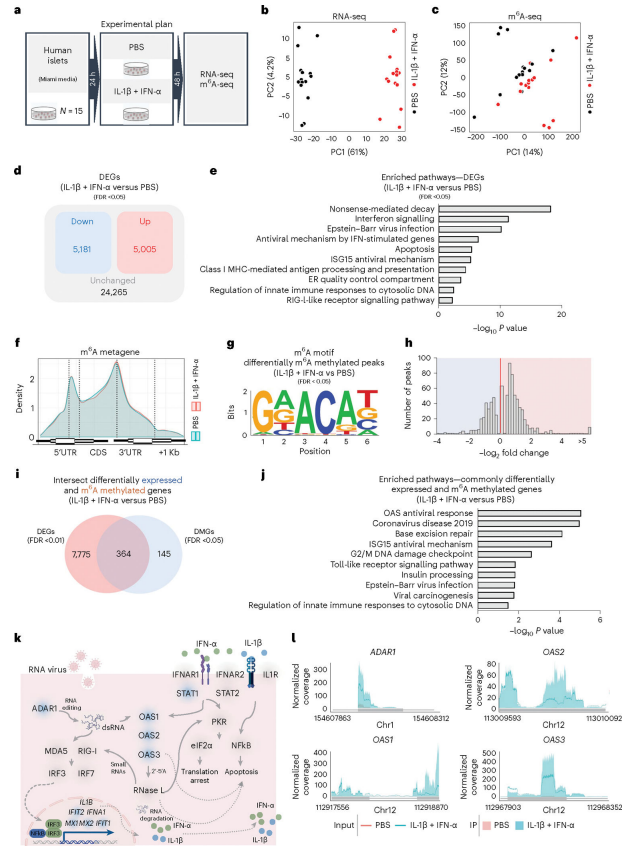
图3.RNA-seq+m6A-seq揭示人类胰岛细胞中2′,5’-OAS基因发生了超甲基化
文章二
-
m6A阅读蛋白YTHDF2通过抑制RIG-I介导的免疫反应促进膀胱癌进展[7]

-
研究内容:
本文主要研究了m6A阅读蛋白YTHDF2在膀胱癌中的作用,发现YTHDF2在膀胱癌中经常性上调,并促进了膀胱癌细胞的增殖和肿瘤生长。研究通过整合RNA-seq和meRIP-seq分析,揭示了RIG-I作为YTHDF2的下游靶标,其中YTHDF2通过结合DDX58 mRNA并介导其m6A依赖性降解来抑制RIG-I。此外,YTHDF2缺乏能够激活先天免疫反应,并增强BCG免疫疗法的效果,表明YTHDF2可能作为膀胱癌治疗的潜在靶点。
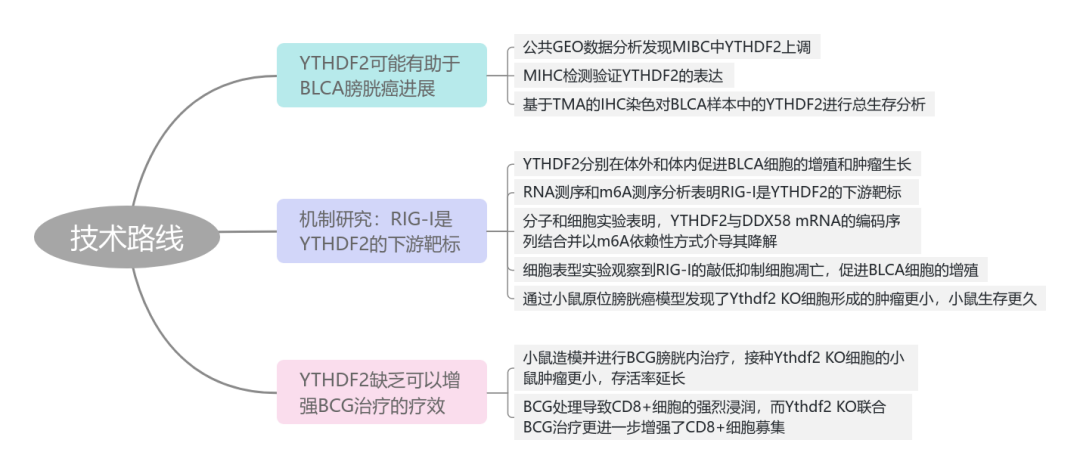
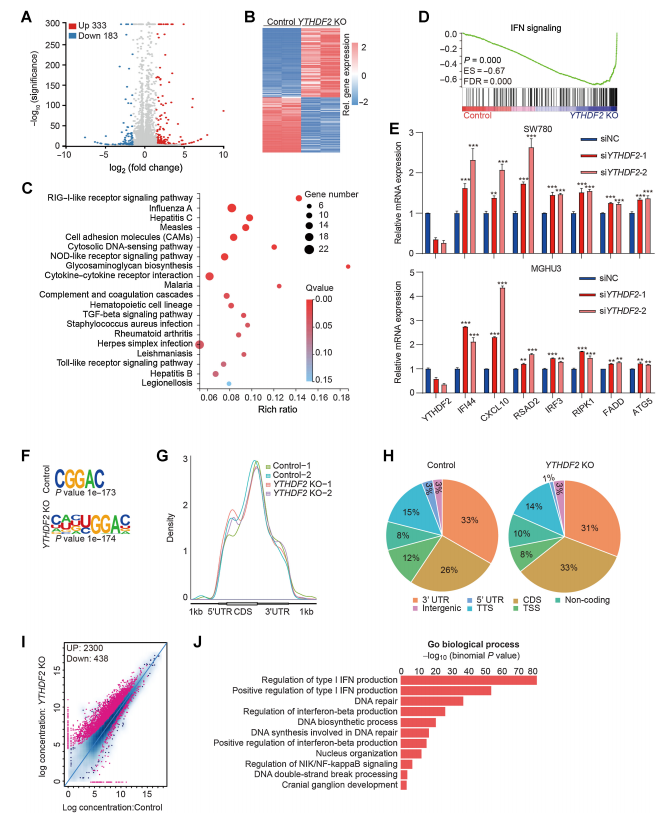
图4.RNA-seq+meRIP-seq鉴定RIG-I是YTHDF2的下游靶标
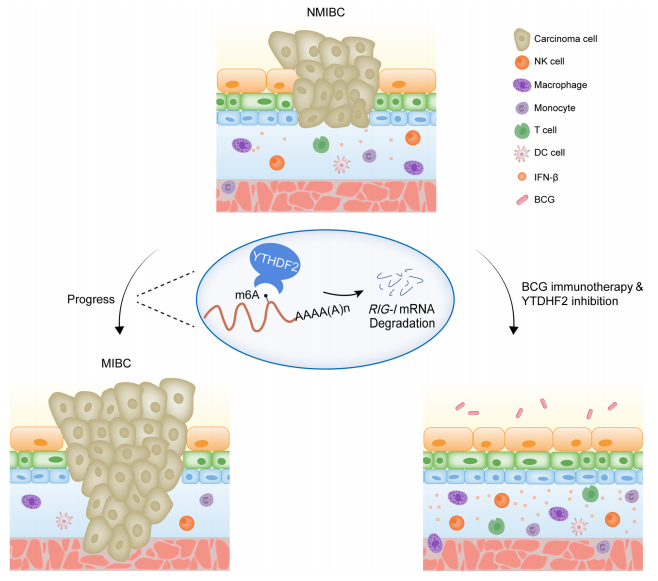
图5.YTHDF2以m6A依赖的方式调控RIG-I mRNA降解从而调控免疫
文章三
-
靶向m6A去甲基酶FTO抑制肝癌的肿瘤发生并增强免疫反应[8]

-
研究内容:
本研究探讨了去甲基化酶FTO在肝细胞癌(HCC)中的作用,发现FTO在HCC中表达上调,并通过促进细胞增殖、迁移、侵袭以及肿瘤生长和转移发挥致癌作用。研究还揭示了FTO的下游靶标GPNMB,发现FTO通过减少GPNMB的m6A修饰,增加其稳定性,进而通过GPNMB包装进入小细胞外囊泡(sEVs)抑制CD8+ T细胞的激活,导致肿瘤免疫逃逸。此外,研究还发现FTO抑制剂CS2能够抑制HCC细胞的致癌功能,并增强对PD-1和索拉非尼治疗的敏感性,表明靶向FTO/m6A/GPNMB轴可能成为HCC治疗的新策略。
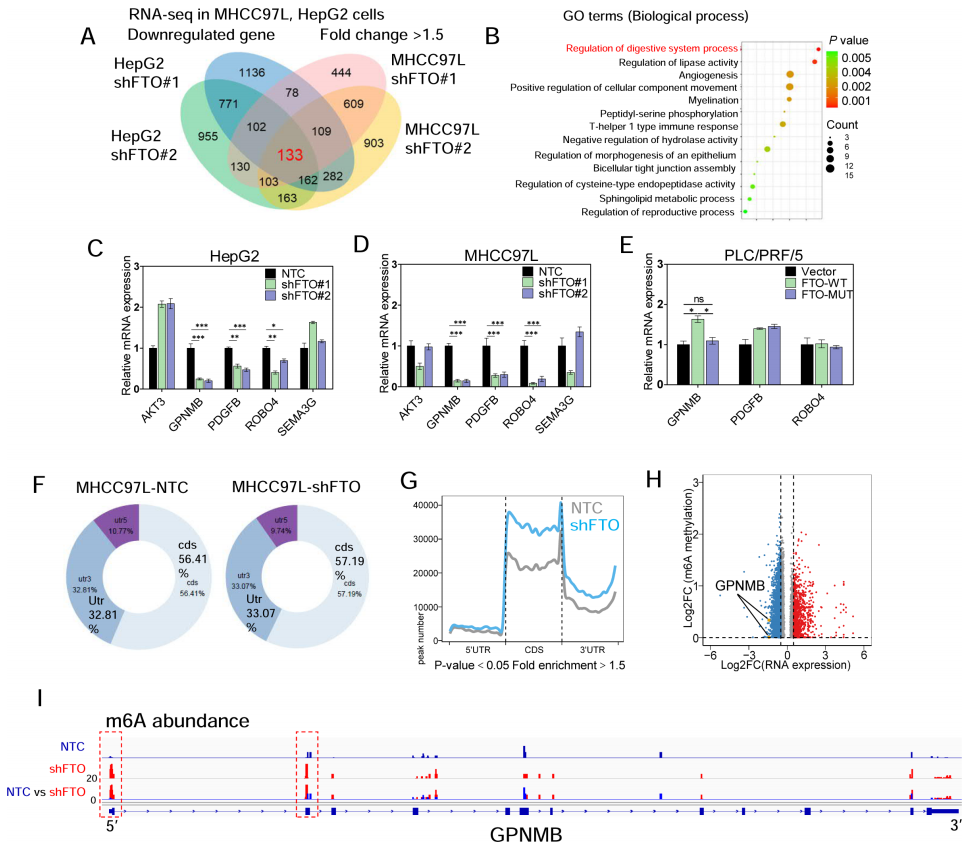
图6.RNA-seq+meRIP-seq确定GPNMB是FTO的下游靶标
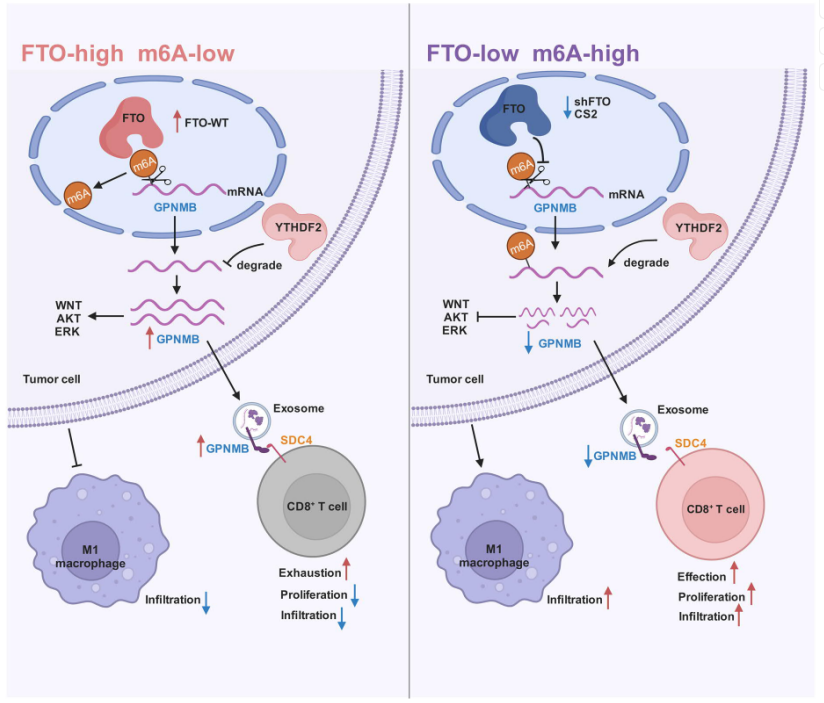
图7.FTO/m6A/GPNMB轴调控机制
总 结
三篇文章分别聚焦于m6A修饰动态调控中的核心组分:甲基转移酶(Writers)、去甲基酶(Erasers)和m6A阅读蛋白(Readers),并分析了它们如何通过精细调控mRNA的m6A修饰来影响免疫细胞的功能和肿瘤细胞的免疫逃逸机制。这些研究不仅强调了m6A修饰在免疫调节中的复杂性和多样性,而且为开发基于m6A修饰的新型免疫治疗策略提供了坚实的科学基础,展现了m6A修饰在肿瘤治疗中的转化潜力,为未来的临床应用开辟了新的道路。
本期的介绍就到这里了,如有相关技术需求,欢迎联系我们。祝大家科研顺利,发文就发CNS~
-
参考文献
【1】Han, D., Liu, J., Chen, C. et al. Anti-tumour immunity controlled through mRNA m6A methylation and YTHDF1 in dendritic cells. Nature 566, 270–274 (2019).
【2】Qiu W, Zhang Q, Zhang R, Lu Y, Wang X, Tian H, Yang Y, Gu Z, Gao Y, Yang X, Cui G, Sun B, Peng Y, Deng H, Peng H, Yang A, Yang YG, Yang P. N6-methyladenosine RNA modification suppresses antiviral innate sensing pathways via reshaping double-stranded RNA. Nat Commun. 2021 Mar 11;12(1):1582. doi: 10.1038/s41467-021-21904-y. PMID: 33707441; PMCID: PMC7952553.
【3】Liu Y, Liang G, Xu H, Dong W, Dong Z, Qiu Z, Zhang Z, Li F, Huang Y, Li Y, Wu J, Yin S, Zhang Y, Guo P, Liu J, Xi JJ, Jiang P, Han D, Yang CG, Xu MM. Tumors exploit FTO-mediated regulation of glycolytic metabolism to evade immune surveillance. Cell Metab. 2021 Jun 1;33(6):1221-1233.e11. doi: 10.1016/j.cmet.2021.04.001. Epub 2021 Apr 27. PMID: 33910046.
【4】Qiu W, Zhang Q, Zhang R, Lu Y, Wang X, Tian H, Yang Y, Gu Z, Gao Y, Yang X, Cui G, Sun B, Peng Y, Deng H, Peng H, Yang A, Yang YG, Yang P. N6-methyladenosine RNA modification suppresses antiviral innate sensing pathways via reshaping double-stranded RNA. Nat Commun. 2021 Mar 11;12(1):1582. doi: 10.1038/s41467-021-21904-y. PMID: 33707441; PMCID: PMC7952553.
【5】ZHOU Haixia, ZHANG Jing. Research progress of m6A methylation modification in regulating tumor immunity[J]. Journal of Shanghai Jiao Tong University (Medical Science), 2024, 44(1): 137-144.
【6】De Jesus DF, Zhang Z, Brown NK, Li X, Xiao L, Hu J, Gaffrey MJ, Fogarty G, Kahraman S, Wei J, Basile G, Rana TM, Mathews C, Powers AC, Parent AV, Atkinson MA, Dhe-Paganon S, Eizirik DL, Qian WJ, He C, Kulkarni RN. Redox regulation of m6A methyltransferase METTL3 in β-cells controls the innate immune response in type 1 diabetes. Nat Cell Biol. 2024 Mar;26(3):421-437. doi: 10.1038/s41556-024-01368-0. Epub 2024 Feb 26. PMID: 38409327; PMCID: PMC11042681.
【7】Zhang L, Li Y, Zhou L, Zhou H, Ye L, Ou T, Hong H, Zheng S, Zhou Z, Wu K, Yan Z, Thiery JP, Cui J, Wu S. The m6A Reader YTHDF2 Promotes Bladder Cancer Progression by Suppressing RIG-I-Mediated Immune Response. Cancer Res. 2023 Jun 2;83(11):1834-1850. doi: 10.1158/0008-5472.CAN-22-2485. PMID: 36939388; PMCID: PMC10236158.
【8】 Chen A, Zhang VX, Zhang Q, Sze KM, Tian L, Huang H, Wang X, Lee E, Lu J, Lyu X, Lee MJ, Wong CM, Ho DW, Ng IO. Targeting the oncogenic m6A demethylase FTO suppresses tumourigenesis and potentiates immune response in hepatocellular carcinoma. Gut. 2024 Jun 5:gutjnl-2024-331903. doi: 10.1136/gutjnl-2024-331903. Epub ahead of print. PMID: 38839271.