《中国上市药品目录集》由国家食品药品监督管理总局以数据库形式发布并实时更新,由CDE负责日常维护和管理。《中国上市药品目录集》收录了在中国批准上市的创新药、改良型新药、化学药品新注册分类的仿制药以及通过质量和疗效一致性评价的药品的具体信息。这个目录集旨在维护公众用药权益,提高药品质量,降低用药负担,并鼓励药物研发创新。
随着政策的更新,在《药品注册管理办法》第十八条对其目录集的名称和收载进行了调整,将《中国上市药品目录集》更名为《新批准上市以及通过仿制药质量和疗效一致性评价的化学药品目录集》,简称为《新批准的化学药品目录集》,但在CDE网络版(数据库)中新批准的化学药品目录集其实就是指化学药品目录集,所以导致有人查找不到,下面笔者就分享两种该药品目录集在线查询方法。
方法一:CDE官网-化学药品目录集数据库查询
化学药品目录集数据库的信息涵盖活性成分及其英文名称、药品名称及其英文名称、商品名称及其英文名称、剂型、给药方式、规格、参比制剂、标准制剂、治疗等效性评价代码、解剖学治疗学及化学分类系统代码(即ATC代码)、药品批准文号或注册证号、上市许可持有人、生产厂商、药品首次批准的日期、上市销售的当前状态,以及药品的收录类别等。
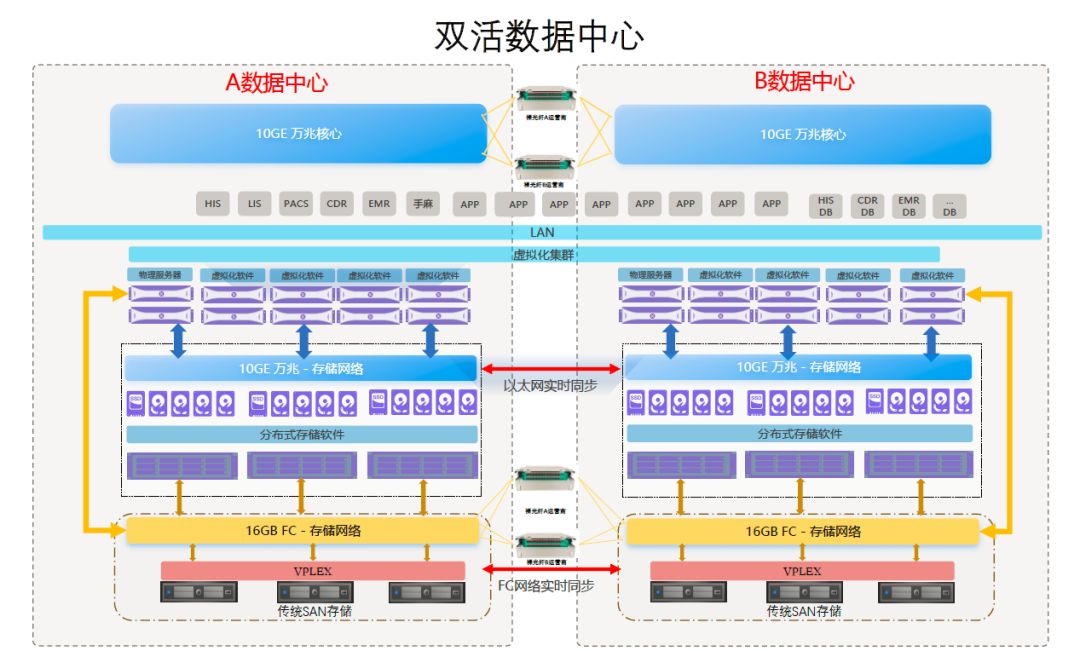
查询路径:CDE官网-->化学药品目录集--> 目录集-->化学药品目录集数据库

图源:CDE官网
药品目录集界面上方为查询条件,默认只显示药品名称和批准文号/注册证号两个查询条件,点击【显示更多查询条件】可展示其它查询条件进行查询。查询条件:包括药品名称(中英文)、批准文号/注册证号、商品名(中英文)、ATC编码、活性成分(中英文)、生产厂商、批准日期、上市许可持有人、规格、上市销售状况、剂型、收录类别、给药途径、参比制剂。
方法二:摩熵医药(原药融云)-中国上市药物目录数据库查询(支持数据下载)
查询路径:摩熵医药官网-->数据库-->一致性评价-->中国上市药物目录数据库

摩熵医药-中国上市药物目录集数据库收录了目前CDE官方符合新注册分类标准的创新药、改良型新药、进口原研药和通过仿制药质量和疗效一致性评价的药品信息9800余条。该目录集数据库实时同步官网更新,支持精确查询和条件筛选,可以通过输入药品活性成分、药品名称、商品名、批准文号/注册证号、上市许可持有人等进行查询,也可以通过上市销售状况、收录类别、参比制剂等条件进行进一步的范围筛选。
该目录集数据库与CDE的目录集数据库相比,除了多了一个数据下载功能外,全部数据库还拥有多个一致性评价关联数据库以及药品研发、上市、销售、市场、原料药、合理用药、生产检验信息相关数据库,为全面的医药信息获取提供便利。

最后说下,被誉为“中国橙皮书”的《中国上市药品目录集》,自2019年3月28日国家药品监督管理局发布《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)发布之日起,《中国上市药品目录集》不再具备指定仿制药参比制剂的功能。