DNA甲基化作为一种关键的表观遗传修饰,已被广泛认为在基因表达调控、细胞分化以及多种疾病的发生发展中扮演着重要角色。DNA甲基化:将甲基基团添加到DNA分子的胞嘧啶上,可以影响基因的活性而不改变DNA序列,这种改变的持久性和可逆性使得甲基化成为表观遗传学研究的热点。
研究者们开发出多种技术来检测DNA甲基化,以期更好地理解生物学功能和调控机制。WGBS长期以来被视为检测DNA甲基化的“金标准”,提供了高分辨率的甲基化图谱。但WGBS在用亚硫酸氢盐处理DNA时,会损伤和降解DNA,这样导致所需样本起始量高。随着新技术的涌现,特别是酶法甲基化测序(EM-seq)的引入,我们拥有了更多的选择来进行DNA甲基化的检测。本期,我们来介绍下DNA甲基化检测技术的新星——酶法甲基化测序(EM-seq)。
No.1 EM-seq技术介绍
2021年,发表在Genome Research上的一项研究提出一个基于酶反应的EM-seq技术[1],该技术可以检测DNA上的5mC和5hmC修饰,且不引入通常与亚硫酸氢盐测序相关的偏差。该技术主要需要3种酶和2次反应。
01.TET2:甲基胞嘧啶双加氧酶2(Tet methylcytosine dioxygenase 2)
02.T4-BGT:T4噬菌体-糖基转移酶(T4-phage beta-glucosyltransferase)
03.APOBEC3A:载脂蛋白B mRNA编辑酶催化亚基3A(apolipoprotein B mRNA editing enzyme catalytic subunit 3A)
-
EM-seq原理和流程
TET2是一种依赖于铁(II)/α-酮戊二酸的双加氧酶,它催化5mC氧化为5hmC,然后是5-甲酰胞嘧啶(5fC),最后是5caC,同时形成二氧化碳和琥珀酸(图1A)。T4-BGT催化TET2形成和基因组的5hmC的糖基化为5-(β-糖基羟甲基)胞嘧啶(5gmc)(图1B)。接下来,APOBEC3A脱氨胞嘧啶,但不脱氨5mC或5hmC的保护形式,从而使它们能够进行区分(图1C)。
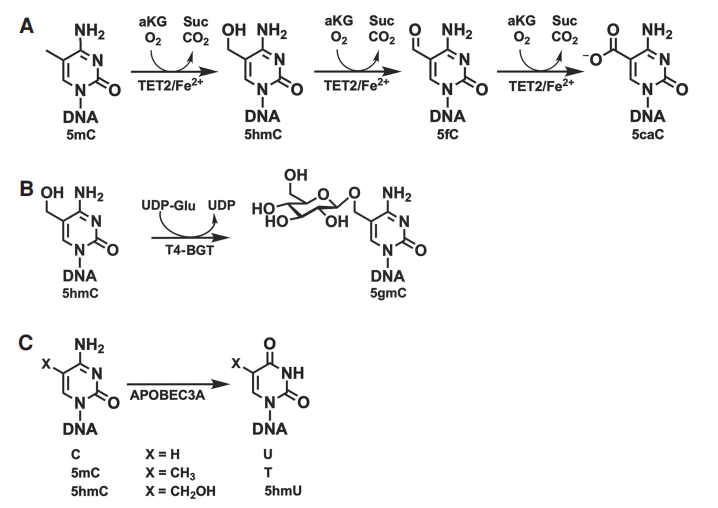
图1:参与5mC和5hmC检测的酶
工作流程:首先由TET2和来自T4噬菌体的葡糖基转移酶T4-BGT将甲基化的胞嘧啶处理为无法被APOBEC3A转化的形式,这和WGBS亚硫酸盐的逻辑相似,甲基化的C无法被转化,而正常无甲基化的C会在APOBEC3A的作用下转化成U,然后在经过测序进行后续的分析。EM-seq通过酶转化的方式能够显著降低DNA损伤,将DNA起始量降低至最低100 pg也可以得到非常稳定的检测结果。

图2:EM-seq的作用机制和工作流程[1]
No.2 技术优势
聊了很多EM-seq的原理和流程,我们来看看EM-seq的技术优势。研究分别使用10、50和200 ng的NA12878基因组DNA制备EM-seq和亚硫酸氢盐文库。
A. 样本起始量低,但文库质量更高
EM-seq文库对所有DNA输入的PCR周期具有更高的文库产量(图2A),产生更少的测序重复,导致更多可用reads,从而增加了有效的基因组覆盖率(图2B)。EM-seq库也比亚硫酸氢盐库产生了更规范化的GC偏倚谱,亚硫酸氢盐库具有“富AT”和“贫GC”谱(图2C)。
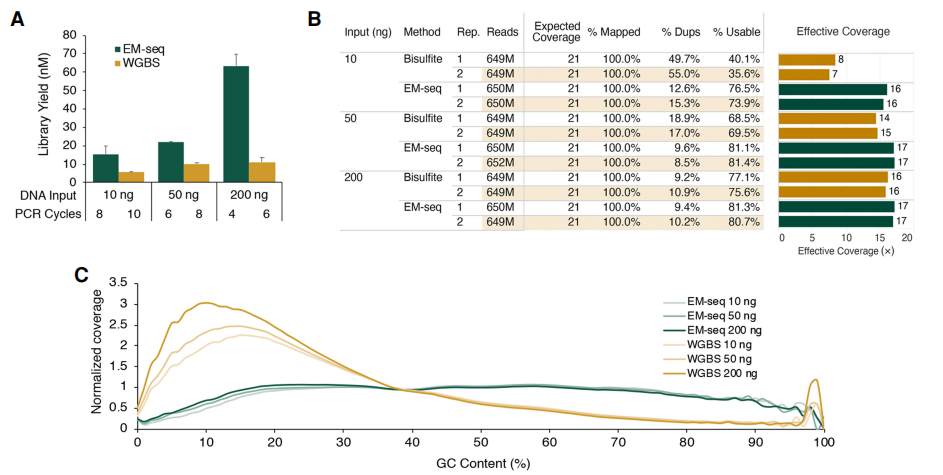
图3:用10 ng、50 ng或200 ng的NA12878DNA制备EM-seq和重亚硫酸盐文库[1]。
低输入量文库的表现与10ng至200ng DNA文库在GC偏差图上的表现相似,显示出均匀的覆盖率,在CpG、CHG和CHH环境中也有相似的全局胞嘧啶甲基化。
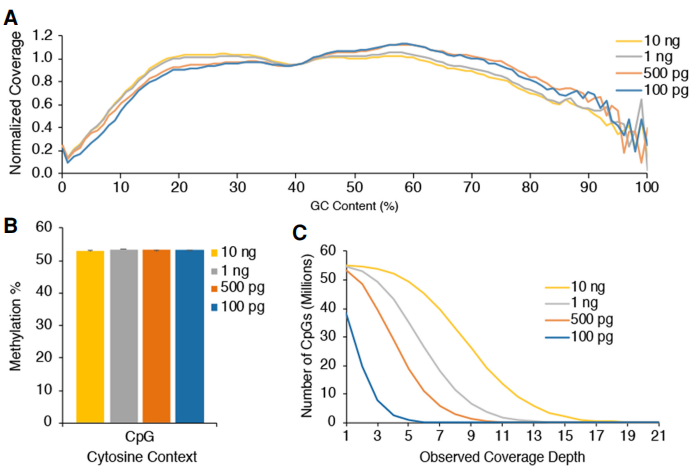
图4:低DNA输入EM-seq文库。
B. EM-seq可准确地表示甲基化
EM-seq和亚硫酸氢盐的NA12878文库在所有DNA输入中具有相似的胞嘧啶甲基化。研究还比较了EM-seq和亚硫酸氢盐文库之间的CpG检测,使用1×到21×的覆盖深度。同样覆盖深度(低深度),EM-seq检测到更多的CpG。
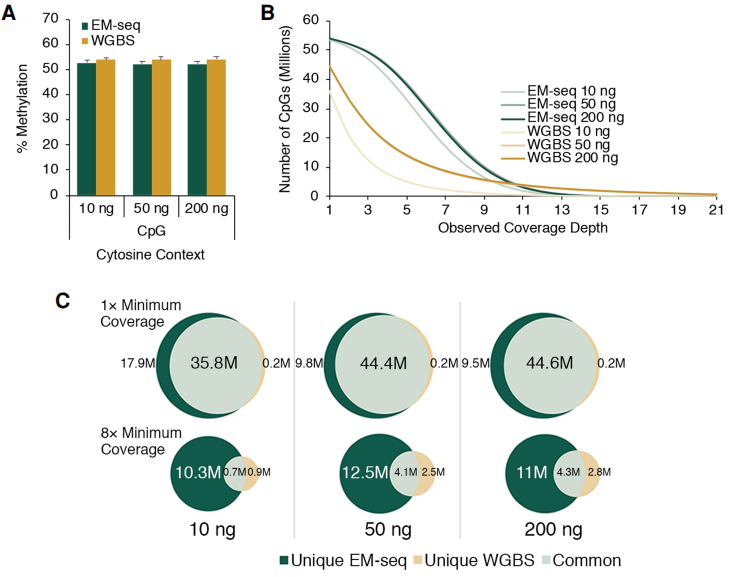
图5:EM-seq准确地表征甲基化
No.3 案例解析
案例一:SPOCD1是piRNA指导的从头DNA甲基化的重要执行者[2]

-
发表期刊:Nature
-
发表时间:2020
-
研究物种:小鼠精原细胞
-
主要内容:
在哺乳动物中,从体细胞获取生殖系面临一个至关重要的挑战:需要擦除和重置基因组的甲基化。在雄性生殖系中,RNA导向的DNA甲基化使年轻、活跃的转座子沉默。PIWI蛋白MIWI2(PIWIL4)及其相关的PIWI相互作用RNA(piRNA)指导转座子的DNA甲基化。piRNA被认为可以将MIWI2固定在新生的转座子转录本上;然而,MIWI2如何指导转座子的从头甲基化机制仍不甚了解,尽管这对生殖系的永生至关重要。
该研究定义了在小鼠胎儿生殖细胞中进行新基因组甲基化时MIWI2的相互作用组,识别出一个之前未知的MIWI2相关因子SPOCD1,它对年轻转座子的甲基化和沉默是必不可少的。在小鼠中,Spocd1的缺失导致雄性特异性不育,但不影响piRNA的生物合成或MIWI2在细胞核中的定位。SPOCD1是一种核蛋白,其表达仅限于基因组从头甲基化的时期。它在体内与DNMT3L和DNMT3A共同纯化,这些都是新甲基化机制的组成部分,同时也与NURD和BAF染色质重塑复合物的成分相互作用。研究提出了一个模型,MIWI2与新生转座子转录本的结合通过SPOCD1招募抑制性染色质重塑活动和从头甲基化的功能。总之,研究发现了一个之前未被认识到的、对哺乳动物piRNA导向的DNA甲基化至关重要的执行因子。
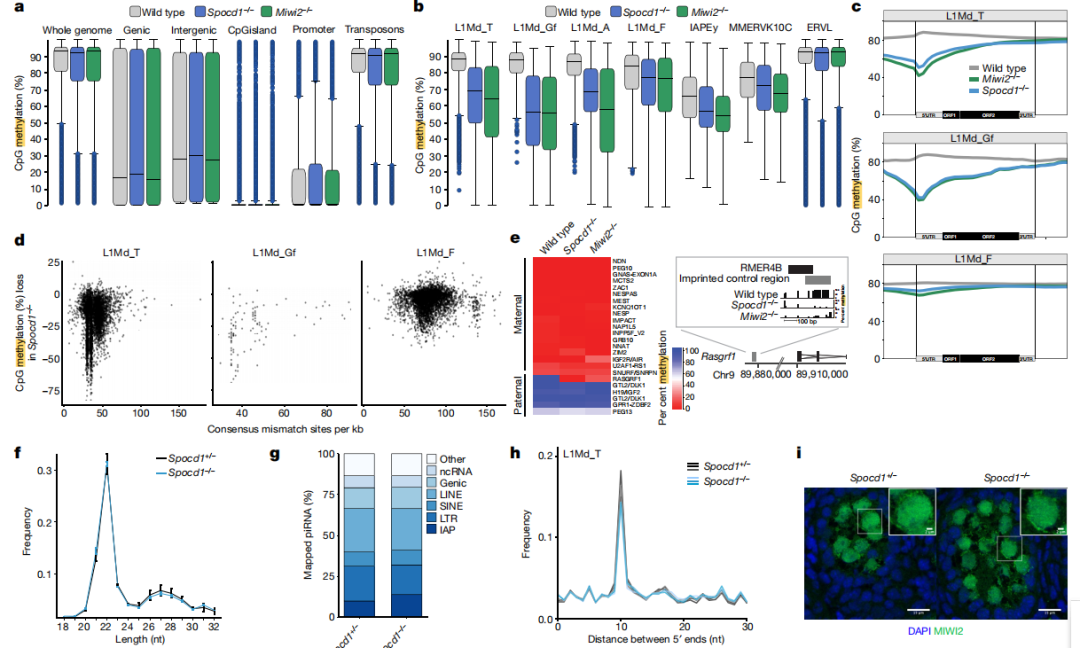
图:SPOCD1是转座因子位点的从头DNA甲基化所必需的,而不是piRNA的表达
循环游离DNA(cfDNA)是一种多样化的核酸片段,主要来源于肿瘤细胞、正常细胞以及胎盘细胞,通常以几十到几百个碱基对的形式存在于血液等体液中。cfDNA的浓度和特征能够随着个体的生理状态或疾病进展而变化,尤其在癌症患者中,它可以作为肿瘤特异性突变的生物标志物,助力非侵入性监测和早期诊断。同时,孕妇体内的cfDNA也为胎儿健康监测提供了新的可能性。与传统组织活检相比,cfDNA检测更安全、便捷,且在体外维持相对稳定,在临床检测上具有较为广泛的应用场景。
此外,cfDNA中的异常甲基化总是与肿瘤细胞中的异常甲基化同时出现,血浆cfDNA中基因异常甲基化具有较高的敏感性和特异性。因此,游离DNA甲基化成为了一种稳定可靠的癌症标志物。酶法转化的EM-seq显著优势在于低投入和低DNA损伤,因此,cfDNA甲基化研究和EM-seq是绝佳的搭档。
案例二:通过浆细胞游离DNA的靶向酶促甲基测序来检测肝细胞癌[3]

-
发表期刊:Clinical Epigenetics
-
发表时间:2023
-
研究物种:外周血cfDNA
-
主要内容:
循环肿瘤DNA携带的表观遗传变异可作为非侵入性液体活检早期检测肝细胞癌(HCC)的生物标志物。然而,传统的甲基化分析方法,即双硫酸盐测序,由于DNA损伤严重的缺点,在少量cfDNA分析中的应用受到限制。
通过温和的酶介导转化,酶甲基测序(EM-seq)非常适合精准测定游离DNA的甲基化水平,为肝细胞癌(HCC)的早期检测提供了机会。甲基化对照组DNA的EM-seq分析显示,将未甲基化的C转化为U的酶促转化效率高于亚硫酸氢盐转化。此外,相对较大比例的未完全转化的EM-seq reads中,包含超过3个未转化的CH位点(CH=CC、CT或CA),这些可以通过过滤去除,从而提高EM-seq甲基化检测的准确性。研究分析了241例HCC、76例肝病和279例正常血浆样本,使用EM-seq和靶向捕获技术测量1595个CpG位点的甲基化值。模型训练确定了283个CpG位点在HCC与非HCC样本之间存在显著的甲基化水平差异。基于这些标记的HCC筛查模型能够有效区分HCC样本和非HCC样本,在测试集中曲线下面积为0.957(sensitivity=90%,specifcity=97%),在不同阶段以及在血清α-胎蛋白/维生素K缺乏II诱导的蛋白阴性样本中表现良好。
如有EM-seq的技术咨询,欢迎联系我们~
-
参考文献
【1】 Vaisvila R, Ponnaluri VKC, Sun Z, Langhorst BW, Saleh L, Guan S, Dai N, Campbell MA, Sexton BS, Marks K, Samaranayake M, Samuelson JC, Church HE, Tamanaha E, Corrêa IR Jr, Pradhan S, Dimalanta ET, Evans TC Jr, Williams L, Davis TB. Enzymatic methyl sequencing detects DNA methylation at single-base resolution from picograms of DNA. Genome Res. 2021 Jun 17;31(7):1280–9. doi: 10.1101
【2】 ZOCH, Ansgar, et al. SPOCD1 is an essential executor of piRNA-directed de novo DNA methylation. Nature, 2020, 584.7822: 635-639.
【3】 GUO, Ping, et al. Hepatocellular carcinoma detection via targeted enzymatic methyl sequencing of plasma cell-free DNA. Clinical Epigenetics, 2023, 15.1: 2.