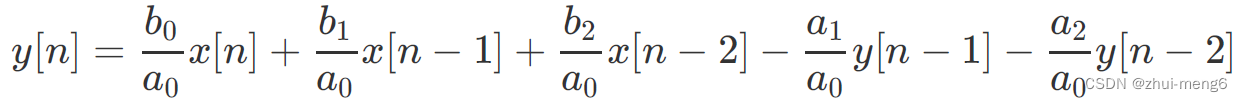“了解衰老是生物医学最重要的目标之一,同时这也是一个非常具有挑战性的问题。”哈佛大学终身教授庄小威说,“造成挑战的原因之一在于大脑非常复杂,细胞种类繁多,许多不同类型的神经元和非神经元细胞形成了复杂的相互作用网络。”
随着年龄的增长,衰老不可避免地在我们的大脑中留下难以逆转的损伤,造成认知能力下降,还可能导致神经退行性疾病。在逐渐衰老的大脑中,细胞经历了怎样的变化?
在大脑细胞中,最受关注的自然是神经元。这些长寿的细胞伴随着我们成长、衰老,在漫长的岁月里积累了大量损伤。神经元的受损可以造成大脑功能的衰退,但这还远远不是故事的全部答案。
事实上。尽管此前的研究表明年龄相关的大脑稳态破坏情况广泛存在于多种细胞类型中,但随着研究的深入,科学家也提出了更多问题。例如,不同细胞类型和细胞状态的分子特征和空间组织如何随着衰老而变化?这些变化与年龄诱导的炎症激活有何关系?年龄诱发的炎症与全身炎症反应有何关系?时至今日,由于人们对于动物不同年龄阶段中大脑结构变化认识并不全面,想要回答这些问题依然存在巨大挑战。
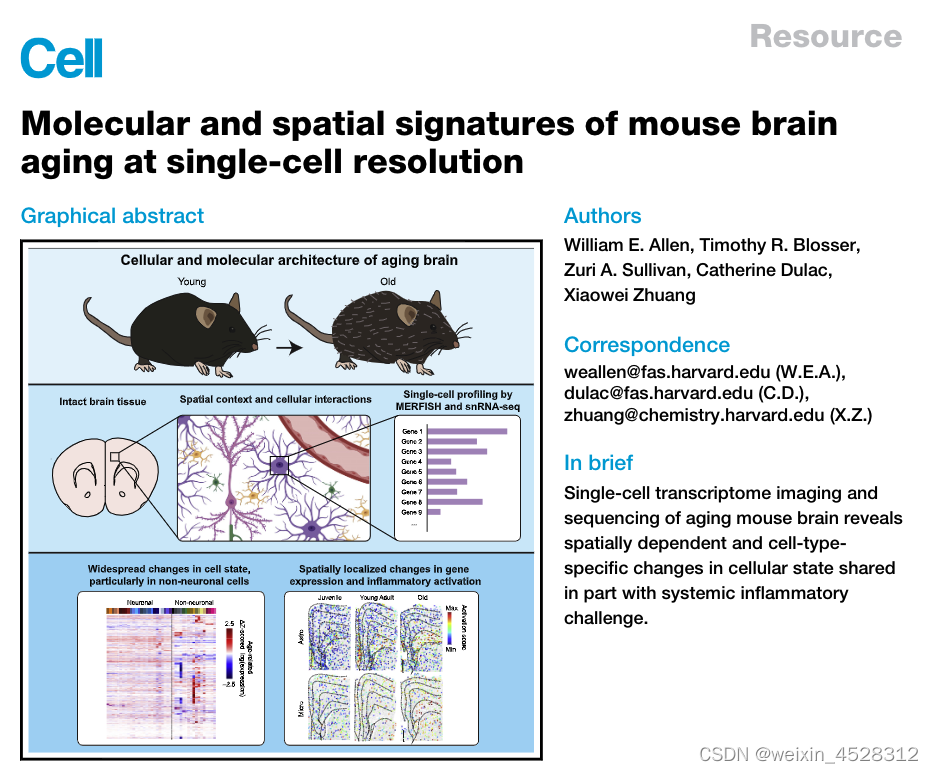
近期,哈佛大学化学及化学生物学教授庄小威和分子与细胞生物学教授 Catherine Dulac 带领课题组展开合作,并于 Cell 期刊上发表研究论文 Molecular and spatial signatures of mouse brain aging at single-cell resolution。本次研究基于一种结合单细胞转录组测序(snRNA-seq)、多重容错荧光原位杂交(MERFISH)的实验方法,针对不同年龄小鼠的额叶皮层和纹状体展开测试,识别并生成了不同年龄哺乳动物的脑内高分辨率细胞图谱。
这些高分辨率细胞图谱揭示并且量化了发生在神经元和非神经元细胞中的年龄相关变化,并且提供衰老过程中胶质细胞和免疫细胞激活的分子和空间特征。与脂多糖(LPS)诱导的炎症变化进行比较,这些证据进一步揭示了由衰老和全身炎症刺激诱导的非神经元细胞激活的未知差异。
衰老和炎症相互促进,加剧大脑损伤
在哺乳动物脑内,正常工作的神经元需要由大量非神经元细胞支持,其中每个细胞均以不同方式维持着组织内稳态。
例如,少突胶质细胞能够为神经元提供代谢支持;星形胶质细胞为神经元提供营养、离子支持并调节突触功能;小胶质细胞能够通过吞噬作用提供免疫监视、突触修剪和碎片清除等。早期研究已经证实,脑损伤、感染和神经变性将会导致这些常驻非神经元细胞产生炎症并且募集外周免疫细胞,这将导致一系列有害作用。
特别值得注意的是,小胶质细胞和星形胶质细胞在感染或损伤期间的反应状态也会在正常衰老过程中出现,这也进一步强调了炎症在衰老相关进程中的作用。
为了进一步探究上述问题的内在机制,研究人员使用结合了单细胞 RNA 测序(snRNA-seq)技术与多重荧光原位杂交技术(MERFISH,Multiplexed Error Robust Fluorescence In Situ Hybridization)的成像方法,针对幼年、成年与老年时期的小鼠额叶皮层和纹状体中约 50,000 个细胞展开监测,从而获得大脑衰老过程中的细胞分子特征和空间组织变化。

不同年龄小鼠额叶皮层和纹状体的空间分辨单细胞转录组学分析
对比分析显示,与神经元相比,大量与炎症相关的基因在衰老小鼠大脑中的非神经元细胞中高度表达,这些细胞表现出更加显著且差异化的年龄相关变化。相较于神经元而言,这些非神经细胞的细胞状态、基因表达以及空间关系的变化都更为明显。
进一步的研究指出,相较于神经元集中的灰质组织,在连接着不同脑区的白质中神经胶质细胞和免疫细胞更加活跃。这说明该类帮助维持大脑功能的非神经细胞在衰老进程中已经产生了明显炎症。
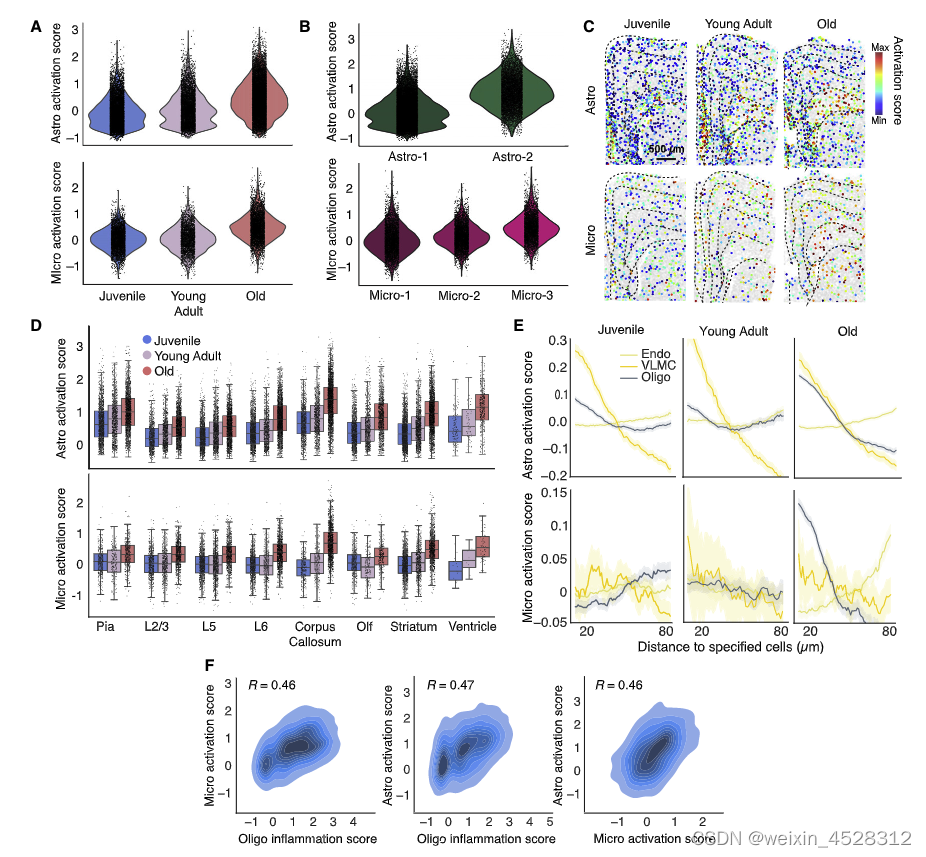
各年龄大脑内的空间异质性和细胞特异性炎症激活特征比较
最后,研究人员通过对小鼠注射脂多糖(LPS)展开对照研究,针对衰老以及系统性炎症反应所引发的大脑炎症进行对比。结果表明,该两种情况既有相似之处,也存在显著差异。其共同点包括:造成多个基因,即促炎细胞因子和激活状态的标志物表达上调;而两者区别在于,仅仅在衰老的大脑中才观察到少突胶质细胞附近的小胶质细胞和星形胶质细胞更加活跃的现象。事实上,这两种过程可能将共同发生,相互促进。当大脑内与衰老相关的内在退行性过程对组织稳态产生局部破坏后,可能使细胞进入促炎状态,然后系统性因素则会继续加剧这种状态。
总体而言,衰老和炎症能够以类似但却差异化的方式影响细胞的基因表达,并且这种表达呈现出空间依赖的特点。研究人员对此表示,想要确定这些共性和差异背后的分子机制,需要对大脑中特定细胞因子和其他信号通路的作用展开进一步的研究。
MERFISH 成为深入观察大脑活动的关键助力
“在此之前,我们已经猜测大脑老化过程可能与炎症有关,”该研究的通讯作者之一 Catherine Dulac 介绍道,认知障碍与衰老进程息息相关,然而早期的研究仅将认知障碍与神经元功能相关联起来。“但如果许多变化发生在非神经元细胞中,那么我们可能已经获知了一个崭新的多步骤过程:其中炎症主要影响非神经元细胞,这将导致神经元功能进一步受损。”
迄今为止,庄小威与 Catherine Dulac 已共同合作了十余年。“多年前,小威的实验室刚刚开发出一种超高分辨率显微技术 STORM,她对于用它来观察大脑功能这件事非常感兴趣,”Dulac 表示,正是这种兴趣促成了双方的首次合作。2010 年,双方合作发表论文,利用 STORM 技术观察大脑中突触形态的变化。

庄小威教授与 Catherine Dulac教授
在此之后,庄小威团队在 2015 年于 Science 杂志发布了 MERFISH 方法。该技术不仅能够在单细胞水平上实现多重化的 RNA 分析,同时还能够揭示它们之间的空间关系。2022 年,庄小威接连在 Science 和 Cell 期刊发布了另外两篇重磅论文,分别针对人类皮层中神经元和非神经元细胞之间的相互作用与单细胞空间分辨表观基因组谱检测方法展开研究,为进一步的工作打下铺垫。
“MERFISH 允许研究人员生成‘基因表达图谱’,并且查看细胞之间的‘邻域关系’,”Catherine Dulac 教授进一步解释道,“通过 MERFISH 技术,人们不仅可以看到不同年龄时期基因表达的变化,还可以明确这种变化在不同细胞类型中所展示出的空间依赖性。”
“了解衰老是生物医学最重要的目标之一,同时这也是一个非常具有挑战性的问题。”针对本次研究,庄小威教授评价道,“造成挑战的原因之一在于大脑非常复杂,细胞种类繁多,许多不同类型的神经元和非神经元细胞形成了复杂的相互作用网络。”
在当前发现的基础之上,Dulac 认为,如果能够打破衰老与炎症之间的作用进程,或将为解决相关疾病带来崭新的思路。“从研究结果来看,如果能够通过健康的生活方式,例如改变饮食、增加运动或其它方法降低与衰老相关的炎症,那么大脑衰老和相关损伤的也可以随之减少。”
论文第一作者,Dulac实验室的博士后William Allen表示:“这项研究为解释随年龄增长而出现的认知衰退和其他大脑功能缺陷提供了新的思路,例如应该更多地关注支持神经元功能或连接的细胞,而不是神经元本身。”接下来,解析白质中的炎症如何影响认知、寻找诱发衰老相关炎症的机制,将是未来研究的重要课题。
小结
研究人员使用空间分辨单细胞转录组学系统地揭示了小鼠额叶皮层和纹状体大脑细胞的分子特征和空间组织在动物整个生命周期中的变化。观察到与神经元相比,非神经元细胞中衰老诱导的变化更为明显,而且在质量上也有所不同,这些非神经元细胞的变化表现出特定的空间模式。提供了与年龄相关的大脑衰退和炎症的关键见解。